Авторы Ларри Г. Арлиан, Марджори, С. Морган
Перевод и адаптация: Ефимов С.Т.
Этот перевод посвящается читателям, которые очень хотели узнать о данном заболевании.
Аннотация
Чесотка является одним из самых ранних заболеваний человека, о причинах возникновения которых было известно с самого начала. Вызывается это заболевание чесоточным клещом Sarcoptes scabiei, который создаёт в эпидермисе кожи человека и многих других млекопитающих ходы и норы. Ранее этот клещ был известен под видовым названием Acarus scabiei (DeGeer, 1778 г.), однако своё нынешнее название он получил с момента основания рода Sarcoptes (Latreille 1802) в 1802 году. Исследования, проведенные за последние 40 лет, значительно расширили понимание биологии данного вида клеща, выражающегося во взаимодействии паразита с хозяином и в механизмах, которые этот клещ использует, чтобы уклоняться от защиты хозяина. В этом обзоре освещаются некоторые из основных достижений в наших знаниях о биологии, геноме, совокупности белков организма паразита, производимых клещом в определённый период времени (протеом) и иммуномодулирующих способностях клещей, которые обеспечивают основу для борьбы с болезнью. Также представлены достижения в разработке диагностического анализа крови для выявления инфекции чесотки и появления вакцины для защиты восприимчивых групп населения от инфицирования или, по крайней мере, ограничения передачи данной болезни.
Происхождение.
Происхождение чесоточного клеща Sarcoptes scabiei, паразитирующего на людях и многих других млекопитающих, неизвестно. Точно так же неизвестно, как давно началась коэволюция S. scabiei с конкретными млекопитающими-хозяевами и как она менялась с течением времени. Однако акарологи и маммологи, использующие молекулярные инструменты и геномную информацию, могут со временем прояснить эти вопросы. Ответы на эти вопросы во многом лежат на плечах биоинформатики, которая взяла лучшее из IT технологий. Пример использования этих технологий я показывал в построении филогенетического древа, к котором в качестве внутренней группы я использовал блох, а в качестве внешней ледничков https://habr.com/ru/post/537708/.
Тем не менее на данном этапе времени мы пока что можем подчеркнуть знания о данных клещах из истории их симбиотических отношений межу людьми и другими животными описанных в различных исторических документах.
Так например, Ронкалли [ 1 ] и Фридман [ 2 ] описывают историю этого заболевания у людей и у других животных с библейских времен до начала 1900-х годов. Самое раннее письменное упоминание о кожном заболевании людей и других млекопитающих, которое могло быть вызвано чесоточным клещом, встречается в книге Левит в Библии (1200 г. до н.э.) [ 1 ]. Согласно Фридману [ 2 ], причинно-следственная связь между чесоточным клещом Acarus scabiei (ныне Sarcoptes scabiei) была установлена уже давно, однако сама сама болезнь у людей была официально открыта Бономо и Честони в 1687 году. Это событие являлось первым в истории медицины, которое охарактеризовало точно известную причину любой из болезней человека. Сегодня чесотка — это забытое, хотя и широко распространенное во всем мире заразное кожное заболевание человека, многих домашних и диких млекопитающих, вызывающее значительную заболеваемость и смертность.
Забытые заболевания— группа инфекционных и паразитарных тропических заболеваний, поражающих преимущественно беднейшие и маргинализированные слои населения в наиболее отсталых регионах стран.
Классификация чесоточных клещей
Первоначально Sarcoptes scabiei был отнесен к роду Acarus и назван Acarus scabiei DeGeer, 1778. По мере развития номенклатуры клещей изменилась и классификация S. scabiei. В настоящее время Sarcoptes scabiei относится к надсемейству Sarcoptoidea и семейству Sarcoptidae вместе со многими другими эктопаразитическими клещами млекопитающих. Среди акарин S. scabiei принадлежат к надотряду Acariformes, отряду Sarcoptiformes, подотряду Oribatida, инфраотряду Desmonomata и гипоотряду Astigmata (наряду с клещами домашней пыли Dermatophagoides farinae , D. pteronyssinus и Euroglyphus maynei ) [ 3 ].
Семейство Sarcoptidae включает три подсемейства (Sarcoptinae, Teinocoptinae и Diabolicoptinae), включающее 16 родов и 118 видов, все из которых являются обитателями кожи млекопитающих [ 4 , 5 ]. Подсемейство Sarcoptinae включает четыре рода Sarcoptes (1 вид), Prosarcoptes (3 вида), Trixacarus (3 вида) и Kutzerocoptes (1 вид). Sarcoptes, и Trixacarus caviae очень похожи, и их можно спутать. Trixacarus caviae — паразит морских свинок, он намного меньше, чем Sarcoptes [ 6 ]. Trixacarus caviae может вызвать зудящий дерматит у людей, которые заражаются данными клещами от зараженных морских свинок в результате контакта с ними [ 7 ]. Помимо различий в размерах, Sarcoptes легко отличается от T. caviae по нескольким другим признакам. Спинные щетинки самок T. caviae простые, в то время как у S. scabiei конусообразные и шиповидные, а спинные чешуйки T. caviae более широкие, чем у S. scabiei, и доходят до задней части идиосомы [ 7 ]. Идиосома – часть тела клеща, образованная в результате слияния части тела содержащую две первые пары ног (проподосома) с частью тела содержащую две пары задних ног (метаподосома) и с брюшком (опистосома). Спинные щетинки sci l1 , и d1 T. Caviae, не пластинчатые как у S. scabiei (рис. 1).
рисунок 1
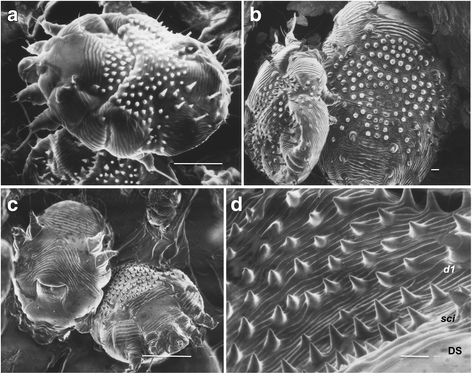
Морфология
Подробные описания S. scabiei со схемами опубликованы ранее [ 2 , 4 , 5 , 6 ]. Вкратце, S. scabiei имеет овальное черепахоподобное тело (идиосома), которое вентрально плоское и дорсально выпуклое (Рис. 1 ). Дорсальная идиосома несет толстые боковые (l) и дорсальные (d) щетинки, кутикулярные шипы и грубые поперечно-гребенчатые кутикулярные бороздки. Дорсальные щетинки sci, l1 и d1 пластинчатые (рис. 1).
Все ноги у самок и самцов короткие и щетинистые (рис. 1 , 2 ). Ноги III и IV у обоих полов не выходят за латерально-задний край идиосомы, в то время как ноги I и II выходят за передний край идиосомы с лапкой, на которой находится стебельчатый эмподиум (одна из структур для перемещения в пространстве), который заканчивается подушечкой (рис. 2а ). . Ноги IV самцов также несут эмподиум на стебле, который заканчивается подушечкой. Все остальные ноги самцов и самок (III и IV ноги самок и III ноги самцов) оканчиваются длинными щетинками. Все концевые сегменты ног обоих самцов и самок имеют клешни (рис. 2). На концевых сегментах I, II, III и IV ног самок имеются два шпорцевидных когтя. У самцов два шпорцевидных когтя на I, II и III ногах и по одному на ноге IV.
Рис. 2
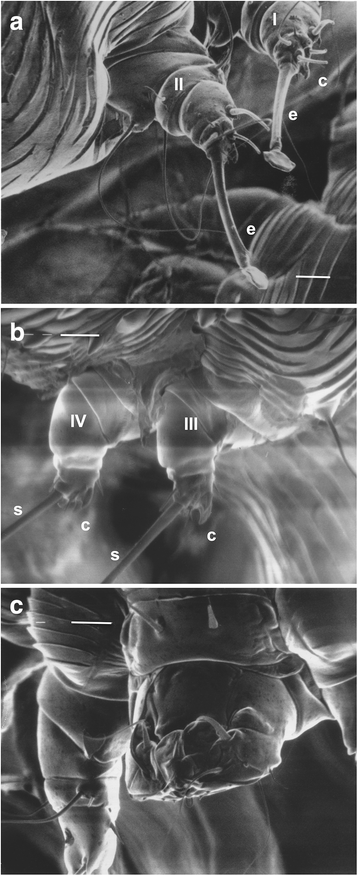
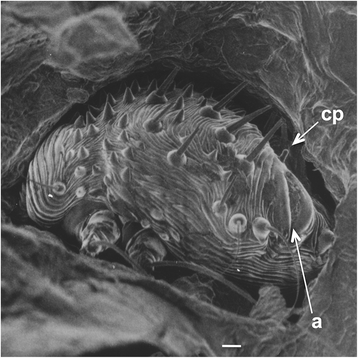
Гнатосома (capitalum) состоит из коротких толстых хелицер и педипальп (рис. 2c ). Анальное отверстие у самок является задним / дорсальным, а копулятриса («предвагина») в форме соска расположена спереди от анального отверстия (рис. 3 ). Средняя сырая и сухая масса самок составляет 5,62 ± 1,25 мкг и 2,8 ± 0,86 мкг соответственно [ 8 ]. Самцы намного мельче: влажный вес 1,49 ± 0,59 мкг и сухой вес 0,39 ± 0,16 мкг [ 8 ].
Рис. 3
Животные модели для изучения биологии чесоточного клеща
Отсутствие возможности получить большое количество S. scabiei var. hominis от человека приводит к ограничениям исследований биологии чесоточных клещей человека. Для решения этой проблемы иногда берут чесоточную корку (норвежская чесотка) от пациента с этой болезнью, чтобы получить большое количество клещей для дальнейших исследований. Таким образом, многие биологические исследования (исследования о взаимодействиях паразита с хозяином, иммунологические, протеомные и геномные исследования) должны опираться на данные из популяции чесоточных клещей, полученных с животных и модельных животных-хозяев, таких как кролики или свиньи. Если возможно прямое сравнение видов, то сравнивают var. canis и var. Hominis поскольку они имеют сходную биологию.
В настоящее время доступны две группы модельных животных для изучения взаимодействий (паразит-хозяин), распространения чесоточных клещей, а также их иммуномодулирующей способности. Этими группами моделей являются кролики/собаки и свиньи. Благодаря ним за последние 30 лет мы получили большую часть знаний о чесоточных клещах. Модель кроличьей / собачьей чесотки была разработана много лет назад [ 9]. Однако неясно, является ли эта модель межвидовой моделью, ведь вполне может оказаться, что эта модель на самом деле внутривидовая (кролик / кролик).
Первоначальным источником чесоточного клеща, использованного для экспериментального заражения кроликов, были бродячие собаки. Но эти собаки могли быть инфицированы от диких кроликов, на которых собаки охотились в дикой среде (переход от добычи к хищнику обсуждается в разделе «Переход от одного вида к другому»). Легкость, с которой лабораторные кролики были заражены клещами, собранными у бродячих собак, предполагает эту возможность, но к сожалению, нет никакого способа узнать о происхождении этих изъятых от собак клещей. Другая модель, использованная в более поздних исследованиях, предполагает использование клещей свиней (var. Suis ) и свиней-хозяев [ 10 ].
Жизненный цикл
Стадии развития S. scabiei состоят из яйца, личинки, протонимфы, тритонимфы и взрослой особи. Этот жизненный цикл типичен для других астигматидных клещей. Существует значительная разница в заявленной продолжительности жизненного цикла S. scabiei var. hominis. Сообщаемая продолжительность жизненного цикла чесоточных клещей человека составляет от 12 до 17 дней [ 11 ], от 17 до 21 дня [ 12 ], от 7 до 10 дней [ 13 ], от 9 до 15 дней [ 14 ] и около 15 дней [ 2]. ]. В исторической опубликованной литературе предполагается, что самки откладывают 40–50 или более яиц в течение 26–40 дней [ 2 ].
Систематическое исследование жизненного цикла S. scabiei var. In vivo . canis с использованием модели кролика сообщил, что продолжительность от яйца до взрослой особи составляет от 10 до 13 дней [ 15 ]. Личинки выходили из яиц через 50–53 ч инкубации. Продолжительность личиночной стадии составляла примерно 3–4 дня, тогда как для протонимфальной и тритонимфальной стадий она составляла примерно 2–3 дня для каждой стадии жизни. Сопоставимые периоды жизненного цикла в 10–15 дней приводятся для var. suis у свиней [ 16 ].
Причины различий в заявленной продолжительности жизненного цикла S. scabiei неизвестны. Вариации, вероятно, связаны с трудностью наблюдения за их развитием в коже in vivo (исследование на животном, включая человека; in vitro исследование в пробирке, в чашке петри). Различные методы наблюдения, используемые для получения этой информации, различные условия температуры и относительной влажности во время периодов наблюдения, а также наблюдение за чесоточными клещами от разных хозяев могут иметь способствующие факторы.
Поиск хозяина
Клещи Sarcoptes scabiei ищут источник стимулов, исходящих от хозяина, когда они находятся вне хозяина, но в непосредственной близости от него. Такое поведение может облегчить им поиск нового хозяина, если они вытеснены из старого в результате переполнения и загрязнения среды оного. Таким образом, прямой контакт с зараженным хозяином может не потребоваться для людей и других млекопитающих, достаточно чтобы S. Scabiei были рядом. Источником чесотки у человека могут быть живые клещи в постельных принадлежностях, мебели, игрушках и в одежде. Sarcoptes scabiei var. hominis однажды были извлечены из мусорных баков в доме престарелых [ 17 ]. Для диких и домашних млекопитающих источником заражения чесоточными клещами могут служить общие места днёвок или общие места для ночлега, стойла в сараях и загонах.
Эксперименты, проведенные с использованием var. canis , показали, что самки клещей, размещенные на металлической проволоке (диаметром 1 мм, расположенной перпендикулярно хозяину и касающейся хозяина) на разном расстоянии от хозяина, шли по проволоке к хозяину [ 18 ]. Более 68% протестированных самок клещей двигались к хозяину при размещении на расстоянии 4,9 см (1,93 дюйма) от него, а 100% перемещались в этом направлении при размещении на расстоянии 4,2 см (1,65 дюйма). Около 20% испытываемых клещей мигрировали к хозяину при размещении на расстоянии 11,2 см (4,41 дюйма). Таким образом, способность воспринимать хозяина и реагировать на него уменьшается с увеличением расстояния от источника. В этих экспериментах стимулом для паразита, который вызывал у него реакцию к поиску прокормителя, мог быть запах тела и тепло хозяина, и/ или CO 2 при выдохе.
Дополнительные эксперименты показали, что клещи будут искать источник теплового стимула без присутствия хозяина [ 18]. Более 83% самок клещей искали источник тепла на расстоянии 5,6 см (2,2 дюйма). Однако самки одинаково (по 50% на каждом участке) реагировали как на искусственный тепловой стимул, так и на запах кожи хозяина, когда им предлагался выбор из двух одновременно и в непосредственной близости (2,5 см = 1 дюйм) к стимулам. На расстоянии 6,5 см (4,41 дюйма) от обоих стимулов 38% клещей выбрали стимулы от живого хозяина, 5% выбрали искусственный тепловой стимул при температуре 32 °C и 57% не выбирали ни того, ни другого, что предполагало, что запах хозяина был более сильным аттрактантом, чем тепло, когда оба стимула предлагались вместе. В других экспериментах с двумя вариантами содержания веществ в воздухе чесоточные клещи выбирали воздух, содержащий запах хозяина, а не там, где был CO2, поэтому CO2 не требуется для индуцирования реакции.
Mellanby et al. [ 19 ] отметили, что S. scabiei var. hominis, помещенный в температурный градиент от 20 ° C до 30 ° C, демонстрировал аналогичную термотаксическую реакцию. Sarcoptes scabiei var. hominis, помещенные ниже 24 ° C, перемещались в более горячую часть градиента. Клещи не перемещались в районы с температурой ниже 24 ° C.
Эти эксперименты ясно показывают, что чесоточные клещи в окружающей среде рядом с хозяином воспринимают стимулы (запах, температуру тела) от хозяина и будут искать источник хозяина.
Фотопроводимость
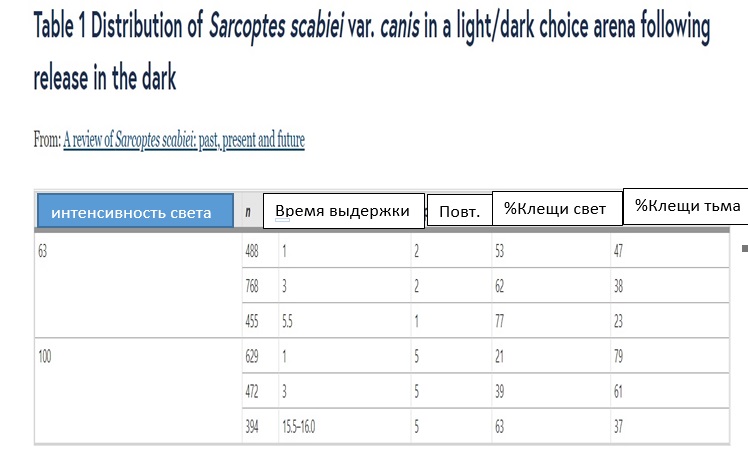
Способность обнаруживать свет и его интенсивность могут быть важными факторами наряду с запахом хозяина и высокой температурой тела при обнаружении хозяина чесоточными клещами. Фотоответ у чесоточного клеща широко не исследовался. Sarcoptes scabiei var. hominis ранее не реагировал (положительно или отрицательно) на световой раздражитель, хотя никаких данных представлено не было [ 19 ]. Напротив, S. scabiei var. canis привлекает люминесцентный потолочный светильник при 63 фк (678 лм / м 2 ) и 100 фк (1076 лм / м 2 ) (Таблица 1). Большинство клещей, появившихся из-под корки кожи, покрытой чесоткой, скорее мигрировали на свет, чем оставались в темноте.
Таблица 1 Распространение Sarcoptes scabiei var. canis на поле выбора света / темноты после выпуска этих клещей в темноту
Выживание вне хозяина
Контакт с инфицированным хозяином обычно считается основным способом заражения человека чесоткой. Эта идея во многом основана на исследованиях Мелланби [ 11 ], который обнаружил, что из 272 протестированных человек во время сна в кроватях ранее используемых сильно инфицированными пациентами только 4 человека в конечном счёте заразились чесоткой. Однако роль выживаемости клещей вне организма-хозяина и их инфекционная способность в передаче чесотки никогда широко не исследовались. Способность чесоточных клещей выживать и оставаться заразными вдали от хозяина является ключевым фактором заражения хозяев от клещей в окружающей среде.
Популяции животных S. scabiei являются подходящими моделями для определения выживаемости и сохранения инфекционности клещей в среде обитания хозяина. В исследовании Arlian et al. [ 20 ] мы обнаружили, что S. scabiei var. canis выживали в течение недели при температуре 15 ° C (59 ° F) и относительной влажности (RH) выше 75% (рис. 4 ). При более высокой температуре 25 ° C (77 ° F) самки выживали 1-2 дня при всех тестируемых RH (рис. 4).). Время выживания самцов вне хозяина было намного короче, чем у самок. Эти исследования показали, что обычно более высокие температуры резко сокращают время выживания при любой влажности. В этом исследовании клещи явно умирали от обезвоживания из-за своей неспособности поддерживать водный баланс (вопрос будет рассмотрен позже). Более высокая относительная влажность и температура ниже 20 ° C позволили увеличить время выживания.
Рис. 4
![Наблюдаемое время достижения 100% смертности в испытываемых популяциях самок S. scabiei var. canis, которые были подвержены воздействию определенных колебаний температур с относительной влажностью (RH). Количество клещей в каждой тестовой группе колебалось от 8 до 26. Данные из [ 20 ] Наблюдаемое время достижения 100% смертности в испытываемых популяциях самок S. scabiei var. canis, которые были подвержены воздействию определенных колебаний температур с относительной влажностью (RH). Количество клещей в каждой тестовой группе колебалось от 8 до 26. Данные из [ 20 ]](https://habrastorage.org/getpro/habr/upload_files/c2e/d68/10e/c2ed6810e23de0fb339474c9b2a83936.png)
С другой стороны, голодные самки клещей S. scabiei var. hominis могут выживать 19 дней при 10 ° C и относительной влажности 97%, 8 дней при 10 ° C и 25% относительной влажности [ 20 ]. Sarcoptes scabiei var. hominis , которых держали вне организма хозяина с чередующимися 12-часовыми периодами при 4 ° C или 10 ° C и 95% относительной влажности и комнатных условиях (21 ° C и 45% RH) в течение 4 дней, оставались заразными и все равно могли проникать через кожу кролика [ 20 ].
Замораживание может быть одним из способов убийства чесоточного клеща в таких предметах, как мягкие и твердые игрушки, маленькие подушки и постельные принадлежности. Замораживание самок var. canis при температуре -25 ° C и относительной влажности 50% в течение 1,5 ч привели к 100% гибели. После 1 часа замораживания 23% испытуемых клещей выжили, но они более не смогли проникать под кожу хозяина [ 20 ]. Неизвестно, как долго эти клещи могут выжить при температуре от -15 ° C до -17 ° C, т.е. температуре обычной домашней морозильной камеры.
Mellanby et al. [ 19 ] определили точку термической смерти чесоточных клещей. Самки подвергались воздействию различных температур в течение 10 и 30 мин при относительной влажности 0–90%. Летальные температуры составляли 49 ° C (120 ° F) за 10 минут и 47,5 ° C (117,5 ° F) за 30 минут. После извлечения из организма-хозяина они обнаружили, что выживаемость составила 84,7, 30,5, 6,8, 1,7 и 0% в течение 1, 2, 3, 4 и 5 дней воздействия, соответственно, при 21,0–25,5 ° C и относительной влажности 90%. Выживаемость при 24–25 ° C и относительной влажности 30% составила 63,5, 6,8 и 0% после 1, 2 и 3 дней воздействия, соответственно. Однако 61, 52, 35, 30 и 26% клещей выживали 5, 6, 7, 9 и 11 дней соответственно при относительной влажности 90%, и лишь немногие клещи смогли выживать 14 дней. Напротив, только 4 и 2% клещей выжили спустя 2 и 4 дня соответственно при относительной влажности 30%. Таким образом, высокая относительная влажность и низкая температура также продлевают выживание клеща без хозяина. Клещи действительно проявляли некоторую способность выдерживать отрицательные температуры. Все испытываемые клещи выживали 2 дня при 0 ° C, а 28,6% выживали 8 дней.
Продолжение следует.
Ссылки на источники
-
1.
Roncalli RA. The history of scabies in veterinary and human medicine from biblical to modern times. Vet Parasitol. 1987;25(2):193–8.
-
2.
Friedman R. The story of scabies. New York: Froben Press; 1947.
-
3.
Zhang ZQ. Animal biodiversity: an outline of higher-level classification and survey of taxonomic richness. Zootaxa. 2011;3148:237.
-
4.
Bochkov AV. A review of mammal-associated Psoroptidia (Acariformes: Astigmata). Acarina. 2010;18:99–260.
-
5.
Klompen H. Phylogenetic relationships in the mite family Sarcoptidae (Acari: Astigmata). Misc Publ Univ Michigan Mus Zool. 1992;180:1–155.
-
6.
Fain A. Etude de la variabilite de Sarcoptes scabiei avec une revision des Sarcoptidae. Acta Zool Pathol Antverp. 1968;47(1):1–196.
-
7.
Kummel BA, Estes SA, Arlian LG. Trixacarus caviae infestation of guinea pigs. J Am Vet Med Assoc. 1980;177(9):903–8.
-
8.
Arlian LG, Runyan RA, Vyszenski-Moher DL. Water balance and nutrient procurement of Sarcoptes scabiei var. canis (Acari: Sarcoptidae). J Med Entomol. 1988;25(1):64–8.
-
9.
Arlian LG, Runyan RA, Estes SA. Cross infestivity of Sarcoptes scabiei. J Am Acad Dermatol. 1984;10(6):979–86.
-
10.
Mounsey K, Ho MF, Kelly A, Willis C, Pasay C, Kemp DJ, et al. A tractable experimental model for study of human and animal scabies. PLoS Negl Trop Dis. 2010;4(7):e756.
-
11.
Mellanby K. The development of symptoms, parasitic infection and immunity in human scabies. Parasitology. 1944;35(4):197.
-
12.
Heilesen B. Studies on Acarus scabiei and scabies. Rosenkilde & Bagger: Copenhagen; 1946.
-
13.
Munro JW. Report of scabies investigation. J R Army Med Corp. 1919;33:1–41.
-
14.
Van Neste D, Mrena E, Marchal G. Life cycle of scabies mite (Sarcoptes scabiei¨C11Cvar.¨C12Chominis) studied by scanning electron microscopy (author’s transl). Ann Dermatol Venereol. 1981;108(4):355–61.
-
15.
Arlian LG, Vyszenski-Moher DL. Life cycle of¨C13CSarcoptes scabiei¨C14Cvar.¨C15Ccanis. J Parasitol. 1988;74(3):427–30.
-
16.
Ljunggren EL. Molecular analysis of¨C16CSarcoptes scabiei. Uppsala: Dept. of Biomedical Sciences and Veterinary Public Health, Swedish University of Agricultural Sciences; 2005.
-
17.
Arlian LG, Estes SA, Vyszenski-Moher DL. Prevalence of¨C17CSarcoptes scabiei¨C18Cin the homes and nursing homes of scabietic patients. J Am Acad Dermatol. 1988;19(5,Pt1):806–11.
-
18.
Arlian LG, Runyan RA, Sorlie LB, Estes SA. Host-seeking behavior of¨C19CSarcoptes scabiei. J Am Acad Dermatol. 1984;11(4,Pt1):594–8.
-
19.
Mellanby K, Johnson CG, Bartley WC, Brown P. Experiments on the survival and behavior of the itch mite¨C20CSarcoptes scabiei¨C21CDeG var.¨C22Chominis. Bull Entomol Res. 1942;33:267–71.
-
20.
Arlian LG, Runyan RA, Achar S, Estes SA. Survival and infectivity of¨C23CSarcoptes scabiei¨C24Cvar.¨C25Ccanis¨C26Cand var.¨C27Chominis. J Am Acad Dermatol. 1984;11(2,Pt1):210–5.
-
21.
Wharton GW, Richards AG. Water vapor exchange kinetics in insects and acarines. Annu Rev Entomol. 1978;23:309–28.
-
22.
Arlian LG, Veselica MM. Reevaluation of the humidity requirements of the house dust mite¨C28CDermatophagoides farinae¨C29C(Acari: Pyroglyphidae). J Med Entomol. 1981;18(4):351–2.
-
23.
Arlian LG. Water balance and humidity requirements of house dust mites. Exp Appl Acarol. 1992;16:15–35.
-
24.
Van Neste D, Lachapelle JM. Host-parasite relationships in hyperkeratotic (Norwegian) scabies: pathological and immunological findings. Br J Dermatol. 1981;105(6):667–78.
-
25.
Van Neste D. Intraepidermal localization of scabies mites overlooked? J Am Acad Dermatol. 1984;10(4):676–7.
-
26.
Estes SA, Kummel B, Arlian L. Experimental canine scabies in humans. J Am Acad Dermatol. 1983;9(3):397–401.
-
27.
Rapp CM, Morgan MS, Arlian LG. Presence of host immunoglobulin in the gut of¨C30CSarcoptes scabiei¨C31C(Acari: Sarcoptidae). J Med Entomol. 2006;43(3):539–42.
-
28.
Morgan MS, Arlian LG. Enzymatic activity in extracts of allergy-causing astigmatid mites. J Med Entomol. 2006;43(6):1200–7.
-
29.
Arlian LG, Vyszenski-Moher DL. Response of¨C32CSarcoptes scabiei¨C33Cvar.¨C34Ccanis¨C35C(Acari: Sarcoptidae) to lipids of mammalian skin. J Med Entomol. 1995;32(1):34–41.
-
30.
Entrekin DL, Oliver JH Jr. Aggregation of the chicken mite,¨C36CDermanyssus gallinae¨C37C(Acari: Dermanyssidae). J Med Entomol. 1982;19(6):671–8.
-
31.
Otieno DA, Hassanali A, Obenchain FA, Sternberg AG, R. Identification of guanine as an assembly pheromone of ticks. Insect Sci Appl. 1985;6(3):667–70.
-
32.
Sonenshine DE. Tick pheremones. In: Anonymous biology of ticks. New York: Oxford University Press; 1991. p. 331–69.
-
33.
Sonenshine DE, Silverstein RM, West JR. Occurrence of sex attractant pheromone, 2,6-dichlorophenol, in relation to age and feeding in American dog tick,¨C38CDermacentor variabilis¨C39C(Say) (Acari: Ixodidae). J Chem Ecol. 1984;10(1):95–100.
-
34.
Sonenshine DE. Pheromones and other semiochemicals of the acari. Annu Rev Entomol. 1985;30:1–28.
-
35.
Arlian LG, Vyszenski-Moher DL. Responses of¨C40CSarcoptes scabiei¨C41C(Acari: Sarcoptidae) to nitrogenous waste and phenolic compounds. J Med Entomol. 1996;33(2):236–43.
-
36.
Arlian LG, Morgan MS, Neal JS. Modulation of cytokine expression in human keratinocytes and fibroblasts by extracts of scabies mites. Am J Trop Med Hyg. 2003;69(6):652–6.
-
37.
Mullins JS, Arlian LG, Morgan MS. Extracts of¨C42CSarcoptes scabiei¨C43Cde Geer downmodulate secretion of IL-8 by skin keratinocytes and fibroblasts and of GM-CSF by fibroblasts in the presence of proinflammatory cytokines. J Med Entomol. 2009;46(4):845–51.
-
38.
Hajnicka V, Kocakova P, Slavikova M, Slovak M, Gasperik J, Fuchsberger N, et al. Anti-interleukin-8 activity of tick salivary gland extracts. Parasite Immunol. 2001;23(9):483–9.
-
39.
Deruaz M, Frauenschuh A, Alessandri AL, Dias JM, Coelho FM, Russo RC, et al. Ticks produce highly selective chemokine binding proteins with antiinflammatory activity. J Exp Med. 2008;205(9):2019–31.
-
40.
Vancova I, Hajnicka V, Slovak M, Kocakova P, Paesen GC, Nuttall PA. Evasin-3-like anti-chemokine activity in salivary gland extracts of ixodid ticks during blood-feeding: a new target for tick control. Parasite Immunol. 2010;32(6):460–3.
-
41.
Morgan MS, Arlian LG. Response of human skin equivalents to¨C44CSarcoptes scabiei. J Med Entomol. 2010;47:877–83.
-
42.
Morgan MS, Arlian LG, Markey MP.¨C45CSarcoptes scabiei¨C46Cmites modulate gene expression in human skin equivalents. PLoS One. 2013;8(8):e71143.
-
43.
Elder BL, Arlian LG, Morgan MS.¨C47CSarcoptes scabiei¨C48C(Acari: Sarcoptidae) mite extract modulates expression of cytokines and adhesion molecules by human dermal microvascular endothelial cells. J Med Entomol. 2006;43(5):910–5.
-
44.
Elder BL, Arlian LG, Morgan MS. Modulation of human dermal microvascular endothelial cells by¨C49CSarcoptes scabiei¨C50Cin combination with proinflammatory cytokines, histamine, and lipid-derived biologic mediators. Cytokine. 2009;47(2):103–11.
-
45.
Arlian LG, Morgan MS, Neal JS. Extracts of scabies mites (Sarcoptidae:¨C51CSarcoptes scabiei) modulate cytokine expression by human peripheral blood mononuclear cells and dendritic cells. J Med Entomol. 2004;41(1):69–73.
-
46.
Walton SF, Pizzutto S, Slender A, Viberg L, Holt D, Hales BJ, et al. Increased allergic immune response to¨C52CSarcoptes scabiei¨C53Cantigens in crusted¨C54Cversus¨C55Cordinary scabies. Clin Vaccine Immunol. 2010;17(9):1428–38.
-
47.
Arlian LG, Morgan MS, Paul CC. Evidence that scabies mites (Acari: Sarcoptidae) influence production of interleukin-10 and the function of T-regulatory cells (Tr1) in humans. J Med Entomol. 2006;43(2):283–7.
-
48.
Holt DC, Fischer K, Allen GE, Wilson D, Wilson P, Slade R, et al. Mechanisms for a novel immune evasion strategy in the scabies mite¨C56CSarcoptes scabiei: a multigene family of inactivated serine proteases. J Invest Dermatol. 2003;121(6):1419–24.
-
49.
Bergstrom FC, Reynolds S, Johnstone M, Pike RN, Buckle AM, Kemp DJ, et al. Scabies mite inactivated serine protease paralogs inhibit the human complement system. J Immunol. 2009;182(12):7809–17.
-
50.
Fischer K, Langendorf CG, Irving JA, Reynolds S, Willis C, Beckham S, et al. Structural mechanisms of inactivation in scabies mite serine protease paralogues. J Mol Biol. 2009;390(4):635–45.
-
51.
Mika A, Reynolds SL, Mohlin FC, Willis C, Swe PM, Pickering DA, et al. Novel scabies mite serpins inhibit the three pathways of the human complement system. PLoS One. 2012;7(7):e40489.
-
52.
Mika A, Reynolds SL, Pickering D, McMillan D, Sriprakash KS, Kemp DJ, et al. Complement inhibitors from scabies mites promote streptococcal growth — a novel mechanism in infected epidermis? PLoS Negl Trop Dis. 2012;6(7):e1563.
-
53.
Swe PM, Fischer K. A scabies mite serpin interferes with complement-mediated neutrophil functions and promotes staphylococcal growth. PLoS Negl Trop Dis. 2014;8(6):e2928.
-
54.
Swe PM, Reynolds SL, Fischer K. Parasitic scabies mites and associated bacteria joining forces against host complement defence. Parasite Immunol. 2014;36((1)1):585–93.
-
55.
Arlian LG, Fall N, Morgan MS.¨C57CIn vivo¨C58Cevidence that¨C59CSarcoptes scabiei¨C60C(Acari: Sarcoptidae) is the source of molecules that modulate splenic gene expression. J Med Entomol. 2007;44(6):1054–63.
-
56.
Lalli PN, Morgan MS, Arlian LG. Skewed Th1/Th2 immune response to¨C61CSarcoptes scabiei. J Parasitol. 2004;90(4):711–4.
-
57.
Rider SD, Morgan MS, Arlian LG. Draft genome of the scabies mite. Parasit Vectors. 2015;8:585.
-
58.
Mofiz E, Holt DC, Seemann T, Currie BJ, Fischer K, Papenfuss AT. Genomic resources and draft assemblies of the human and porcine varieties of scabies mites,¨C62CSarcoptes scabiei¨C63Cvar.¨C64Chominis¨C65Cand var.¨C66Csuis. Gigascience. 2016;5(1):23-016-0129-2.
-
59.
Mofiz E, Seemann T, Bahlo M, Holt D, Currie BJ, Fischer K, et al. Mitochondrial genome sequence of the scabies mite provides insight into the genetic diversity of individual scabies infections. PLoS Negl Trop Dis. 2016;10(2):e0004384.
-
60.
Pagel Van Zee J, Geraci NS, Guerrero FD, Wikel SK, Stuart JJ, Nene VM, et al. Tick genomics: the¨C67CIxodes¨C68Cgenome project and beyond. Int J Parasitol. 2007;37((1)2):1297–305.
-
61.
Jeyaprakash A, Hoy MA. The nuclear genome of the phytoseiid¨C69CMetaseiulus occidentalis¨C70C(Acari: Phytoseiidae) is among the smallest known in arthropods. Exp Appl Acarol. 2009;47(4):263–73.
-
62.
Grbic M, Van Leeuwen T, Clark RM, Rombauts S, Rouze P, Grbic V, et al. The genome of¨C71CTetranychus urticae¨C72Creveals herbivorous pest adaptations. Nature. 2011;479(7374):487–92.
-
63.
Chan TF, Ji KM, Yim AK, Liu XY, Zhou JW, Li RQ, et al. The draft genome, transcriptome, and microbiome of¨C73CDermatophagoides farinae¨C74Creveal a broad spectrum of dust mite allergens. J Allergy Clin Immunol. 2015;135(2):539–48.
-
64.
Morgan MS, Arlian LG, Rider SD Jr, Grunwald WC Jr, Cool DR. A proteomic analysis of¨C75CSarcoptes scabiei¨C76C(Acari: Sarcoptidae). J Med Entomol. 2016;53(3):553–61.
-
65.
Arlian LG, Morgan MS, Rider SD Jr.¨C77CSarcoptes scabiei: genomics to proteomics to biology. Parasit Vectors. 2016;9:380.
-
66.
Walton SF, Currie BJ, Kemp DJ. A DNA fingerprinting system for the ectoparasite¨C78CSarcoptes scabiei. Mol Biochem Parasitol. 1997;85(2):187–96.
-
67.
Walton SF, Choy JL, Bonson A, Valle A, McBroom J, Taplin D, et al. Genetically distinct dog-derived and human-derived¨C79CSarcoptes scabiei¨C80Cin scabies-endemic communities in northern Australia. Am J Trop Med Hyg. 1999;61(4):542–7.
-
68.
Zhao Y, Cao Z, Cheng J, Hu L, Ma J, Yang Y, et al. Population identification of¨C81CSarcoptes hominis¨C82Cand¨C83CSarcoptes canis¨C84Cin China using DNA sequences. Parasitol Res. 2015;114(3):1001–10.
-
69.
Zahler M, Essig A, Gothe R, Rinder H. Molecular analyses suggest monospecificity of the genus¨C85CSarcoptes¨C86C(Acari: Sarcoptidae). Int J Parasitol. 1999;29(5):759–66.
-
70.
Berrilli F, D’Amelio S, Rossi L. Ribosomal and mitochondrial DNA sequence variation in¨C87CSarcoptes¨C88Cmites from different hosts and geographical regions. Parasitol Res. 2002;88(8):772–7.
-
71.
Gu XB, Yang GY. A study on the genetic relationship of mites in the genus¨C89CSarcoptes¨C90C(Acari: Sarcoptidae) in China. Int J Acarol. 2008;34:183–90.
-
72.
Alasaad S, Soglia D, Spalenza V, Maione S, Soriguer RC, Perez JM, et al. Is ITS-2 rDNA suitable marker for genetic characterization of¨C91CSarcoptes¨C92Cmites from different wild animals in different geographic areas? Vet Parasitol. 2009;159(2):181–5.
-
73.
Amer S, El Wahab TA, Metwaly Ael N, Ye J, Roellig D, Feng Y, et al. Preliminary molecular characterizations of¨C93CSarcoptes scabiei¨C94C(Acari: Sarcoptidae) from farm animals in Egypt. PLoS One. 2014;9(4):e94705.
-
74.
Walton SF, Dougall A, Pizzutto S, Holt D, Taplin D, Arlian LG, et al. Genetic epidemiology of¨C95CSarcoptes scabiei¨C96C(Acari: Sarcoptidae) in northern Australia. Int J Parasitol. 2004;34(7):839–49.
-
75.
Andriantsoanirina V, Ariey F, Izri A, Bernigaud C, Fang F, Guillot J, et al. Wombats acquired scabies from humans and/or dogs from outside Australia. Parasitol Res. 2015;114(6):2079–83.
-
76.
Andriantsoanirina V, Ariey F, Izri A, Bernigaud C, Fang F, Charrel R, et al.¨C97CSarcoptes scabiei¨C98Cmites in humans are distributed into three genetically distinct clades. Clin Microbiol Infect. 2015;21(12):1107–14.
-
77.
Alasaad S, Soglia D, Sarasa M, Soriguer RC, Perez JM, Granados JE, et al. Skin-scale genetic structure of¨C99CSarcoptes scabiei¨C100Cpopulations from individual hosts: empirical evidence from Iberian ibex-derived mites. Parasitol Res. 2008;104(1):101–5.
-
78.
Alasaad S, Oleaga A, Casais R, Rossi L, Min AM, Soriguer RC, et al. Temporal stability in the genetic structure of¨C101CSarcoptes scabiei¨C102Cunder the host-taxon law: empirical evidences from wildlife-derived¨C103CSarcoptes¨C104Cmite in Asturias, Spain. Parasit Vectors. 2011;4:151.
-
79.
Alasaad S, Fickel J, Rossi L, Sarasa M, Bena-Tez-Camacho B, Granados JE, et al. Applicability of major histocompatibility complex DRB1 alleles as markers to detect vertebrate hybridization: a case study from Iberian ibex x domestic goat in southern Spain. Acta Vet Scand. 2012;54(1):56.
-
80.
Rasero R, Rossi L, Soglia D, Maione S, Sacchi P, Rambozzi L, et al. Host taxon-derived¨C105CSarcoptes¨C106Cmite in European wild animals revealed by microsatellite markers. Biol Conserv. 2010;143(5):1269–77.
-
81.
Alasaad S, Rossi L, Heukelbach J, Perez JM, Hamarsheh O, Otiende M, et al. The neglected navigating web of the incomprehensibly emerging and re-emerging¨C107CSarcoptes¨C108Cmite. Infect Genet Evol. 2013;17:253–9.
-
82.
Renteria-Solis Z, Min AM, Alasaad S, Muller K, Michler FU, Schmaschke R, et al. Genetic epidemiology and pathology of raccoon-derived¨C109CSarcoptes¨C110Cmites from urban areas of Germany. Med Vet Entomol. 2014;28(Suppl 1):98–103.
-
83.
Oleaga A, Alasaad S, Rossi L, Casais R, Vicente J, Maione S, et al. Genetic epidemiology of¨C111CSarcoptes scabiei¨C112Cin the Iberian wolf in Asturias, Spain. Vet Parasitol. 2013;196(3–4):453–9.
-
84.
Gakuya F, Rossi L, Ombui J, Maingi N, Muchemi G, Ogara W, et al. The curse of the prey:¨C113CSarcoptes¨C114Cmite molecular analysis reveals potential prey-to-predator parasitic infestation in wild animals from Masai Mara, Kenya. Parasit Vectors. 2011;4:193.
-
85.
Gakuya F, Ombui J, Maingi N, Muchemi G, Ogara W, Soriguer RC, et al. Sarcoptic mange and cheetah conservation in Masai Mara (Kenya): epidemiological study in a wildlife/livestock system. Parasitology. 2012;139((1)2):1587–95.
-
86.
Mellanby K. Scabies. 2nd ed. E. W. Classey: Hampton, UK; 1972.
-
87.
Arlian LG, Feldmeier H, Morgan MS. The potential for a blood test for scabies. PLoS Negl Trop Dis. 2015;9:e0004188.
-
88.
Arlian LG, Vyszenski-Moher DL, Gilmore AM. Cross-antigenicity between¨C115CSarcoptes scabiei¨C116Cand the house dust mite,¨C117CDermatophagoides farinae¨C118C(Acari: Sarcoptidae and Pyroglyphidae). J Med Entomol. 1988;25(4):240–7.
-
89.
Arlian LG, Vyszenski-Moher DL, Ahmed SG, Estes SA. Cross-antigenicity between the scabies mite,¨C119CSarcoptes scabiei, and the house dust mite,¨C120CDermatophagoides pteronyssinus. J Invest Dermatol. 1991;96(3):349–54.
-
90.
Arlian LG, Rapp CM, Morgan MS. Resistance and immune response in scabies-infested hosts immunized with¨C121CDermatophagoides¨C122Cmites. Am J Trop Med Hyg. 1995;52(6):539–45.
-
91.
Falk ES, Dale S, Bolle R, Haneberg B. Antigens common to scabies and house dust mites. Allergy. 1981;36(4):233–8.
-
92.
Walton SF, Slender A, Pizutto S, Mounsey KE, Opresecu F, Thomas WR, et al. Analysis of IgE binding patterns to house dust mite allergens in scabies-endemic communities: insights for both diseases. Clin Exp Allergy. 2015;45((1)2):1868–72.
-
93.
Arlian LG, Morgan MS, Estes SA, Walton SF, Kemp DJ, Currie BJ. Circulating IgE in patients with ordinary and crusted scabies. J Med Entomol. 2004;41(1):74–7.
-
94.
Arlian LG, Morgan MS, Arends JJ. Immunologic cross-reactivity among various strains of¨C123CSarcoptes scabiei. J Parasitol. 1996;82(1):66–72.
-
95.
Hollanders W, Vercruysse J, Raes S, Bornstein S. Evaluation of an enzyme-linked immunosorbent assay (ELISA) for the serological diagnosis of sarcoptic mange in swine. Vet Parasitol. 1997;69(1–2):117–23.
-
96.
Kessler E, Matthes HF, Schein E, Wendt M. Detection of antibodies in sera of weaned pigs after contact infection with¨C124CSarcoptes scabiei¨C125Cvar.¨C126Csuis¨C127Cand after treatment with an antiparasitic agent by three different indirect ELISAs. Vet Parasitol. 2003;114(1):63–73.
-
97.
Lowenstein M, Kahlbacher H, Peschke R. On the substantial variation in serological responses in pigs to¨C128CSarcoptes scabiei¨C129Cvar.¨C130Csuis¨C131Cusing different commercially available indirect enzyme-linked immunosorbent assays. Parasitol Res. 2004;94(1):24–30.
-
98.
van der Heijden HM, Rambags PG, Elbers AR, van Maanen C, Hunneman WA. Validation of ELISAs for the detection of antibodies to¨C132CSarcoptes scabiei¨C133Cin pigs. Vet Parasitol. 2000;89(1–2):95–107.
-
99.
Rambozzi L, Menzano A, Lavin S, Rossi L. Biotin-avidin amplified ELISA for detection of antibodies to¨C134CSarcoptes scabiei¨C135Cin chamois (Rupicapra¨C136Cspp.). Vet Res. 2004;35(6):701–8.
-
100.
Leon-Vizcaino L, Ruiz de Ybanez MR, Cubero MJ, Ortiz JM, Espinosa J, Perez L, et al. Sarcoptic mange in Spanish ibex from Spain. J Wildl Dis. 1999;35(4):647–59.
-
101.
Fernandez-Moran J, Gomez S, Ballesteros F, Quiros P, Benito JL, Feliu C, et al. Epizootiology of sarcoptic mange in a population of Cantabrian chamois (Rupicapra pyrenaica parva) in northwestern Spain. Vet Parasitol. 1997;73(1–2):163–71.
-
102.
Rodriguez-Cadenas F, Carbajal-Gonzalez MT, Fregeneda-Grandes JM, Aller-Gancedo JM, Huntley JF, Rojo-Vazquez FA. Development and evaluation of an antibody ELISA for sarcoptic mange in sheep and a comparison with the skin-scraping method. Prev Vet Med. 2010;96(1–2):82–92.
-
103.
Bornstein S, Frossling J, Naslund K, Zakrisson G, Morner T. Evaluation of a serological test (indirect ELISA) for the diagnosis of sarcoptic mange in red foxes (Vulpes vulpes). Vet Dermatol. 2006;17(6):411–6.
-
104.
Curtis CF. Evaluation of a commercially available enzyme-linked immunosorbent assay for the diagnosis of canine sarcoptic mange. Vet Rec. 2001;148(8):238–9.
-
105.
Haas N, Wagemann B, Hermes B, Henz BM, Heile C, Schein E. Crossreacting IgG antibodies against fox mite antigens in human scabies. Arch Dermatol Res. 2005;296(7):327–31.
-
106.
Oleaga A, Casais R, Gonzalez-Quiros P, Prieto M, Gortazar C. Sarcoptic mange in red deer from Spain: improved surveillance or disease emergence? Vet Parasitol. 2008;154(1–2):103–13.
-
107.
Casais R, Prieto M, Balseiro A, Solano P, Parra F, Martin Alonso JM. Identification and heterologous expression of a¨C137CSarcoptes scabiei¨C138CcDNA encoding a structural antigen with immunodiagnostic potential. Vet Res. 2007;38(3):435–50.
-
108.
Millan J, Casais R, Delibes-Mateos M, Calvete C, Rouco C, Castro F, et al. Widespread exposure to¨C139CSarcoptes scabiei¨C140Cin wild European rabbits (Oryctolagus cuniculus) in Spain. Vet Parasitol. 2012;183(3–4):323–9.
-
109.
He R, Shen N, Lin H, Gu X, Lai W, Peng X, et al. Molecular characterization of calmodulin from¨C141CSarcoptes scabiei. Parasitol Int. 2017;66(2):1–6.
-
110.
Mattsson JG, Ljunggren EL, Bergstrom K. Paramyosin from the parasitic mite¨C142CSarcoptes scabiei: cDNA cloning and heterologous expression. Parasitology. 2001;122(Pt 5):555–62.
-
111.
Kuhn C, Lucius R, Matthes HF, Meusel G, Reich B, Kalinna BH. Characterisation of recombinant immunoreactive antigens of the scab mite¨C143CSarcoptes scabiei. Vet Parasitol. 2008;153(3–4):329–37.
-
112.
Angelone-Alasaad S, Molinar Min A, Pasquetti M, Alagaili AN, D’Amelio S, Berrilli F, et al. Universal conventional and real-time PCR diagnosis tools for¨C144CSarcoptes scabiei. Parasit Vectors. 2015;8:587.
-
113.
Mounsey KE, McCarthy JS. Treatment and control of scabies. Curr Opin Infect Dis. 2013;26(2):133–9.
-
114.
Liu X, Walton S, Mounsey K. Vaccine against scabies: necessity and possibility. Parasitology. 2014;141(6):725–32.
-
115.
Thomas J, Peterson GM, Walton SF, Carson CF, Naunton M, Baby KE. Scabies: an ancient global disease with a need for new therapies. BMC Infect Dis. 2015;15:250.
-
116.
Arlian LG, Morgan MS, Vyszenski-Moher DL, Stemmer BL.¨C145CSarcoptes scabiei: the circulating antibody response and induced immunity to scabies. Exp Parasitol. 1994;78(1):37–50.
-
117.
Arlian LG, Morgan MS, Rapp CM, Vyszenski-Moher DL. The development of protective immunity in canine scabies. Vet Parasitol. 1996;62(1–2):133–42.
-
118.
Tarigan S, Huntley JF. Failure to protect goats following vaccination with soluble proteins of¨C146CSarcoptes scabiei: evidence for a role for IgE antibody in protection. Vet Parasitol. 2005;133(1):101–9.
-
119.
Arlian LG, Rapp CM, Vyszenski-Moher DL, Morgan MS.¨C147CSarcoptes scabiei: histopathological changes associated with acquisition and expression of host immunity to scabies. Exp Parasitol. 1994;78(1):51–63.
-
120.
Morgan MS, Arlian LG. Serum antibody profiles of¨C148CSarcoptes scabiei¨C149Cinfested or immunized rabbits. Folia Parasitol (Praha). 1994;41(3):223–7.
-
121.
Harumal P, Morgan M, Walton SF, Holt DC, Rode J, Arlian LG, et al. Identification of a homologue of a house dust mite allergen in a cDNA library from¨C150CSarcoptes scabiei¨C151Cvar.¨C152Chominis¨C153Cand evaluation of its vaccine potential in a rabbit/S. scabiei¨C154CVar.¨C155Ccanis¨C156Cmodel. Am J Trop Med Hyg. 2003;68(1):54–60.
-
122.
Casais R, Granda V, Balseiro A, Del Cerro A, Dalton KP, Gonzalez R, et al. Vaccination of rabbits with immunodominant antigens from¨C157CSarcoptes scabiei¨C158Cinduced high levels of humoral responses and pro-inflammatory cytokines but confers limited protection. Parasit Vectors. 2016;9:435.
-
123.
Uhlir J. Immunization of rabbits with antigens from¨C159CPsoroptes cuniculi, the rabbit scab mite. Folia Parasitol (Praha). 1992;39(4):375–82.
-
124.
Smith WD, Bates P, Pettit DM, Van Den Broek A, Taylor MA. Attempts to immunize sheep against the scab mite,¨C160CPsoroptes ovis. Parasite Immunol. 2002;24(6):303–10.
-
125.
Smith WD, Pettit DM. Immunization against sheep scab: preliminary identification of fractions of¨C161CPsoroptes ovis¨C162Cwhich confer protective effects. Parasite Immunol. 2004;26(6–7):307–14.
-
126.
Gu X, Xie Y, Wang S, Peng X, Lai S, Yang G. Immune response induced by candidate¨C163CSarcoptes scabiei¨C164Cvar.¨C165Ccuniculi¨C166CDNA vaccine encoding paramyosin in mice. Exp Appl Acarol. 2014;63(3):401–12.
-
127.
Normaznah Y, Saniah K, Nazma M, Mak JW, Krishnasamy M, Hakim SL. Seroprevalence of¨C167CSarcoptes scabiei¨C168Cvar.¨C169Ccanis¨C170Cantibodies among aborigines in peninsular Malaysia. Southeast Asian J Trop Med Public Health. 1996;27(1):53–6.
-
128.
Raez-Bravo A, Granados JE, Serrano E, Dellamaria D, Casais R, Rossi L, et al. Evaluation of three enzyme-linked immunosorbent assays for sarcoptic mange diagnosis and assessment in the Iberian ibex,¨C171CCapra pyrenaica. Parasit Vectors. 2016;9:558.
-
129.
Rodriguez-Cadenas F, Carbajal-Gonzalez MT, Fregeneda-Grandes JM, Aller-Gancedo JM, Rojo-Vazquez FA. Clinical evaluation and antibody responses in sheep after primary and secondary experimental challenges with the mange mite¨C172CSarcoptes scabiei¨C173Cvar.¨C174Covis. Vet Immunol Immunopathol. 2010;133(2–4):109–16.
-
130.
Smets K, Vercruysse J. Evaluation of different methods for the diagnosis of scabies in swine. Vet Parasitol. 2000;90(1–2):137–45.
-
131.
Vercruysse J, Geurden T, Peelaers I. Development and Bayesian evaluation of an ELISA to detect specific antibodies to¨C175CSarcoptes scabiei¨C176Cvar.¨C177Csuis¨C178Cin the meat juice of pigs. Vet Rec. 2006;158(15):506–8.
-
132.
Rampton M, Walton SF, Holt DC, Pasay C, Kelly A, Currie BJ, et al. Antibody responses to¨C179CSarcoptes scabiei¨C180Capolipoprotein in a porcine model: relevance to immunodiagnosis of recent infection. PLoS One. 2013;8(6):e65354.
-
133.
Haas C, Rossi S, Meier R, Ryser-Degiorgis MP. Evaluation of a commercial ELISA for the detection of antibodies to¨C181CSarcoptes scabiei¨C182Cin wild boar (Sus scrofa). J Wildl Dis. 2015;51(3):729–33.
-
134.
Davidson RK, Bornstein S, Handeland K. Long-term study of¨C183CSarcoptes scabiei¨C184Cinfection in Norwegian red foxes (Vulpes vulpes) indicating host/parasite adaptation. Vet Parasitol. 2008;156(3–4):277–83.
-
135.
Jakubek EB, Mattsson R, Morner T, Mattsson JG, Gavier-Widen D. Potential application of serological tests on fluids from carcasses: detection of antibodies against¨C185CToxoplasma gondii¨C186Cand¨C187CSarcoptes scabiei¨C188Cin red foxes (Vulpes vulpes). Acta Vet Scand. 2012;54(1):13.
-
136.
Lower KS, Medleau LM, Hnilica K, Bigler B. Evaluation of an enzyme-linked immunosorbent assay (ELISA) for the serological diagnosis of sarcoptic mange in dogs. Vet Dermatol. 2001;12(6):315–20.
-
137.
Bornstein S, Zakrisson G. Humoral antibody response to experimental¨C189CSarcoptes scabiei¨C190Cvar.¨C191Cvulpes¨C192Cinfection in the dog. Vet Derm. 1993;4:107–10.
-
138.
Fuchs B, Zimmermann B, Wabakken P, Bornstein S, Mansson J, Evans AL, et al. Sarcoptic mange in the Scandinavian wolf¨C193CCanis lupus¨C194Cpopulation. BMC Vet Res. 2016;12:156.
-
139.
Sarasa M, Rambozzi L, Rossi L, Meneguz PG, Serrano E, Granados JE, et al.¨C195CSarcoptes scabiei: specific immune response to sarcoptic mange in the Iberian ibex¨C196CCapra pyrenaica¨C197Cdepends on previous exposure and sex. Exp Parasitol. 2010;124(3):265–71.
-
140.
Bornstein S, Zakrisson G. Clinical picture and antibody response in pigs infected by¨C198CSarcoptes scabiei¨C199Cvar.¨C200Csuis. Vet Derm. 1993;4:123–31.
-
141.
Zhang R, Jise Q, Zheng W, Ren Y, Nong X, Wu X, et al. Characterization and evaluation of a¨C201CSarcoptes scabiei¨C202Callergen as a candidate vaccine. Parasit Vectors. 2012;5:176.
-
142.
Zhang R, Zheng W, Wu X, Jise Q, Ren Y, Nong X, et al. Characterisation and analysis of thioredoxin peroxidase as a potential antigen for the serodiagnosis of sarcoptic mange in rabbits by dot-ELISA. BMC Infect Dis. 2013;13:336.
-
143.
Zheng Y, He R, He M, Gu X, Wang T, Lai W, et al. Characterization of¨C203CSarcoptes scabiei¨C204Ccofilin gene and assessment of recombinant cofilin protein as an antigen in indirect-ELISA for diagnosis. BMC Infect Dis. 2016;16:21.
-
144.
Jayaraj R, Hales B, Viberg L, Pizzuto S, Holt D, Rolland JM, et al. A diagnostic test for scabies: IgE specificity for a recombinant allergen of¨C205CSarcoptes scabiei. Diagn Microbiol Infect Dis. 2011;71(4):403–7.
-
145.
Casais R, Goyena E, Martinez-Carrasco C, Ruiz de Ybanez R, Alonso de Vega F, Ramis G, et al. Variable performance of a human derived¨C206CSarcoptes scabiei¨C207Crecombinant antigen ELISA in swine mange diagnosis. Vet Parasitol. 2013;197(1–2):397–403.
-
146.
Casais R, Millan J, Rosell JM, Dalton KP, Prieto JM. Evaluation of an ELISA using recombinant Ssλ20ΔB3 antigen for the serological diagnosis of¨C208CSarcoptes scabiei¨C209Cinfestation in domestic and wild rabbits. Vet Parasitol. 2015;214(3–4):315–21.
-
147.
Oleaga A, Casais R, Balseiro A, Espi A, Llaneza L, Hartasanchez A, et al. New techniques for an old disease: sarcoptic mange in the Iberian wolf. Vet Parasitol. 2011;181(2–4):255–66.
-
148.
Dougall A, Holt DC, Fischer K, Currie BJ, Kemp DJ, Walton SF. Identification and characterization of¨C210CSarcoptes scabiei¨C211Cand¨C212CDermatophagoides pteronyssinus¨C213Cglutathione S-transferases: implication as a potential major allergen in crusted scabies. Am J Trop Med Hyg. 2005;73(5):977–84.


