В общем, чтобы узнать, как картошечкой вылечить артрит и снизить артериальное давление, какой размер у картофельного генома и где нынче производят картофельный квас — нужно заглянуть под cut.

— Биохимию! Биохимию! — кричали пионеры и доставали блокноты.
перефразировано из известного анекдота
Бульбяны тлушч, он же Fat of the…potato
Если говорить начистоту, то вводить такое понятие как «картофельный жир» даже как-то и не comme il faut, потому что содержание жиров (они же липиды) в клубнях очень низкое — всего лишь порядка 0,2 — 2 грамма/кг сырой массы (или в среднем 1,2 г/кг). Примерно о том же говорит и моя любимая база USDA, приписывая 100 граммам сваренного в мундире картофеля 0,1 г липидов, из которых 0,03 г приходится на насыщенные жирные кислоты, 0,002 на мононенасыщенные жирные кислоты и 0,043 г полиненасыщенных жирных кислот. И это притом что для здорового взрослого организма в день требуется примерно до 17 грамм омега-6 и до 2 грамм омега-3 полиненасыщенных жирных кислот. В общем, можно точно сказать, что жирком поживиться из картофеля не удастся… Но в целом не все так просто, мы ведь ищем качество, а не количество.
Начну с того, что, как ни удивительно, но все липиды синтезируются в клубнях картофеля из сахарозы. Под спойлером для продвинутых читателей — схема биосинтеза
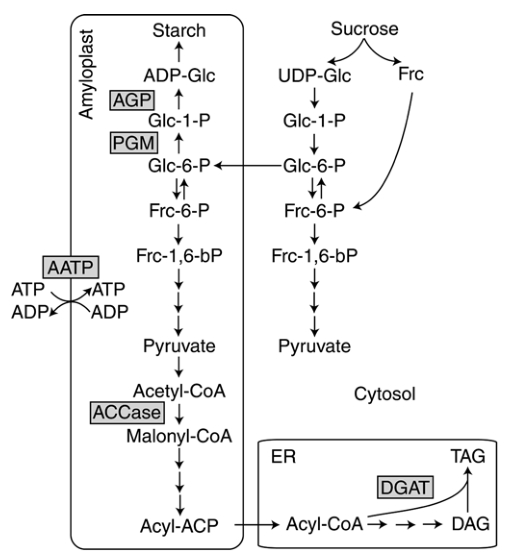
Обозначения: ACCase — Ацетил-СоА карбоксилаза, AGP — АДФ-глюкоза пирофосфорилаза, ACP — белок-носитель для ацильных групп, AATP — пластидный АТФ/АДФ-переносчик, bP — бисфосфат, CoA — коэнзим A, DAG — диацилглицерин, DGAT acyl-CoA — диацилглицерин ацилтрансфераза, Frc — фруктоза, Glc — глюкоза, P — фосфат, PGM — пластидная фосфоглюкомутаза, TAG — триглицериды
Свободных жирных кислот и триглицеридов в картофеле — следовые количества, но зато есть фосфолипиды (фосфатидилхолин — 30,7 мол. %, фосфатидилэтаноламин — 19,6%, фосфатидилинозитол — 9,3%, фосфатидная кислота — 3,2%, фосфатидилсерин — 1,5%, фосфатидилглицерин — 1,2% и дифосфатидилглицерин (кардиолипин) — 0,7%) и галактолипиды. Если о фосфолипидах и их свойствах я уже рассказывал в разделе Fat of the…banana своей последней «банановой» статьи (а значит все сказанное там, применимо и к картофелю), то вот о галактолипидах кратенько расскажу сейчас. По-сути, это разновидность гликолипидов, веществ, содержащих в своем составе неполярный «хвост» — остаток липида (жирной кислоты), связанный ковалентной (гликозидной) связью с полярным углеводным остатком (буквально сахарной «головой»). В случае галактолипидов, в качестве углеводного остатка выступает галактоза.
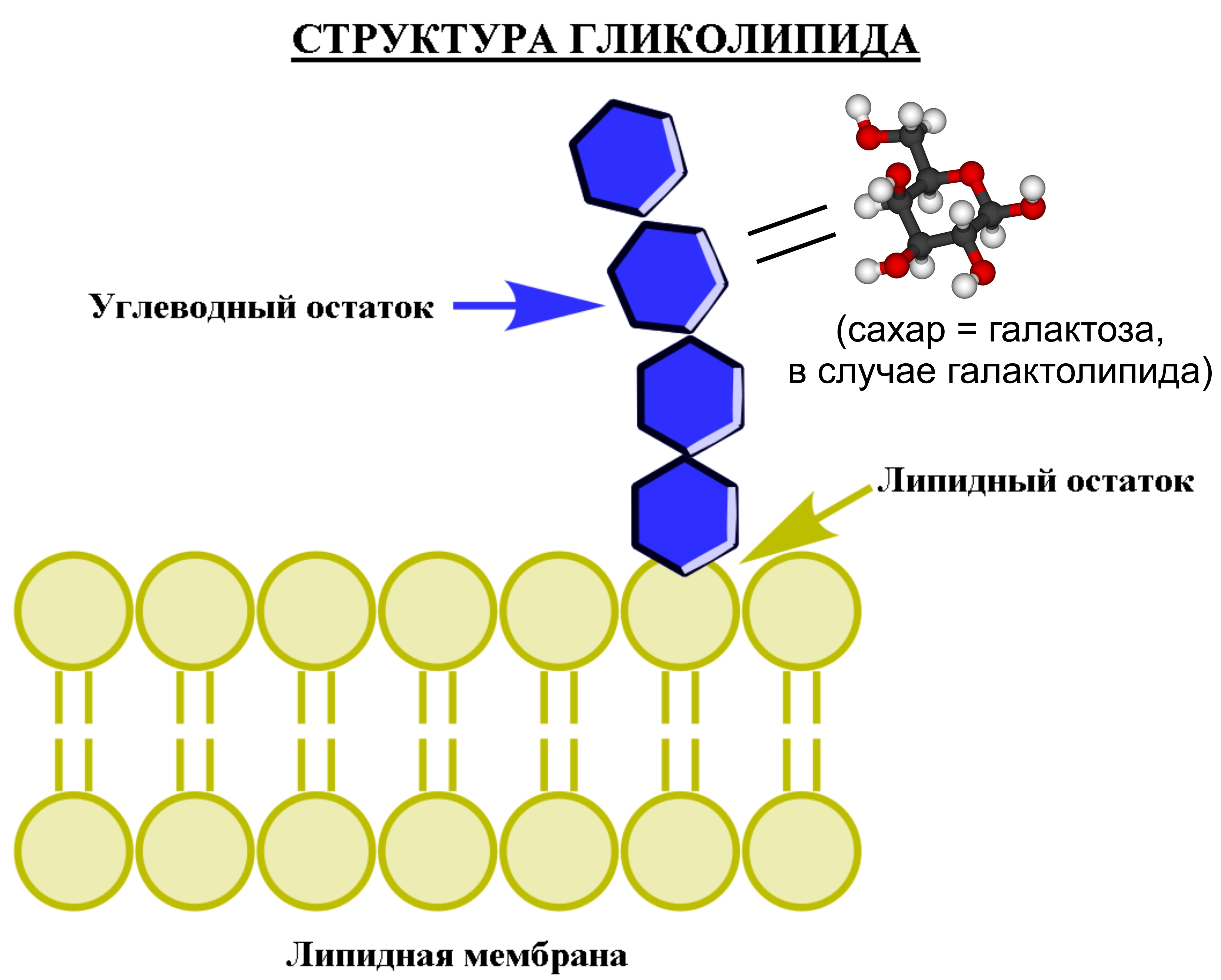
В целом гликолипиды отвечают за стабильность клеточной мембраны и за процессы распознавания «свой-чужой», как лежащие в основе имунного ответа, так и позволяющие клеткам срастаться между собой, образуя ткани. Кроме того, гликолипиды находятся на поверхности мембран эукариотических клеток, простираясь от двойного липидного слоя в «открытый космос» внеклеточной среды. Возвращаясь к галактолипидам, можно сказать что чаще всего они принимают непосредственное участие в процессах фотосинтеза и выступают в качестве резервного «аналога» фосфолипидов, в случае недостатка в организме фосфора. Помимо того, что галактолипиды обладают большей биодоступностью, чем свободные жирные кислоты, они, помимо всего прочего, способны проявлять и хорошую противовоспалительную активность. В качестве примера может служить шиповник, содержащий галактолипиды и обладающий выраженным противовоспалительным действием (противоартритным, в частности).
Интересным фактом является то, что галактолипиды также могут выступать и в роли отпугивающего средства (антифиданта) для морских растений (так же, как и всевозможные танины для наземных). В качестве примера можно привести распространенную на побережьях Атлантического и Тихого океана водоросль фукус, которую никак не может из-за присутствия галактолипидов поесть тот самый милый морской ёжик.
Cовсем по вершкам о связанных с жирами соединениям, присутствующим в клубнях:
Во-первых, это уже знакомые нам фитостеролы (см. статью Заметки фитохимика. Закат эпохи хабра-банана чтобы освежить знания о фитостеринах/стеролах). В свежих картофельных клубнях можно найти достаточно много свободных стеринов. Свежие клубни картофеля содержат около 43.1–43.7% β-ситостерина (от общего количества растительных стеринов), кампестерин (26%), Δ5-авенастерин (20%), и 10% остатка примерно поровну делят между собой брассикастерин, Δ7-авенастерин и стигмастерина и их эфиры. А значит что? А значит subj неправ (почему — см. уже упомянутую выше банана-статью):

Во-вторых, липофильный биополимер суберин, который является основным компонентом внутренней части картофельной кожуры. Суберин состоит из т.н. субериновых кислот (пробковых кислот) и глицерина. Сами кислоты иногда используются для синтеза лекарств (таких вот, по данным русской википедии) и биоразлагаемых пластиков. А суберин — суберин, друзья, это, грубо говоря, и есть та самая пробка, абсолютно одинаковая что в винной бутылке, что в виде отделочного материала на стенке кухни. «грубо говоря», потому пробка — это смесь суберина, клетчатки, лигнина, и различных растительных восков.
Ну и в-третьих, именно жиры отвечают за тот самый картофельный запах. Важно, что сырой картофель практически не имеет запаха, ибо содержит очень малые количества летучих веществ. Как только пошло окисление липидов — пошли и запахи (кстати, именно с процессами окисления липидов и борются все антиоксиданты). Приятные запахи свеже сваренного картофеля, ровно как жаренного и запеченного, форумируются из-за того, что происходит окисление ненасыщенных жирных кислот (которых и содержится то мизерное количество) — в основном, линолевой и линоленовой. В результате образуется ряд летучих альдегидов, кетонов, спиртов и алкилфуранов. Как утверждают авторы работы, разница во вкусах вареного картофеля различных сортов связана с содержанием линолевой кислоты, и соединением цис-4-гептеналь, который образуется в результате окисления (соединение это, кстати, используется в качестве пищевой отдушки). В качестве ложки дегтя можно добавить, что неприятные запахи («прогорклости» и т.п.) также обязаны своим появленияем ненасыщенным жирным кислотам, которые легко окисляются при хранении (особенно обезвоженного картофеля и продуктов из него). В работе авторы показали, что неприятному запаху, который образуется при длительном хранении картофельных хлопьев, последние обязаны продуктам разложения линолевой кислоты (образуются при расщеплении пероксо-комплексов линолевой кислоты), в частности гексаналю (который дает запах «свежескошенной травы»).
Подозреваю, что комментаторы обязательно при упоминании про запах термически обработанного картофеля могут вспомнить про всевозможные пиразины, которые придают картофелю «тот самый вкус, знакомый с детства». Поэтому внесу уточнение «за запах-в большей степени отвечают жиры, а за вкус — все остальное, что получается в результате „известной каждому повару“ реакции Майяра.
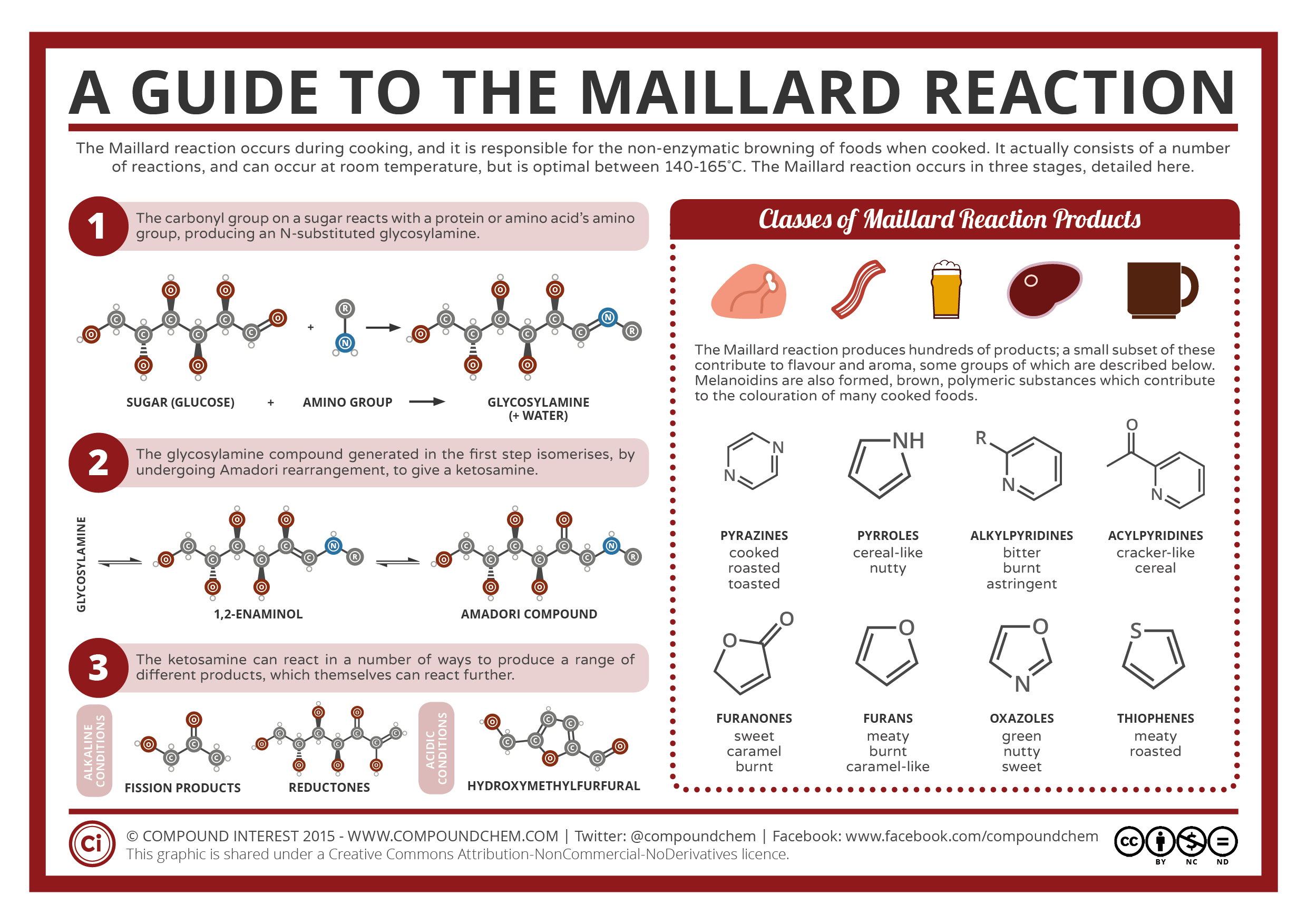
Реакция Майяра (реакция сахароаминной конденсации) — химическая реакция между аминокислотами и сахарами, которая происходит при нагревании. Примером такой реакции является жарка мяса или выпечка хлеба, в ходе которых в процессе нагревания пищевого продукта возникает типичный запах, цвет и вкус приготовленной пищи. Эти изменения вызваны образованием продуктов реакции Майяра. Названа в честь французского химика и врача Луи Камиля Майяра, который одним из первых исследовал реакцию в 1910-х годах.
Возможно, позднее придется остановится отдельно на процессе термической обработки картофеля и рассмотреть его химизм. Пока же скажу просто, что в формировании вкуса сваренной/жаренной картошечки (и присущего ему аромата) принимают участие в основном различные алкилфураны (пиразины туда же), образующиеся в той самой реакции Майяра.
На заметку: интересный факт заключается в том, что продукты распада РНК — некоторые рибонуклеотиды, образующиеся в процессе запекания/жарки картофеля выступают как прекурсоры (предшественники) „глутамато-подобных“ усилителей вкуса, стимуляторов рецепторов класса „умами“. Так что, если „язык не идет к глутамату, глутамат идет к языку“, а ты, %USERNAME% об этом и не догадываешься 🙂
Белок картофеля
Жиров — мало, белков — немного больше (в картофеле, естественно). Но все равно даже при огромном желании дотянуть до продуктов животного происхождения не получится. В среднем, один картофельный клубень содержит около 20 грамм белка (6,9-46,3) на килограмм сырого веса. А по данным USDA в мякоти одного вареного в мундире картофеля содержится примерно 1,87 грамма белка на 100 г продукта. Таким образом, белок, который может поступить в организм с картофелем — составляет мизерную часть к общему необходимому для организма дневному поступлению белка. Но, тем не менее, стоит признать, что даже с таким малым содержанием, корнеплоды (вроде картофеля и батата) явояются ценным НЕзерновым источником белка в мировом масштабе. Кроме того, картофельный белок представляет определенную ценность из-за высокого содержания таких незаменимых кислот как лизин, метионин, треонин и триптофан. Все же так сказать эндогенные белки, которые можно найти в картофеле, можно разделить на три класса: пататины, ингибиторы протеаз и высокомолекулярные белки. О каждом по-подробнее ниже.
Основным белком, содержащимся в картофеле, является пататин, также известный как туберин (как это получится в переводе на русский — »картофин» что ли…). В основном он содержится в клубнях или столонах растения (в вакуолях паренхимы). На пататины приходится около 40–60% всех белков картофеля. Пататины — это гликопротеины запасного типа (т.е. белки, накопленные в ходе роста и развития плода как питательные вещества, необходимые для развития растения на начальных этапах прорастания), обладающие ферментативной активностью липидацил гидролазы (LAH, способная отщеплять жирные кислоты от мембранных липидов, но имеено это, кстати, является основной причиной аллергии на картофель) и обладающие молекулярной массой от 40 до 45 кДа.
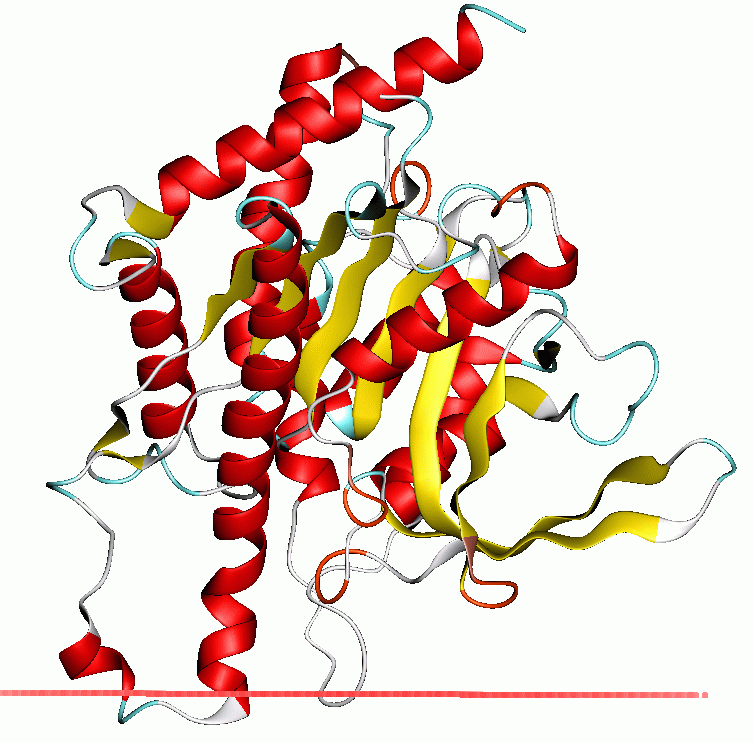
Состоит пататин примерно из 366 аминокислот, в картофеле присутствует в виде димера молекулярной массой около 88 кДа. Третичная структура у белка стабильна до 45 °С, при повышении температуры вторичная структура начинает разворачиваться и при 55 °C денатурирует α-спираль. Так что, возрадуйтесь, о поклонники и фанаты модного нынче СУ-ВИД течения, даже оно может избавить вас от картофельного белка.
Интересно, что по сравнению с другими распространенными белковыми растительными источниками, пататин обладает такой же питательной эффективностью, что и яичный белок, и при этом имеет эмульгирующие свойства лучше чем соевые белки (производители всевозможных вегетарианских суррогатов здесь должны остановиться и задуматься).
Второй группой белков картофеля, являются ингибиторы протеаз (т.н. туберинин), которые имеют молекулярную массу в диапазоне от 5 до 25 кДа. Как и пататин, ингибиторы протеазы составляют 30–40% от общего белка клубня. И да, это, если кто-то уже забыл, ни много ни мало, а антипитательные вещества. Ингибиторы протеазы блокируют работу сериновой, цистеиновой (ингибирует папаина = не есть сырой картофель с папайей), аспаргиновой протеазы (может ингибировать трипсин, химотрипсин и эластазу лейкоцитов человека, ага), некоторых инвертаз и металлсодержащих карбоксипепсидаз (PCI). В целом, на сегодня выделено пять семейств этих ингибиторов (А — с массой до 8,1 кДа, В — с массой до 12,3 кДа, С — с массой 22–25 кДа, K, M) которые отличаются по своей аминокислотной последовательности, длине цепи и составу субъединицы (от мономера до пентамера). 70% картофельных ингибиторов протеаз относятся к т.н. «доменам Куница» (ударение на первый слог), которые, кстати, активно используются в качестве основы для разработки новых фармацевтических препаратов. По сравнению с пататином, ингибиторы протеаз, как правило, более гидрофильны, однако обе фракции белка имеют одинаковую тенденцию коагулировать под воздействием термической обработки (т.е. они так же уязвимы перед sous-vide). Еще раз напомню, что статус антипитательных веществ ингибиторы протеаз получили за то, что снижают усвояемость и биологическую ценность белка, что, правда, имеет место только в случае употребления сырых или неправильно приготовленных продуктов из картофеля.
Ну и наконец, третья, «NONAME», группа картофельных белков (20–30% от общего белка картофеля). Сюда относятся в основном высокомолекулярные белки, участвующие в синтезе крахмала, например, такие как фосфорилаза L-1 с молекулярной массой 80 кДа (4%). Можно также вспомнить липоксигеназы (10%), дефенсин (5%), аннексин, глиоксилаза I, энолаза, каталаза, UDP-пирофосфорилаза и т.п. Семейство это на сегодняшний день никто толком еще не изучал. Так что, белые пятна еще есть (белорусские картофельные эксперты, ау! работа для вас).
Итак, описание дано и стоит рассказать, а чем это все интересно. А интересно тем, что при ферментативной деградации многих из упомянутых полипептидов образуются короткоцепочные протеины, которые могут обладать гормоноподобной (антитромботическую, антигипертензивную, иммуномодулирующую и т.д.) активностью. Биоактивностью обычно обладают пептиды с 3-20 аминокислотными остатками, способные проникать через кишечный эпителий или связываться со специфичными рецепторами эпителиальных клеток кишечника.
На сегодняшний день, стоит признать, ни физиологическая роль, ни биологическая активность картофельных белков достаточно не изучена (читай ждет своих исследователей). Исходя из аминокислотных последовательностях картофельных белков, исследователи предполагают наличие нескольких потенциальных «белков-прекурсоров» (предшественников), которые в организме человека формируют пептиды с различной активностью.

Картинка, кстати, из той самой, легендарной статьи в не менее легендарном Nature. Геном картофеля был отсеквенирован в 2011 году силами Международного консорциума по секвенированию картофеля. В состав этого коллектива входили 16 научных групп из разных стран, из России специалисты были, а вот были ли из «картофельной» Беларуси — не знаю, если комментаторы подскажут — поправлю статью.
Но скорее всего, пока международное комьюнити секвенировано секвенировало, да не высеквенировало, наш брат «мытьем и катаньем» (=как завещал нам дедушка Мичурин) выводил себе селекционными методами «картофель с розовой, синей и фиолетовой мякотью«. Не столь важно, что уже в 2003 году исследователи из Корнеллского университета США встречали Новый год с фиолетовой картошкой сорта Adirondack Blue, сколь то, что из «Белорусского цветного» можно делать картофельный квас Miкола (Miкола — это Николай на русском, если что) (для Европейских игр 2019, ага).

В качестве примера биологической активности можно привести работу в которой показан эффект «картофина» приводящий к усиленному ингибированию ангиотензинпревращающего фермента (АПФ), ответственного за контроль артериального давления (и кучу других последствий различных заболеваний). Притом наибольшей активностью на этом поприще обладали белки из т.н. «сосудистого пучка» и внутренних клубней. Оказывал воздействие и возраст этих самых клубней (любители молодой картошечки, как ни крути, а правы в своих вкусовых предпочтениях).
Хотя, если уж говорить о снижении артериального давления, то стоит сказать о такой штуке как кукоамины (на картинке — кукоамин А)

В 2005 году британские исследователи обнаружили эти соединения в картофеле. Химически кукоамины являются катехинами (т.е. относятся к подмножеству антиоксидантов), а также производными диаминов дигидрокофейных кислот. Ранее подобные соединения были обнаружены в одном единственном растении Lycium chinense (Solanaceae) аka Дереза китайская

Если что, к этому же семейству относится и Дереза обыкновенная, плоды которой у нас принято еще называть «волчьей ягодой». Но системы здесь никакой нет, так что не вздумайте хватануть на досуге волчьих ягод, давление не понизит, несмотря на внешнюю схожесть (найди десять отличий с Lycium chinense)

Китайская дереза традиционно использовалась в фитомедицине, как средство эффективно снижающее артериальное давление. Аналогичными свойствами обладают и кукоамины картофеля. Правда стоит отметить, что в той же работе 2005 года есть ссылки на исследования, показавшие наличие кукоаминов в лесном табаке (Nicotiana sylvestris) и помидорчике (Lycopersicon esculentum). Пока роль кукоаминов в картофеле недостаточно изучена, существуют статьи, где авторы приписывают им регуляцию биосинтеза крахмала, формирование устойчивости к заболеваниям и стимуляцию прорастания. Что касается биологической активности в человеческом организме, то здесь еще предстоит оценить термическую устойчивость картофельных аминов (а на сегодня их обнаружено около 30 штук) и их биодоступность.
Вторым интересным фактом белковой природы могут служить работы (ать, два). Исследователи обнаружили, что картофельные белки, в частности, ингибиторы аспаргиновой протеазы, стимулируют высвобождение в организме мышей холестистокинина (CCK) и стимулировал клетки, вырабатывающие CCKAR (англ. Cholecystokinin A receptor), который, взаимодействуя с белками пищи, способствует возникновению эффекта насыщения.
Учитывая все вышесказанное, картофельные белки могут выступать в качестве прекрасного компонента для создания функциональной пищи (о ней я неоднократно упоминал в своих «банановых» статьях).
Кроме того, картофель из-за огромного количества фактически дармовых полипептидов может выступать в качестве отличного in vitro нанореактора многих необходимых биологических соединений. Исследователи в работе, к примеру обнаружили, что мелкие картофельные пептиды, полученные в результате щелочного ферментативного гидролиза, оказали положительное влияние на метаболизм липидов у крыс. В результате этой работы, высокомолекулярные белки картофеля удалось «раздробить» на пептиды с молекулярной массой от 700 до 1840 Да, причем основная молекулярная масса (90% от общего количества) составляла 850 Да. В результате был сделан вывод, что такой способ получения низкомолекулярных пептидов является наиболее экономически доступным из существующих, с великолепными возможностями для промышленного масштабирования (не говоря уже про то, что низкомолекулярные пептиды обладают более широким спектром функциональных свойств, чем их высокомолекулярные «коллеги»).
К чему это все? А к тому, что на сегодняшний день белок картофеля чаще всего стараются убрать при производстве крахмала и даже не всегда используют на корм животным (из-за горького вкуса, которым могут давать некоторые соединения, тот же соланин), также практически не используются белки картофеля для эмульгирования и пенообразования, хотя, думаю, каждый кто хоть раз варил картофель, знает насколько устойчивой бывает образующаяся при кипении пена. А выходит штука это интересная и достаточно не изученная. Единственный их минус в том, что все, самые интересные свойства, проявляются только при использовании as is, т.е. в необработанном виде… Химики-сыроеды, ваш ход!
Продолжение следует…
Cергей Бесараб (Siarhei V. Besarab)
Pots, A. M.; Gruppen, H.; Diepenbeek, R. v.; Lee, J. J. v. d.; Boekel, M. v.; Wijngaards, G.; Voragen, A. G. J. The effect of storage of whole potatoes of three cultivars on the patatin and
protease inhibitor content; a study using capillary electrophoresis and MALDI-TOF mass spectrometry. J. Sci. Food Agric. 1999, 79, 1557-1564.
van Koningsveld, G.A., Walstra, P., Gruppen, H., Wijngaards, G., van Boekel, M.A., Voragen, A.G., (2002). Formation and stability of foam made with various potato protein preparations. Journal of Agricultural and Food Chemistry 7651–7659.
Løkra, S., Helland, M.H., Claussen, I.C., Straetkvern, K.O., Egelandsdal, B., (2008). Chemical characterization and functional properties of a potato protein concentrate prepared by large-scale expanded bed adsorption chromatography. Swiss Society of Food Science and Technology 1089–1099.
Dobson, G., Griffiths, D. W., Davies, H. V., & McNicol, J. W. (2004). Comparison of fatty acid and polar lipid contents of tubers from two potato species, Solanum tuberosum and Solanum phureja. J. Agric. Food Chem., 52, 6306–6314.
Petersen, M. A., Poll, L., & Larsen, L. M. (1998). Comparison of volatiles in raw and boiled potatoes using a mild extraction technique combined with GC odour profiling and GC-MS. Food Chem., 61, 461–466.
Oruna-Concha, M. J., Bakker, J., & Ames, J. M. (2002). Comparison of the volatile components of two cultivars of potato cooked by boiling, conventional baking and microwave baking. J. Sci. Food Agric., 82, 1080–1087.
Laine, G., Göbel, C., du Jardin, P., Feussner, I., & Fauconnier, M. -L. (2006). Study of precursors responsible for off-flavor formation during storage of potato flakes. J. Agric. Food Chem., 54, 5445–5452.
Klaus, D., Ohlrogge, J. B., Ekkehard Neuhaus, H., & Dörmann, P. (2004). Increased fatty acid production in potato by engineering of acetyl-CoA carboxylase. Planta, 219, 389–396.
Dobson, G., Griffiths, D. W., Davies, H. V., & McNicol, J. W. (2004). Comparison of fatty acid and polar lipid contents of tubers from two potato species, Solanum tuberosum and Solanum phureja. J. Agric. Food Chem., 52, 6306–6314.
Shewry PR (2003). Tuber storage proteins. Ann. Bot. 91 (7): 755–69.
Pihlanto, A. and Korhonen, H.J.T. (2003) Bioactive peptides and proteins. Advances in Food and Nutrition Research 47, 175-276.
Pihlanto, A., Akkanen, S. and Korhonen, H.J. (2008) ACE-inhibitory and antioxidant properties of potato (Solanum tuberosum). Food Chemistry 109, 104-112.
Makinen, S., Kelloniemi, J., Pihlanto, A., Makinen, K., Korhonen, M., Hopia, A. and Valkonen, J.P.T. (2008) Inhibition of angiotensin converting enzyme I caused by autolysis of potato proteins by enzymatic activities confined to different parts of the potato tuber. Journal of Agricultural and Food Chemistry 56, 9875-9883.
Foltz, M., Ansems, P., Schwarz, J., Tasker, M.C., Lourbakos, A. and Gerhardt, C.C. (2008) Protein hydrolysates induce CCK release from enteroendocrine cells and act as partial agonists of the CCK1 receptor. Journal of Agricultural and Food Chemistry 56, 837-843.
Parr, A. J., Mellon, F. A., Colquhoun, I. J., & Davies, H. V. (2005). Dihydrocaffeoyl polyamines (kukoamine and allies) in potato (Solanum tuberosum) tubers detected during metabolite profiling. J. Agric. Food Chem., 53, 5461–5466.
Tanemura, Y., & Yoshino, M. (2006). Regulatory role of polyamine in the acid phosphatase from potato tubers. Plant Physiol. Biochem., 44, 43–48.
Stenzel,O.,Teuber,M.,&Drager,B.(2006).Putrescine N-ethyltransferase in Solanum tuberosumL., a calystegine-forming plant. Planta, 223, 200–212.
Matsuda, F., Morino, K., Ano, R., Kuzawa, M., Wakasa, K., & Miyagawa, H. (2005). Metabolic flux analysis of the phenylpropanoid pathway in elicitor-treated potato tuber tissue. Plant Cell Physiol., 46, 454–466.
Kaur-Sawhney, R., Shih, L. M., & Galston, A. W. (1982). Relation of Polyamine Biosynthesis to the Initiation of Sprouting in Potato Tubers. Plant Physiol., 69, 411–415.
Источник


