
Физическую боль сложно назвать чем-то приятным, однако это ощущение имеет крайне важное значение в работоспособности нашего организма. Боль является своеобразной сигнализацией, оповещающей о наличии некоего раздражителя, от которого необходимо избавиться. Причиной боли могут быть как физические повреждения тканей или органов (переломы, ушибы, порезы, удар мизинцем об комод и т.д.), так и патологические процессы в организме (инфекции, онкология, врожденные дефекты и т.д.). В любом случае боль помогает как можно раньше и точнее локализовать проблему, требующую внимания. При этом разные люди могут ощущать боль от одинакового источника по-разному, что обусловлено разным болевым порогом. Для одних людей снятия пластыря — настоящая агония. А другие спокойно могут уснуть во время лечения зубного канала без анестезии. Боль крайне индивидуальна, но даже тут есть скрытая логика. Ученые из MGH (Массачусетская больница общего профиля, США) установили причину, почему люди с рыжими волосами обладают более высоким болевым порогом. Как цвет волос влияет на восприятие боли, как это связано с кожей, и как можно на практике применить полученные сведения? Ответы на эти вопросы мы найдем в докладе ученых. Поехали.
Основа исследования
С точки зрения медицины можно выделить два основных типа боли: ноцицептивную и нейропатическую. Первый тип относится к периферическим нервным окончаниям, которые активируются болевыми стимулами в результате повреждения тканей. Второй тип является результатом повреждения или дисфункции центральной нервной системы или периферических нервов. В рассматриваемом нами сегодня труде речь идет о первом типе боли, т.е. о ноцицептивной.
Ранее было установлено, что люди (и мыши) с рыжими волосами обладают отличным от других болевым порогом, повышенной потребностью в неопиоидных анальгетиках и усиленной реакцией на опиоидные анальгетики. Факт отличий был установлен, но причина его существования так и не была определена.
Чтобы понять причину отличия болевого порога у рыжих стоит сначала обратить внимание на причину визуального отличия, т.е. на причину рыжего цвета волосяного покрова. Рыжий цвет обусловлен вариантными аллелями с потерей функции рецептора меланокортина 1 (MC1R) — Gs-связанного рецептора, экспрессируемого на меланоцитах (клетках кожи, продуцирующих пигмент). Эти отличительные черты могут каким-то образом влиять и на болевой порог. Чтобы это выяснить, ученые использовали в ходе опытов мышей Mc1re/e, которые демонстрируют многие черты рыжих людей: рыжие волосы, синтез красного/светлого пигмента феомеланина, неспособность загорать после воздействия УФ-излучения и увеличение риска рака кожи из-за УФ воздействия.
Результаты исследования
Чтобы первоначально оценить пороги ноцицепции у мышей Mc1re/e и проверить роль пигмента в ноцицепции, ученые скрестили мышей Mc1re/e с видом-альбиносом, содержащим инактивирующую мутацию гена тирозиназы (Tyrc/c). У этих мышей количество меланоцитов не изменено, но они не пигментированы. Полученный скрещенный вид (Mc1re/e + Tyrc/c) не отличался от Tyrc/c вида, поскольку также имел белый окрас.

Изображение №1
Сравнение мышей с разными генетическими изменениями показало, что особи Mc1re/e обладают значительно более высоким болевым порогом (давление и температура), чем мыши Mc1rE/E с генетическим фоном альбиносов (1A и 1B). При этом повышенный болевой порог наблюдался у мышей Mc1re/e и в сравнении с Mc1rE/E без генетичсекого фона альбиносов (1C и 1D). Из этого следует, что MC1R играет важную роль в регуляции ноцицепции, но не зависит от пигментации.
Далее ученые решили проверить, вызваны ли повышенные пороги ноцицепции у рыжеволосых мышей потерей функции MC1R в меланоцитах или в других типах клеток. Для этого было проведено сравнение трех генетически согласованных (C57BL/6J) моделей мышей, которые различаются по количеству меланоцитов.
Мыши с повышенным количеством эпидермальных меланоцитов показали значительно более низкие пороги ноцицепции (1E и 1F), в то время как мыши, лишенные меланоцитов, показали более высокие пороги ноцицепции по сравнению с мышами из контрольной группы (без каких-либо генетичсеких манипуляций; 1G и 1H). Эти данные свидетельствуют о том, что количество эпидермальных меланоцитов (независимо от функции MC1R) действительно может модулировать пороги ноцицепции.
Далее ученые скрестили рыжих мышей с мышами без меланоцитов. Анализ полученных гибридов позволял оценить функцию MC1R в немеланоцитарных клетках. На графиках 1G и 1H видно, что генетическое отсутствие меланоцитов сводит на нет способность MC1R влиять на пороги ноцицепции. Следовательно, влияние на болевой порог осуществляется MC1R именно в меланоцитах, а не в других клетках.
Одним из гипотетических модуляторов повышенного порога ноцицепции у рыжеволосых мышей является β-эндорфин — продукт посттрансляционного расщепления проопиомеланокортина (ПОМК), который экспрессируется в меланоцитах. ПОМК индуцируется аденозин 3′, 5′-циклическим монофосфатом (ациклический АМР или цАМР) в других типах клеток. Следовательно, низкие уровни цАМР в мутантных меланоцитах MC1R может повлиять на экспрессию ПОМК.
У рыжих мышей уровень β-эндорфина в плазме был значительно ниже, чем у черных мышей (1I). Однако это еще не означает, что изменения β-эндорфина влияют на болевой порог, поскольку направление изменения противоположно фенотипическому изменению, поскольку передача сигналов опиоидов способствует, а не уменьшает анальгезию (уменьшение болевой чувствительности). Более того, уровни β-эндорфина в плазме также были обратно пропорциональны порогам ноцицепции у мышей K14-SCF (более высокие числа меланоцитов и более низкие пороги ноцицепции) и мышей Mitfmi-wh/mi-wh (отсутствие меланоцитов и более высокие пороги ноцицепции).
Из этих данных следует, что количество и функции меланоцитов обратно коррелируют с порогами ноцицепции, несмотря на то, что они напрямую связаны с уровнями β-эндорфина.
Для оценки роли меланоцитов в модуляции экспрессии ПОМК относительно MC1R были произведены два дополнительных изменения в меланоцитах мышей: подавление мРНК Mc1r (1J) и стимуляция MC1R с помощью ⍺-MSH, т.е. ⍺-меланоцит-стимулирующего гормона (1K). В первом случае наблюдалось снижение продукции мРНК ПОМК, а во втором, наоборот, увеличение.
Экспрессия ПОМК не показала статистически значимого снижения в надпочечниках и гипофизе мышей Mc1re/e. Это позволяет предположить, что изменения уровня ПОМК в плазме связаны с уменьшением продукции меланоцитов ПОМК, вызванным потерей функции MC1R.
Далее необходимо было установить, является ли повышенный болевой порог результатом адаптации к низкому уровню β-эндорфина. Для этого использовалось два типа мышей: у одного была гомозиготная мутация ПОМК, которая экспрессирует все пептиды меланокортина, но не имеет концевой последовательности β-эндорфина («нокаут β-эндорфин»), а у второго типа был дефицит гена рецептора β-эндорфина, т.е. µ-опиоидного рецептора (Oprm1−/−).

Изображение №2
Анализ не показал каких-либо значимых эффектов нокаута β-эндорфина на болевые пороги у черных и рыжих мышей (2A и 2B). Делеция (потеря участка хромосомы) Oprm1 не влияла на пороги ноцицепции у черных мышей, но устраняла повышенные болевые пороги у рыжих (2C и 2D).
Подобный эффект имели и налоксон (антагонист* широкого опиоидного рецептора), и ципродим (антагонист, специфичный для µ-опиоидного рецептора). Они оба снижали болевые пороги у рыжих мышей до уровня порогов черных мышей (2E и 2F).
Антагонист* — лиганд, который блокирует, снижает или предотвращает физиологические эффекты, вызываемые связыванием агониста с рецептором.
Агонист* — лиганд, который при взаимодействии с рецептором изменяет его состояние, приводя к биологическому отклику.
Эти данные предполагают, что повышенные пороги ноцицепции у рыжих мышей зависят от β-эндорфин-независимой передачи сигналов опиоидных рецепторов.
Из вышеописанных результатов следует вывод, что более высокая передача сигналов µ-опиоидных рецепторов в присутствии низких уровней β-эндорфина в плазме может быть объяснена усилением регуляции другого эндогенного опиоида, адаптацией µ-опиоидного рецептора или сокращением пути, который препятствует передаче опиоидных сигналов.
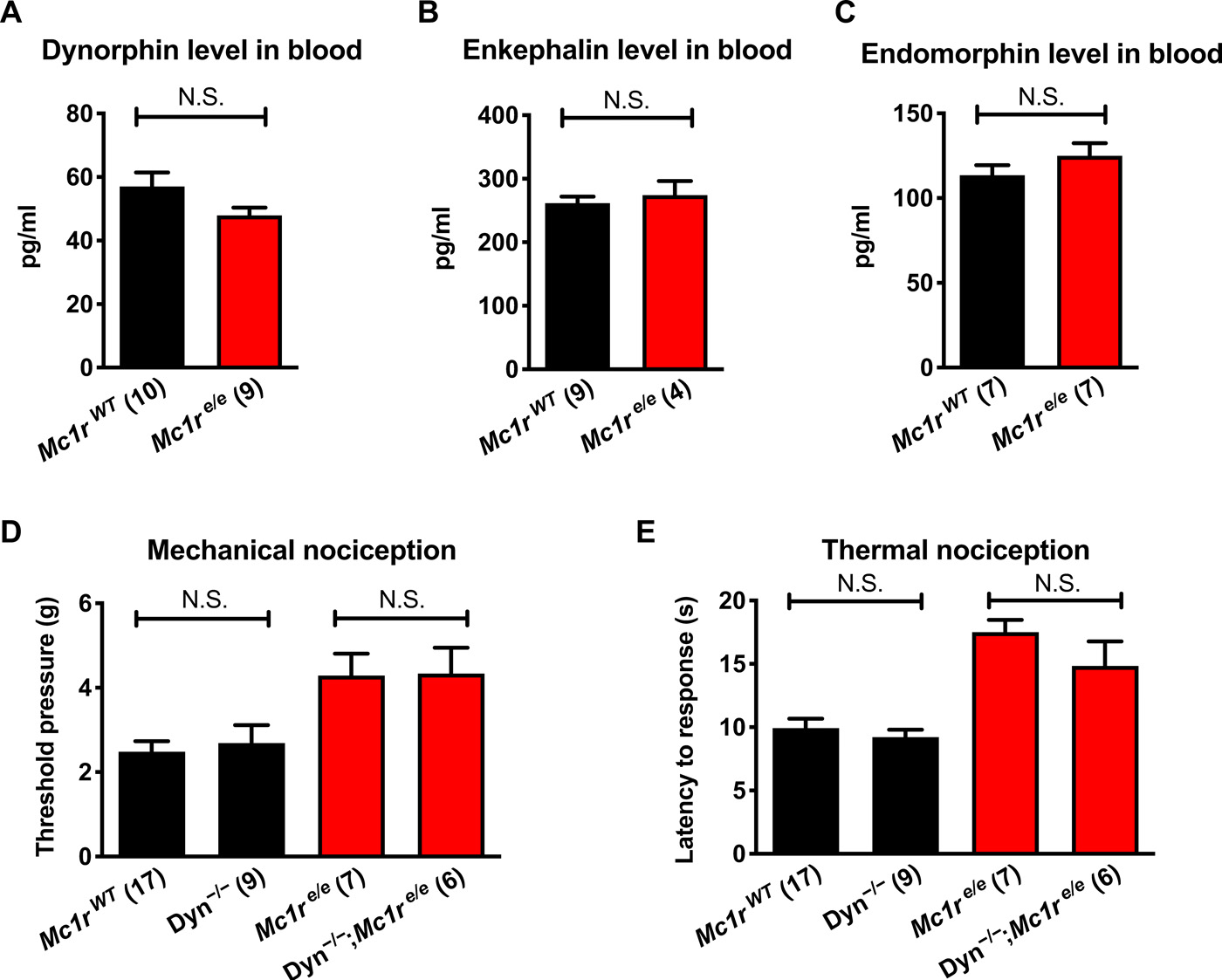
Изображение №3
Прямые измерения циркулирующих опиоидных лигандов динорфина, энкефалина и эндоморфина не выявили существенных различий между рыжими и черными мышами (3A—3C). Учитывая ранее опубликованные данные о различиях между рыжими и черными мышами в их реакции на пентазоцин (агонист β-опиоидных рецепторов), было решено продолжить изучение агониста β-рецепторов динорфина.
Для этого штамм мышей с нокаутом динорфина был скрещен с рыжими и черными мышами. Однако измеримых эффектов на пороги ноцицепции у рыжих или черных мышей при этом не наблюдалось (3D и 3E). Это означает, что повышение уровня эндогенного (внутреннего) опиоида вряд ли может быть причиной повышения порога ноцицепции.
После проведения фармакологических манипуляций с меланокортином, которые привели к снижению некоторых эффектов морфина, ученые решили исследовать уровни ⍺-MSH (агониста меланокортина) в плазме. MSH кодируется в ПОМК, как и β-эндорфин.
Учитывая общее происхождение ⍺-MSH и β-эндорфина, было неудивительно, что уровни первого варьировались у мышей с разной пигментацией. У мышей с большим количеством меланоцитов (черные мыши) уровень ⍺-MSH был достаточно высок (4A). А у мышей меньшим количеством меланоцитов (рыжие мыши) уровень был значительно ниже.

Изображение №4
Таким образом, уровень ⍺-MSH в плазме мышей менялся в соответствии с болевым порогом, который он моделирует (гипотетически), чего нельзя сказать про β-эндорфин.
Чтобы функционально оценить, может ли пропорционально низкий уровень ⍺-MSH способствовать повышенным порогам ноцицепции для рыжих мышей, было выполнено фармакологическое исследование. Меланотан II (пептидный имитатор ⍺-MSH) снижал пороги ноцицепции дозозависимым образом у самцов рыжих, но не у черных мышей (4B).
Эти результаты подтверждают, что потеря функции передачи сигналов MC1R приводит к увеличению пороговых значений ноцицепции из-за дефицита меланокортина.
Дополнительно был исследован еще один рецептор меланокортина — MC4R, поскольку его ингибирование имеет прямое отношение к фармакологическому обезболиванию и нейропатической боли.
Сначала был проверен пептид SHU 9119, противодействующий MC4R и MC3R. SHU 9119 вызывал уменьшение болевой чувствительности (т.е. увеличение болевого порога) при введении самцам черных мышей (4C). Из этого можно сделать вывод, что обезболивающие эффекты SHU 9119 не зависят от Mc1r и, вероятно, связаны с эффектами лиганда на MC4R или MC3R.
Мыши, которые были лишены MC4R, демонстрировали повышенные пороги ноцицепции (4D и 4E). Отсутствие MC4R у черных мышей также привело к повышению чувствительности к опиоидному антагонизму (4F), что наблюдается у рыжих мышей. Значит, порог ноцицепции может определяться балансом между OPRM1 и сигналами MC4R. Фармакологическое замедление OPRM1 привело к восстановлению порогов ноцицепции как у черных, так и у рыжих мышей (4G). При этом применение агониста меланокортина снижало повышенные пороги ноцицепции у рыжих мышей (4B), но никак не влияло на мышей без MC4R (4H). Это наталкивает на мысль, что именно MC4R является ключевым рецептором меланокортина, на который MSH действует как лиганд для снижения порога ноцицепции.
На следующем этапе ученые решили выяснить, периферическая или центральная нервная система больше задействованы в процессе модуляции ноцицепции. Ноцицептивная разница, наблюдаемая между черными и рыжими мышами, уменьшилась после периферического (внутрибрюшинного) введения налтрексона (5А) — антагониста опиоидных рецепторов, который способен преодолевать гематоэнцефалический барьер (ГЭБ).
Гематоэнцефалический барьер* (ГЭБ) — физиологический гистогематический барьер между кровеносной системой и центральной нервной системой.
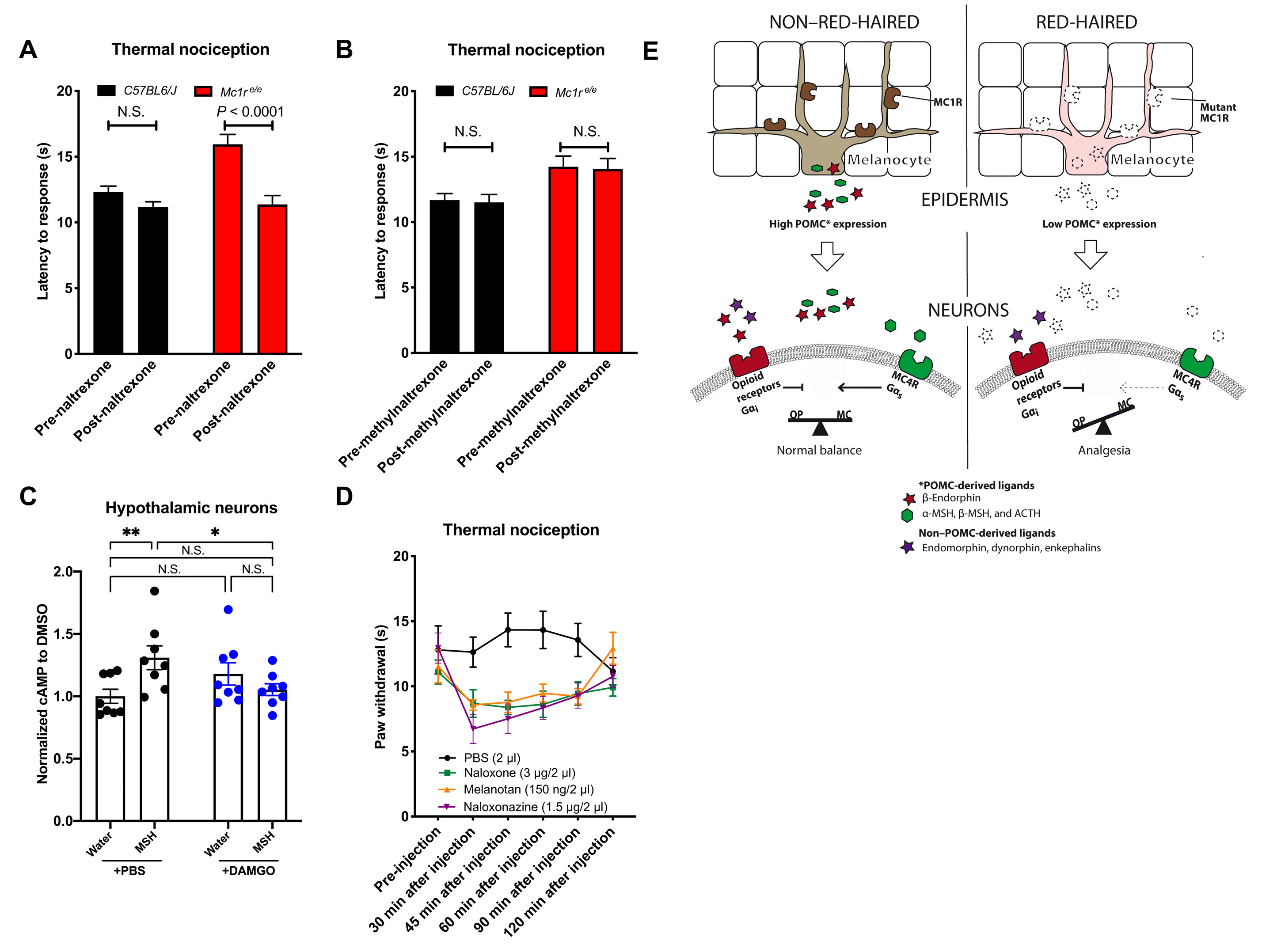
Изображение №5
Однако периферическое введение метилированного налтрексона, непроницаемого для ГЭБ опиоидного антагониста, не уменьшило ноцицептивных различий между черными и рыжими мышами (5В), что свидетельствует о минимальном периферическом влиянии.
Это предполагает, что относительное усиление передачи сигналов опиоидов у рыжих мышей происходит центрально, а не периферически.
Ранее сообщалось, что передача сигналов цАМР играет важную роль в модуляции опиоидного снижения боли. Посему было решено измерить влияние антагонизма на содержание цАМР в первичных нейронах гипоталамуса крыс (RPHN от rat primary hypothalamic neurons). Было обнаружено, что агонист меланокортина увеличивал содержание цАМР, но опиоидный агонист морфин значительно уменьшал вызванное меланокортином повышение цАМР (5C). Следовательно, передача сигналов меланокортином и опиоидами может противодействовать друг другу.
Анализ также показал возможное наличие нейронов в периакведуктальной серой зоне (PAG от periaqueductal gray area), экспрессирующих оба типа рецепторов. Сравнение уровней мРНК опиоидных рецепторов в PAG у разных мышей не показо особых отличий.
Исследование роли PAG в модулировании ноцицепции показало, что местный антагонизм опиоидных рецепторов или агонизм рецепторов меланокортина значительно снижают болевые пороги (5D).
Совокупность всех вышеописанных данных позволяет подытожить: повышенные болевые пороги у рыжих мышей возникают из-за снижения уровней ⍺-MSH, вызванного снижением продукции проопиомеланокортина (ПОМК) в меланоцитах, что приводит к снижению передачи сигналов MC4R.
Снижение передачи сигналов MC4R, в свою очередь, снижает его антагонизм по отношению к передаче сигналов опиоидов в ЦНС, которая, несмотря на снижение продукции β-эндорфина, не обнаруживает заметных различий в других эндогенных опиоидных лигандах. В совокупности это вызывает дефицит меланокортина, что изменяет баланс в пользу анальгезии (обезболивания), индуцированной β-опиоидными рецепторами (5E).
Для более подробного ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых и дополнительные материалы к нему.
Эпилог
Да, легким этот труд не назовешь, но когда дело доходит до изучения работы нервной системы, другого и не стоит ожидать. В данном исследовании ученые пытались разобраться, почему рыжие мыши менее чувствительны к боли, чем черные или белые. Другими словами, почему у них повышенный болевой порог (порог ноцицепции).
В ходе многочисленных опытов удалось выяснить, что у рыжих мышей функции рецептора меланокортина снижены. Это приводит к тому, что клетки кожи, производящие пигмент, выделяют меньше проопиомеланокортина (ПОМК). В свою очередь, молекулы ПОМК расщепляются на гормоны, участвующие в восприятии или блокировке болевых ощущений. Наличие этих гормонов поддерживает равновесие между опиоидными рецепторами и рецепторами меланокортина, которые подавляют и усиливают боль соответственно.
У рыжих мышей уровень обоих гормонов очень низок. Логично, что их действие должно быть минимально. Однако, помимо этих конкретных гормонов существует ряд дополнительных элементов, которые влияют на восприятие/подавление боли. К ним относятся те, что связаны с меланоцитами, которые активируют опиоидные рецепторы, участвующие в блокировании боли. В результате более низкие уровни гормонов приводят к повышению болевого порога за счет усиления опиоидных сигналов.
Естественно, главным применением новообретенных знаний является медицина и фармакология. Понимая индивидуальную природу боли и ее ощущения у разных пациентов, можно более точно применять обезболивающие. Что касается лекарств, то знания о том, какие именно механизмы участвуют в восприятии/блокировки боли, можно разработать препараты, ингибирующие (подавляющие) рецепторы меланокортина, тем самым повышая болевой порог.
Боль играет крайне важную роль в диагностике травм и заболеваний, однако это не означает, что ее нужно терпеть длительное время. Конечно, полностью лишать человека способности ощущать боль было бы крайне неразумно, но иметь в своем распоряжении инструменты, позволяющие ее контролировать, могли бы значительно облегчить жизнь не только медработникам, но и миллионам пациентов во всем мире.
Благодарю за внимание, оставайтесь любопытствующими и отличных всем выходных, ребята! 🙂
Немного рекламы
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99, уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5-2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Maincubes Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?


