Внеклеточная ДНК (вкДНК) обнаруживается в нескольких жидкостях организма (в плазме и сыворотке крови, моче, слюне, синовиальной, перитонеальной и спинномозговой жидкости).
Мы с вами рассмотрим особенности вкДНК в двух жидкостях: крови и моче. Понятно дело, что так удобней для диагностики.
Источники вкДНК в организме.
Как стало известно, вкДНК циркулируют в крови в составе апоптотических телец, микровезикул, нуклеосом, экзосом, нуклеопротеиновых комплексов с белками крови и, предположительно, в свободном виде.
Считается, источниками возникновения вкДНК в крови являются процессы гибели клеток, созревание эритроцитов, секреция ДНК клетками, а также бактерии и вирусы. Сразу отметим, что последний источник, ДНК бактерий и вирусов, вносят очень незначительный вклад в общий пул циркулирующей ДНК, и уровень экзогенной ДНК во время инфекций не превышает нескольких десятков пкг/мл. Тогда как по современным данным, нормальный уровень вкДНК в здоровом организме составляет 3-44 нг/мл в плазме и 50-100 нг/мл в сыворотке крови.
Значительная часть вкДНК в организме вероятно появляется в результате гибели клеток, в процессе апоптоза, некроза и нетоза. Ежедневно в организме взрослого человека посредством программируемой клеточной гибели (апоптоза) гибнет около ста миллиардов клеток, в результате чего деградирует около 1г. ДНК в сутки.
В процессе апоптоза ядерная ДНК расщепляется специальным ферментом ДНКазой. После чего появляются фрагменты ДНК длиной, кратной нуклеосоме, 180-200 п.н., которые в составе апоптотических телец (специальной упаковки после апоптоза) должны быть утилизированы макрофагами. П.Н. — пар нуклеотидов. Ну все знают, что пары нуклеотидов, аденин-тимин и гуанин-цитозин, в нашей ДНК повторяются три миллиарда раз. Нуклеосомы — специальные структуры в составе хроматина, состоящие из белков-гистонов. на которые в полтора оборота наматывается нить ДНК.
Дальше происходит странное. По непонятным причинам, часть ДНК погибших клеток избегает встречи с макрофагами и попадает в кровь. В разное время проводились эксперименты, подтверждавшие апоптотическую природу вкДНК [1,2].
При разделении вкДНК плазмы здоровых доноров с помощью гель-электрофореза обнаруживаются полосы, соответствующие длинам фрагментов 180-200 п.н. и длинам, кратным этому числу, что соответствует межнуклеосомному расщеплению хроматина при апоптозе.
Обнаружение ДНК плода в крови матери также говорит в пользу апоптоза как источника вкДНК [3].
В норме некроз вносит менее значительный вклад в появление вкДНК, увеличивая её количество при тяжёлых травмах. Некротическая вкДНК в плазме обнаруживается в виде более длинных фрагментов – длиной свыше 10 тысяч п.н. С помощью метода ПЦР (полимеразной цепной реакции) возможно различить длинные фрагменты вкДНК, появляющиеся в результате некроза и более короткие фрагменты – из-за апоптоза.
Кроме апоптоза и некроза существует ещё один малоизвестный вид клеточной гибели, являющийся источником вкДНК — нетоз (NETosis).
При нетозе клетки нейтрофилы выбрасывают специальные сетеподобные структуры, внеклеточные нейтрофильные ловушки (NET, Neutrophil Extracellular Trap), задача которых – дезактивация проникшего в организм патогена: вирусов, грибов и бактерий. При этом нейтрофил гибнет, выбрасывая ДНК, гистоны, различные белки и ферменты во внеклеточное пространство. Известно, что иногда процесс NET носит патологический характер, способствуя развитию тромбоза, сердечно-сосудистых, аутоиммунных заболеваний, а также рака.
Недавно, в 2018 году было обнаружено, что при ВИЧ-инфекции происходит гиперактивация нейтрофилов, механизма NET и нетоза. В результате чего происходила обширная гибель иммунных клеток, захваченных сетями нейтрофилов, CD4+ и CD8 + Т-клеток, В-клеток и моноцитов, и развитие сопутствующих сердечно-сосудистых патологий [4].
Ещё один потенциальный источник вкДНК – секреция ДНК нормальными и опухолевыми клетками. Ещё в 1972 году было получено доказательство активного выделения ДНК лимфоцитами во внеклеточную среду [5].
Наличие такое феномена, как выделение ДНК клетками во внеклеточную среду предполагает существование специальных механизмов переноса ДНК через клеточную мембрану. В ходе исследований было установлено, что высвобождение ДНК из лимфоцитов происходит при активном действии трипсина, проназы и плазмина на фоне дефицита ионов Са2+ и Mg2+. Избыток же ионов кальция ингибирует выход ДНК из клетки [6].
По мнению российских биохимиков из Казанского государственного университета, ещё одним вероятным источником вкДНК в крови может быть совсем неизвестная форма цитоплазматической ДНК, отличная от ядерной и митохондриальной – ДНК, ассоциированная с мембраной диплоидных лимфоцитов человека (Membrane-Associated DNA in the Cytoplasm of Diploid Human Lymphocytes) [7].
Несмотря на то, что этот тип ДНК был открыт в 1971 году, он и сейчас остаётся неизученным, и по нему есть считанные работы одних и тех же авторов, хотя и в PNAS и Nature.
По предположению Абрамовой З.И. с соавторами какая-то часть вкДНК может формироваться из этой цитоплазматической ДНК, на что указывают характерные особенности некоторых фрагментов вкДНК, отличные от ядерной и митохондриальной [6].
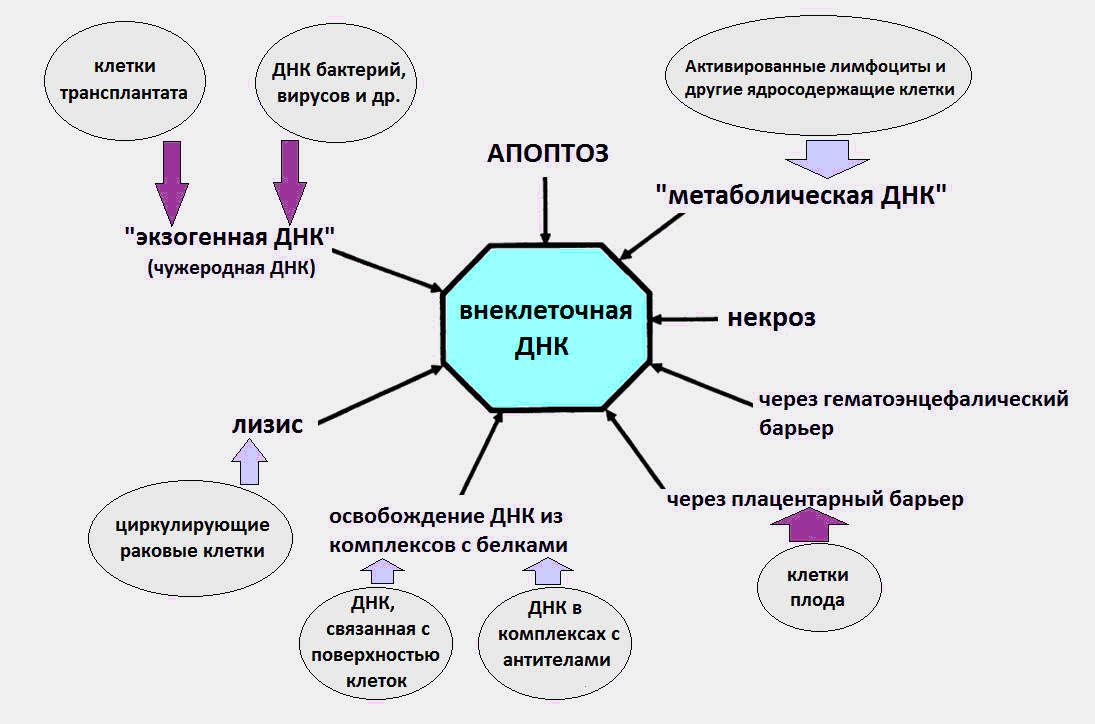
Рис.1 Различные пути, которыми вкДНК попадает в циркуляцию.
Более подробно обо всех аспектах биологии вкДНК (иммуномодулирующих эффектах, рецепции к вкДНК на поверхности клеток и пр.) можно прочесть в подробном обзоре профессора Козлова В.А. (НИИ клинической иммунологии СО РАМН) [8].
Внеклеточное ДНК как биомаркер при различных патологиях
Логика подсказывает, что уровни вкДНК должны изменяться при патологиях, которые сопровождает массовая клеточная гибель. В ряде исследований было показано значимое повышение уровней вкДНК при развитии аутоиммунных заболеваний (системной красной волчанки, системной склеродермии, ревматоидного артрита и др.), и что существуют характерные особенности вкДНК, типичные для определённой аутоиммунной патологии [8-10].
Также известно, что при остром инфаркте миокарда, который сопровождает гибель клеток сердца по типу как некроза, так и апоптоза, уровни вкДНК также повышаются. И это имело потенциальное диагностическое значение, поскольку у пациентов, у которых развились осложнения, были более высокие уровни, чем у тех, кто восстанавливался лучше [11].
У больных, перенёсших острый инсульт, концентрация вкДНК в плазме крови, измеренная в течении 24 часов, коррелирует с тяжестью инсульта и может служить предиктором смертности и тяжести исхода даже у тех пациентов, у которых нет видимых изменений, обнаруживаемых методами нейровизуализации [12,13].
Известно, что для вкДНК характерно наличие большое количества гуанин-цитозин (ГЦ)-последовательностей, которые более устойчивы к разрушению нуклеазами, чем аденин-тимин-фрагменты ДНК. Так, содержание специфической ГЦ-обогащенной последовательности генома — транскрибируемой области рибосомного повтора — в составе вкДНК в несколько раз превышает содержание этого повтора в ядерной ДНК [14].
А при хронических патологиях, сопровождающихся активацией клеточной гибели (ишемической болезни сердца, артериальной гипертонии, аутоиммунных патологиях), содержание этих ГЦ-богатых маркерных последовательностей в вкДНК крови увеличивается в 10 и больше раз [15].
Что даёт полную возможность использовать показатели ГЦ-обогащённой рибосомной ДНК в составе вкДНК в качестве биомаркера хронически протекающего патологического процесса.
При борьбе с раком стоит задача обнаружить опухоль на самой ранней стадии, когда её только вообще можно обнаружить.
Тут вкДНК представляет крайний интерес, как биомаркер опухолегенеза.
Точечные мутации в опухолевой вкДНК обнаруживались в крови пациентов задолго до постановки диагноза[16].
Про уровни вкДНК при онкологии, поиску в составе вкДНК характерных для канцерогенеза мутаций, таких, как онкогены KRAS, TP53, HER2, BRCA1, APC, PIK3CA, BRAF и др., использованию в качестве маркера митохондриальной ДНК в составе вкДНК, изучению характерных генетических и эпигенетических изменений вкДНК, таких, как гипометилирование подвижных элементов Alu, при возникновении опухолей, использования «индекса целостности» вкДНК и прочих аспектов можно прочесть в работах Васильевой и соавт., Gonzalez-Masia и соавт. [17, 18].
Установлено, что для вкДНК характерно гораздо более сильная степень окисления под воздействием активных форм кислорода (АФК), чем для ядерной ДНК.
Так, содержание хорошо известного маркера окисления ДНК, 8-охоdG, в составе ядерной ДНК в норме и при различных патологиях колеблется от 1 до 10 на миллион нуклеотидов, а в составе вкДНК содержание этого маркера составляет 300 и более на миллион нуклеотидов [19].
Резкое повышение содержание 8-охоdG во вкДНК установлено при онкологии и сердечно-сосудистых заболеваниях, которые сопровождаются окислительным стрессом, и может достигать значений в 3000 8-oxodG на миллион нуклеотидов [20].
В целом, считается, что уровни 8-охоdG в составе вкДНК представляют собой чувствительный маркер общего окислительного стресса в организме.
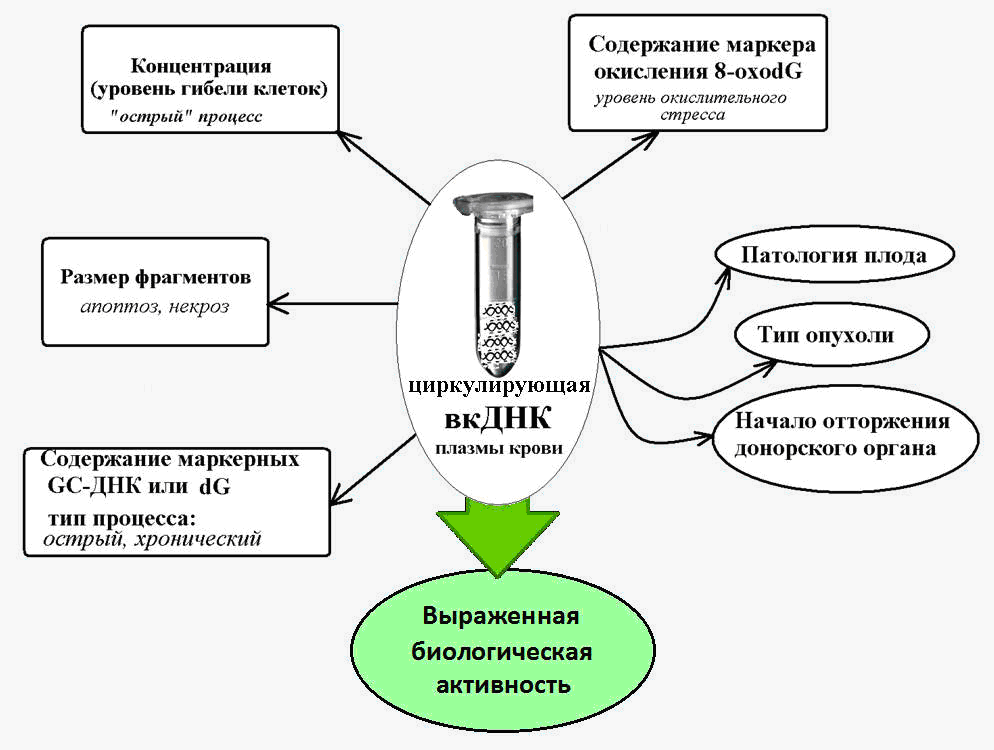
Рис. 2. Циркулирующая внеклеточная ДНК – маркер при различных патологических состояниях, сопровождающихся повышенной гибелью клеток.
Внеклеточное ДНК как мобильный элемент.
Большой и очень важный прорыв в исследованиях роли вкДНК во внутренних процессах произошёл 3 года назад. В 2015 году группой исследователей было сделано захватывающее открытие, показавшее, что вкДНК, подобно мобильным генетическим элементам, способна внедряться в ядерную ДНК и вызывать мутации в геноме [21]. Всё это очень удивительно.
В более ранних работах уже было показано, что опухолевая ДНК из крови может иметь способность встраиваться в ядерную ДНК. Мышиные фибробласты помещали в плазму, взятую у пациентов с раком толстой кишки, после чего в ДНК клеток мыши обнаруживались онкогены K-ras и гены белка р53, участвующего в апоптозе, а сами клетки были онкогенно трансформированы (при введении здоровым мышам вызывали рак) [22].
Что свидетельствует о том, что ДНК из плазмы была поглощена и интегрирована помещёнными в неё клетками. Это предполагаемое явление, поглощение здоровыми клетками онкогенов из циркулирующей в крови вкДНК, может быть ответственно за процесс метастазирования и получило название «генометастаз».
В другой работе были предоставлены данные о поглощении и интеграции фрагментов гена DYS14, специфичного для Y-хромосомы, в мозге женщины, вынашивавшей плод мужского пола [23].
Итак, в исследовании 2015 года учёные проследили, как флуоресцентно меченые вкДНК, взятые у больных раком и здоровых людей, без проблем встраивались в ядерную ДНК мышиных фибробластов в опытах in vitro (т.е вне живого организма, в клеточных культурах).
Причём человеческая вкДНК локализовалась в ядрах мышиных клеток в течение нескольких минут, и почти 100% ядер клеток мыши показывали флуоресцентные сигналы в течение 30 минут.
Секвенирование всего генома мышиных клеток показало присутствие в нём фрагментов ДНК человека, включая характерные мобильные элементы Alu. Кроме этого, авторы обнаружили индукцию γ-H2AX-очагов, возникающих при повреждении ДНК, а также повышение активности каспазы-3 и экспрессии генов ATM, p53, p21, GADD-34 и ДНК-лигазы. Что всё вместе свидетельствует о повышенной нестабильности генома, активации реакции ответа на повреждения ДНК и апоптоза.
Затем авторы проверили действие чужеродной вкДНК in vivo, на живом организме. Мышам внутривенно вводили человеческую вкДНК, фрагменты которой затем обнаружили в сердце, легких, печени и мозге мышей, умерщвленных через 7 дней после инъекции.
Причём ведённые мышам частицы человеческой ДНК оказались способны преодолевать гематоэнцефалический барьер и проникать в мозг. Как и в случае с клетками в культуре, внутривенное введение вкДНК вызывало индукцию γ-H2AX, проапоптотической каспазы-3 и активацию ответа на повреждения ДНК. И именно ответ на повреждение ДНК, по мнению учёных, играет центральную роль интеграции вкДНК в ядерную.
Ядерная ДНК воспринимает внедрение внеклеточной как двухцепочечный разрыв и начинает «латание» самой себя, встраивая циркулирующую ДНК в свой состав: «Активирование ответа на повреждение ДНК объединяет несколько разнородных вкДНК и фрагментированный хроматин в длинные конкатемеры посредством негомологичного соединения концов в рамках процесса восстановления».
В итоге авторы приходят к парадоксальному выводу: «Будучи повсеместным и постоянно возникающим, повреждение ядерной ДНК, вызванное внеклеточной циркулирующей ДНК, может быть основной причиной старения, связанных со старением отклонений и окончательной гибели организма. Таким образом, ДНК, возможно, играет парадоксальную роль как хранителя основ жизни, так и разрушителя самой жизни».
Надо ли говорить, что этот вывод очень сильно противоречит всем представлениям о старении на сегодняшний день.
Логика подсказывает, что этой гипотезе соответствовала бы следующая зависимость – чем больше продолжительность жизни особей вида, тем меньше у них этой формы ДНК и/или она для них менее опасна.
Но до тех пор, пока такое сравнительное исследование не выполнено, остается полагать, что у долгоживущего вида (человек) и короткоживущего (мышь) вкДНК производятся, предположительно, в относительно сравнимых уровнях. И обнаружение повышенных концентраций этих молекул у пожилых вполне может быть наоборот следствием процесса старения, а не его причиной.
Хотя это такое следствие, которое может усиливать причину. Читай статью Беликова.
Кроме этого, авторы открытия предлагают отнести вкДНК к ещё одному классу мобильных генетических элементов. И тогда возможно получит своё объяснение широкое участие в эволюции такого процесса, как горизонтальный перенос генов, как у беспозвоночных, так и позвоночных представителей животного мира. Благодаря которому, по одним из последним данным, геном человека мог заимствовать у других видов несколько десятков генов [24]
Остаётся открытым очень важный вопрос: как именно вкДНК попадают в клетку? Имеющиеся гипотезы включают предположения, что частицы, содержащие ДНК, могут проникать в клетки через имеющиеся в мембране поры, а также посредством разных типов эндоцитоза, протеогликан-зависимого макропиноцитоза или при взаимодействии с мембранными белками.
Внеклеточное ДНК при ожирении, воспалении, рентгеновском облучении и стрессе различной природы
Ещё одно интересное открытие было сделано год спустя японскими исследователями. Они смогли описать активное участие вкДНК, появившейся в крови в результате гибели адипоцитов у людей с ожирением, в развитии воспаления и резистентности к инсулину. Ключевым фактором, взаимодействующим в этих процессах с вкДНК, была молекула врождённого иммунитета Toll-подобный рецептор 9 (TLR9) [25].
Не обошлось и без интриги со стороны российских учёных из Института теоретической и экспериментальной биофизики РАН. Они установили, что рентгеновское облучение и антидиабетический препарат метформин вызывают увеличение выведения с мочой вкДНК (ядерной и митохондриальной) у крыс.
Их данные показали, что до опытов количество ядерной вкДНК было на 40% выше, а митохондриальной вкДНК — на 50% выше в моче пожилых крыс по сравнению с молодыми.
Через 12 ч после облучения содержание я-вкДНК и мт-вкДНК в моче молодых крыс увеличилось на 200% и 460% соответственно по сравнению с контролем, тогда как в моче пожилых крыс оно стало на 250%. и 720% выше.
Через 6 ч после введения метформина другим крысам, количество я-вкДНК и мт-вкДНК в моче молодых крыс было повышено на 25% и 55% и на 50% и 160% в моче пожилых крыс.
По мнению авторов, эти данные говорят о том, что рентгеновские лучи и метформин вызывают значительное увеличение вкДНК в моче крыс (особенно старых), вызванное активной гибелью клеток в тканях. Эти результаты также позволяют предположить, что метформин, возможно, действует как сенолитик, инициируя гибель старых клеток, содержащих структурные и функциональные нарушения [26].
В октябре прошлого года, учёные проследили взаимосвязь уровней вкДНК с психическим стрессом и физическими нагрузками у молодых людей в возрасте 18-36 лет. Результаты показали двукратное увеличение вкДНК после острого психосоциального лабораторного стресса (TSST) и пятикратное увеличение вкДНК после упражнений на беговой дорожке (с достижением истощения сил бегущего).
Было также зафиксировано повышенное количество более коротких фрагментов вкДНК, характерное для апоптоза, в крови после физического истощения.
Внеклеточная митохондриальная ДНК показала одинаковое увеличение после обеих стрессовых нагрузок. Кроме этого, профили метилирования вкДНК, используемые в этой работе в качестве маркера для различного клеточного происхождения, значительно различались для разных стресс-тестов.
Для анализа метилирования учёными был выбран активно участвующий в эмбриональном развитии ген HOXA5 из-за специфичности его метилирования в разных типах клеток. Так, для него характерно гиперметилирование в мышечных клетках, гипометилирование в клетках мозга, из клеточных линий гиппокампа и культивируемых нейронов, и дифференциальное метилирование в клетках крови.
Метилирование гена HOXA5 во вкДНК понижалось сразу после психосоциального стресса и увеличивалось после физического стресса, что, по мнению авторов, указывает на различные клеточные источники активного высвобождения ядерной ДНК. [27].
Внеклеточное ДНК и старение.
Теперь главное. Рассмотрим взаимосвязь уровней и специфических особенностей вкДНК со старением.
Первые работы, показавшие такую взаимосвязь, были опубликованы в 2011-13 годах. Финские микробиологи и иммунологи из университета Тампере изучили показатели вкДНК у долгожителей старше 90 лет, участников исследования Vitality 90+, и у молодых людей (в возрасте 22-37 лет) в качестве контрольной группы.
Результаты их работ показали, что концентрация вкДНК у долгожителей была значительно выше, чем у молодых. Также были характерные различия вкДНК: у старых людей она была представлена больше низкомолекулярными фрагментами, у молодых – больше высокомолекулярными, то есть более длинными.
В следующих работах эта же группа показала, что уровни вкДНК имели чёткую взаимосвязь с маркерами воспаления (положительно коррелировали с уровнем С-реактивного белка, сывороточного амилоида А (SAA) и др.) и смертностью у людей старше 90 лет.
А также то, что более высокие уровни общей и гипометилированной вкДНК были связаны с системным воспалением и развитием старческой астении (frailty) [28-30].
Два самых свежих последних прошлогодних исследования по вкДНК и старению показали характерные эпигенетические изменения этой ДНК.
В одном из них команда учёных проанализировала, как с возрастом изменяется метилирование мобильных генетических элементов LINE-1 и Alu во вкДНК здоровых людей, в возрасте от 23 до 61 года. Элемент LINE-1 имеет длину около 6 тыс.п.н., тогда как высокомолекулярные фрагменты вкДНК, для сравнения, имеют размер более 10 тыс. п.н.
LINE-1 относится к ретроэлементам, т.е. к мобильным элементам, которые для своего размножения используют обратную транскрипцию, перенос генетической информации с РНК на ДНК. LINE-1 — единственный известный на сегодня мобильный элемент генома, который сохраняет способность к размножению и перемещению своих копий в геноме. Также это самый многочисленный из подвижных структур человека: копии LINE-1 занимают в ДНК огромную долю — пятую часть всего генома.
Второй элемент, Alu, не может самостоятельно размножаться и делать новые вставки в геном, и зависит в этом процессе от генетического аппарата элемента LINE-1 (подробнее о ретроэлементах генома см. статью в Популярной Механике “Ретровирусы: «пятая колонна» ДНК” www.popmech.ru/science/178711-retrovirusy-pyataya-kolonna-dnk/#part0)
Результаты исследования показали, что по мере старения происходит значимое уменьшение метилирования ретроэлементов LINE-1 и Alu, причём этот процесс заметно интенсивнее проходил у курильщиков.
Как сегодня установлено, активность элементов LINE-1 и Alu, которые способны вставлять свои копии в геном, вносят вклад в значительную часть генетических заболеваний человека и рака.
Известно о более 100 опосредованных LINE-1 инсерциях (вставках), которые приводят к генетическим заболеваниям человека и найдено несколько вставок LINE-1, которые прерывают гены-супрессоры опухолей и провоцируют рак [31].
Во втором исследовании также учёные подтвердили снижение с возрастом метилирования элементов LINE-1 и Alu в составе вкДНК. Причём, среди 4 групп в исследовании (здоровые долгожители старше 100, нездоровые долгожители старше 100 лет, пожилые люди, 71 год и молодые люди, 25 лет) схожие характеристики вкДНК имели здоровые долгожители с молодыми людьми и пожилые люди с нездоровыми долгожителями:
«Постоянно в нашем исследовании мы отмечали большее сходство в профилях вкДНК, как глобально, так и локально между молодыми и здоровыми долгожителями, в отличие от пожилых людей и нездоровых долгожителей. Следовательно, наше исследование предполагает, что профилирование вкДНК может быть использовано не только в качестве биомаркера возраста, но и в качестве предиктора общего состояния здоровья». [32].
Таким образом, как мы видим, внеклеточная циркулирующая ДНК оказалась тесно связана с состоянием здоровья и процессами, происходящими в организме в ходе старения: окислительным стрессом, воспалением и возрастзависимыми патологиями.
Современные методы исследования, такие, как количественная ПЦР в реальном времени, позволяют использовать вкДНК в качестве очень чувствительного биомаркера процессов, связанных со старением.
Проведённые исследования показали большую потенциальную ценность анализа вкДНК в диагностике рака, в траспланталогии, при сердечно-сосудистых заболеваниях и болезнях почек, фиброзе, в пренатальной диагностике (во время беременности), при травмах и сепсисе, а также в спортивной медицине.
Полученные данные о том, что вкДНК может проявлять свойства мобильного элемента и встраиваться в ядерную ДНК, тем самым влияя на развитие связанных с мутациями патологий и старением в целом, также представляют несомненный интерес.
Всё это требует дальнейших исследований и уточнений.
Обзор подготовили: Алексей Ржешевский и немного Михаил Батин
/i>
Список литературы.
1. Jahr S, Hentze H, Englisch S, Hardt D, Fackelmayer FO, Hesch RD, Knippers R. DNA fragments in the blood plasma of cancer patients: quantitations and evidence for their origin from apoptotic and necrotic cells. Cancer Res. 2001 Feb 15;61(4):1659-65.
2. Deligezer U1, Yaman F, Erten N, Dalay N. Frequent copresence of methylated DNA and fragmented nucleosomal DNA in plasma of lymphoma patients. Clin Chim Acta. 2003 Sep;335(1-2):89-94.
3. Bishoff F.Z., Dang D., Horne C., Marquez-Do D., Brincley W.R., Levis D.E. Fetal DNA in maternal plasma circulates as apoptotic bodies: elucidations of structural nature of fetal DNA for non-invasive prenatal genetic diagnosis // Am. J. Hum. Genet. 2003. V. 73. P. 189.
4. Sivanandham R, Brocca-Cofano E, Krampe N, Falwell E, Venkatraman SMK, Ribeiro RM, Apetrei C, Pandrea. Neutrophil extracellular trap production contributes to pathogenesis in SIV-infected nonhuman primates. J Clin Invest. 2018 Nov 1;128(11):5178-5183.
5. Rogers J.C., Boldt D., Kornfeld S. Excretion of deoxyribonuclein acid by lymphocytes stimulated with phytohemagglutinin or antigen // Proc. Nat. Acad. Sci. USA. 1972. V. 69, No 7. P. 1685–1689.
6. Туаева Н.О, Абрамова З.И. Внеклеточная ДНК в кровотоке человека. 2007. Учебные записки Казанского государственного университета. Т.149, с.23-32.
7. Lerner R.A., Meinke W., Goldstein D.A. Membrane-associated DNA in the cytoplasm of diploid human lymphocytes // Proc. Nat. Acad. Sci. USA. 1971. V. 68, No 6. P. 1212–1216.
8. Козлов В.А. Свободная внеклеточная ДНК в норме и при патологии. Медицинская иммунология. 2013;15(5):399-412.
9. Galeazzi M, Morozzi G, Piccini M, Chen J, Bellisai F, Fineschi S, Marcolongo R. Dosage and characterization of circulating DNA: present usage and possible applications in systemic autoimmune disorders. Autoimmun Rev 2003;2:50-5.
10. Leon SA, Revach M, Ehrlich GE, Adler R, Petersen V, Shapiro B. DNA in synovial fluid and the circulation of patients with arthritis. Arthritis Rheum 1981;24:1142-50.
11. Destouni A, Vrettou C, Antonatos D, Chouliaras G, Traeger-Synodinos J, Patsilinakos S, et al. Cell-free DNA levels in acute myocardial infarction patients during hospitalization. Acta Cardiol 2009;64:51-7.
12. Rainer TH, Wong LKS, Lam W, Yuen E, Lam NYL, Metreweli C, Lo YMD. Prognostic Use of Circulating Plasma Nucleic Acid Concentrations in Patients with Acute Stroke. Clin Chem 2003; 49:562-9.
13. Lam NY, Rainer TH, Wong LK, Lam W, Lo YM. Plasma DNA as a prognostic marker for stroke patients with negative neuroimaging within the first 24 h of symptom onset. Resuscitation 2006; 68:71-8.
14. Вейко Н.Н., Булычева Н.В., Рогинко О.А., Вейко Р.В., Ершова Е.С., Коздоба О.А., Кузьмин В.А., Виноградов А.М., Юдин А.А., Сперанский А.И., Фрагменты транскрибируемой области рибосомного повтора в составе внеклеточной ДНК — маркер гибели клеток организма, Биомедицинская химия, 2008, том: 54(1), 78-93.
15. Bulicheva, N. et al. Effect of cell-free DNA of patients with cardiomyopathy and rDNA on the frequency of contraction of electrically paced neonatal rat ventricular myocytes in culture. Ann N Y Acad Sci. 2008. V. 1137. P. 273-277.
16. Lecomte, T. Circulating free tumor DNA and colorectal cancer/ T. Lecomte, N. Ceze, E.
Dorval, P. Laurent-Puig // Gastroenterol Clin Biol. 2010. V. 34. № 12. P. 662- 681.
17. Васильева И.Н, Беспалов В.Г. Роль внеклеточной ДНК в возникновении и развитии злокачественных опухолей и возможности её использования в диагностике. Вопросы онкологии. 2013.-N 6.-С.673-681
18. Gonzalez-Masia, J.A. et al. Circulating nucleic acids in plasma and serum (CNAPS): applications in oncology. Onco Targets Ther. 2013. V. 8. № 6. P. 819-32.
19. Ermakov, A.V. et al. Oxidized extracellular DNA as a stress signal in human cells. Oxid Med Cell Longev. 2013. V. 2013. P. 649-747.
20. Loseva, P. et al. Extracellular DNA oxidation stimulates activation of NRF2 and reduces the
production of ROS in human mesenchymal stem cells. Expert Opin. Biol. Th. 2012. V.12. № 1. P. 85-97.
21. Mittra I, Khare NK, Raghuram GV, et al. Circulating nucleic acids damage DNA of healthy cells by integrating into their genomes. J Biosci. 2015;40(1):91–111.
22. Garcia‐Olmo DC, Dominguez C, Garcia‐Arranz M, Anker P, Stroun M, Garcia‐Verdugo JM, Garcia‐Olmo D (2010) Cell‐free nucleic acids circulating in the plasma of colorectal cancer patients induce the oncogenic transformation of susceptible cultured cells. Cancer Res. 70, 560–567
23. Chan W, Gurnot C, Montine TJ, Sonnen JA, Guthrie KA, Lee Nelson J (2012) Male Microchimerism in the Human Female Brain. PLoS ONE 7, e45592.
24. Crisp A, Boschetti C, Perry M, et al.: Expression of multiple horizontally acquired genes is a hallmark of both vertebrate and invertebrate genomes. Genome Biol. 2015;16:50. 10.1186/s13059-015-0607-3
25. Sachiko Nishimoto, Daiju Fukuda et al. Obesity-induced DNA released from adipocytes stimulates chronic adipose tissue inflammation and insulin resistance. Sci Adv. 2016 Mar; 2(3): e1501332.
26. Gaziev A, Abdullaev S, Minkabirova G, Kamenskikh K. X-rays and metformin cause increased urinary excretion of cell-free nuclear and mitochondrial DNA in aged rats. J Circ Biomark. 2016 Oct 25; 5:1849454416670782.
27. Hummel EM, Hessas E, Müller S, Beiter T, Fisch M, Eibl A, Wolf OT, Giebel B, Platen P, Kumsta R, Moser DA Transl Psychiatry. 2018 Oct 29;8(1):236.
28. Jylhävä J1, Kotipelto T, Raitala A, Jylhä M, Hervonen A, Hurme M. Aging is associated with quantitative and qualitative changes in circulating cell-free DNA: the Vitality 90+ study.
Mech Ageing Dev. 2011 Jan-Feb;132(1-2):20-6.
29. Jylhävä J1, Jylhä M, Lehtimäki T, Hervonen A, Hurme M. Circulating cell-free DNA is associated with mortality and inflammatory markers in nonagenarians: the Vitality 90+ Study. Exp Gerontol. 2012 May;47(5):372-8.
30. Jylhävä J1, Nevalainen T, Marttila S, Jylhä M, Hervonen A, Hurme M. Characterization of the role of distinct plasma cell-free DNA species in age-associated inflammation and frailty. Aging Cell. 2013 Jun;12(3):388-97.
31. Lars Erichsen,a Agnes Beermann et al. Genome-wide hypomethylation of LINE-1 and Alu retroelements in cell-free DNA of blood is an epigenetic biomarker of human aging. Saudi J Biol Sci. 2018 Sep; 25(6): 1220–1226.
32. Teo YV, Capri M, Morsiani C, Pizza G, Faria AMC, Franceschi C, Neretti N. Cell-free DNA as a biomarker of aging. Aging Cell. 2019 Feb;18(1):e12890.
Источник


