В молодости Клаус Шультен воображал, что станет танцором, и будет жить не полагаясь ни на что, кроме собственного разума и тела. «Но танцор из меня вышел никудышный, – вспоминает он. – Итак, следующим вариантом жизненного пути для меня была теоретическая физика. Только я, карандаш, бумага, ну и ластик, разумеется.»
Строго говоря, эта мечта тоже сорвалась. Но сегодня Шультен полагается на самое мощное и дорогое вычислительное оборудование в мире для применения вычислительной физики к моделированию биологических систем. Его последняя работа включала молекулярное моделирование целой органеллы, которая преобразует энергию света в химическую энергию внутри фотосинтезирующей бактерии.
Предыдущие части: первая, вторая, третья.
Оглавление
Транслоконы: дамбы Теночтитлана
Прекрасный древний ацтекский город Теночтитлан был построен посреди озера и процветал в XV веке. При изучении археологических свидетельств, которые собрали воедино то, как он выглядел и функционировал, можно заметить поразительное сходство с живой клеткой. Внутри Теночтитлана было священное пространство, изобилующее храмами и пирамидами, окруженное стеной, подобно тому, как эукариотическая клетка имеет разделенные секции, отделенные мембранами. Внутри островного города-государства существовали всевозможные специализированные кварталы, похожие на органоиды.
У жителей также были формы валюты (например, какао-бобы), которые гомологичны АТФ. Подобно тому, как аквапорины контролируют поток воды в клетке, ацтекский город имел каменный акведук для питьевой воды. Но как основные блага попадают в клетку и выходят из нее? В Теночтитлане было три дамбы. В клетке самым фундаментальным благом, вероятно, являются ее белки. А проходы в клетке, которые позволяют проходить этим критическим молекулам, белкам, называются транслоконами. Транслокон сам по себе является белком, который живет в мембране, и выполняет функцию проводящего канала. Когда Клаус Шультен начал изучать транслоконы в 2005 году, он не мог представить, что его ждет. Это как не знать о всех сокровищах затерянного города, пока они не откопаны, и Шультену придется раскопать некоторые древние исследования, чтобы изучить новую систему, которую он вскоре стал считать сокровищем.
Когда Джеймс “Джей Си” Гумбарт в 2003 году поступил в аспирантуру в Урбана-Шампейн, он ничего не знал о биофизике и предполагал, что в конечном итоге изучит физику конденсированных сред, что было сильной стороной университета. «Но потом, на первом семестре, я пошел на биофизику и был очень заинтригован ею», – вспоминает Гумбарт. Это было лишь вопросом времени, когда студент начнет работать с Шультеном, поскольку вычислительная направленность также импонировала ему.
Летом 2004 года, когда Гумбарт присоединился к группе, Шультен показал ему статью о канале белковой проводимости, которая, по мнению Шультена, была интересной и, возможно, могла бы стать плодотворным проектом. Вероятно, к восторгу Шультена, Гумбарт действительно обратил на это внимание, проявил большую инициативу и продолжал производить впечатляющий объем работы.

Всего за три года Гумбарт и Шультен подготовили три статьи о различных аспектах транслоконов, которые они раскрыли с помощью моделирования. Например, в первой работе Гумбарта они изучали проводящий белок канал, кристаллическая структура которого была получена совсем недавно и о котором мало что было известно. Было ясно, что этот канал выполняет двойную функцию: он либо полностью пропускает белок на другую сторону мембраны, либо помещает его в последнее пристанище внутри мембраны. Пара ученых из Иллинойса решила сосредоточиться на первой функции транслокона. И они действительно раскрыли динамическую картину происходящего. Гумбарт вытащил короткий сегмент аминокислот и увидел, как пробка в канале сдвинулась, чтобы пропустить этот сегмент. Хотя Гумбарт признает, что это был довольно упрощенный подход, он подчеркивает роль компьютера для наблюдения динамических процессов мембранных белков и их функции. Он также подчеркивает, что многому научился (с точки зрения вычислений и науки) в своих ранних исследованиях проводящих белок каналов, и получил знания, которые хорошо послужат ему для следующей одиссеи, которая вот-вот начнется.
Примерно в то время, когда Шультен изучал транслоконы, его научные интересы внезапно расширились и включили в себя увлекательную и массивную молекулярную машину – рибосому, биологическую фабрику, которая собирает белки клетки. В 2004 году один экспериментатор обратился к Шультену на конференции и попросил его помочь решить дилемму, связанную со структурами рибосом, полученными двумя различными типами микроскопов. Один тип микроскопа включает в себя рентгеновскую кристаллографию, которая выдает структуру высокого разрешения; другой тип электронная микроскопия, которая генерирует структуры низкого разрешения. Этот экспериментатор (Иоахим Франк) получал структуры рибосом с помощью криоэлектронной микроскопии и нуждался в помощи, включающей данные высокого разрешения (от рентгеновской кристаллографии, сгенерированной другими) в его карты. По аналогии рассмотрим две фотографии: на одной птица сидит на проводе, а на другой – птица в полете. Изображение птицы в полете захватывает птицу в процессе полета (ее функция), но имеет низкое разрешение. Однако представьте себе, что первый снимок может запечатлеть мельчайшие детали, вплоть до каждого пера. Если бы каким-то образом можно было использовать все мелкие детали неподвижной птицы и применить их к птице в полете, можно было бы объяснить функцию птицы – полет. Поэтому задача Шультена состояла в том, чтобы взять данные рентгеновской кристаллографии и поместить их в карты криоэлектронной микроскопии; эти карты электронной микроскопии были действительно способны захватить рибосому в процессе выполнения ее функции, в отличие от рентгеновской микроскопии.
Шультен оценил свои силы и согласился на проект. Его группа работала над большими системами в течение десятилетий, у него были собственные программные продукты в качестве инструментов, и у него была группа студентов, одаренных в вычислительном искусстве. Результатом стал метод, названный MDFF или молекулярная динамика с адаптивной подгонкой, и он дебютировал в 2008 году. Более подробную информацию о генезисе MDFF можно найти в этой истории. Достаточно сказать, что она открыла Шультену захватывающий мир рибосомы.
Но как рибосома связана с проводящим белок каналом? Как уже отмечалось, рибосомы производят белки, которые в процессе построения выходят из своего туннеля, а затем должны свернуться и отправиться в свой дрейфующий путь. Один из вариантов заключается в том, что зарождающийся белок может жить в цитозоле клетки. Или его судьбой может быть путешествие через мембрану наружу. Третий вариант – зарождающийся белок может быть предназначен для жизни внутри мембраны. Для этих двух последних вариантов белок-проводящий канал направляет зарождающийся белок к цели. В 2007 году Шультену и Гумбарту стало известно о группе, которая опубликовала карту рибосомы в комплексе с ее белково-проводящим каналом полученную с помощью криоэлектронной микроскопии. (Этот канал известен как SecY). Это интригующая система – сразу две макромолекулы, каждая из которых влияла на другую. Более подробно о функции рибосомы можно было бы узнать, если бы ее изучали в тандеме с проводящим белок каналом, который на нее влиял. И Шультен и Гумбарт поняли, что они могут генерировать структуры высокого разрешения каждой части дуэта, чтобы в конечном итоге скорректировать карту электронной микроскопии. Это казалось идеальной работой для MDFF. Гумбарт даже отправился в Бостон, чтобы получить карту электронной микроскопии от экспериментаторов, создавших комплекс.
Это было одно из первых применений нового метода MDFF для группы Шультена. Гумбарт рассказывает, что группа все еще отлаживала метод, когда он работал над этим комплексом рибосомы плюс канал в январе 2008 года, но это было очень захватывающее время, особенно приятно было видеть, как структуры почти волшебным образом вписываются в электронную плотность. MDFF скомпоновал комплекс из 2,7 миллиона атомов, который включал рибосому, белок-проводящий канал, мембрану и воду – самый большой на тот момент в группе Шультена. Исследователи действительно могли видеть, как рибосома вызывала небольшую дестабилизацию в пробке канала. Это был очень успешный проект, и он был лишь прелюдией к тому, что должно было произойти.
В процессе работы над MDFF Шультен скооперировался с экспериментатором в Мюнхене, биохимиком по имени Роланд Бекман, который сумел выловить активирующие системы с помощью своего электронного микроскопа. Бекман уже работал над электронной микроскопией рибосомы, соединенной с проводящим белок каналом, когда он и Шультен объединили усилия. На самом деле, проект Шультена и Бекмана принес обеим командам научную публикацию, в которой MDFF был использован Гумбартом для карты канала связанного с рибосомой.
Клаус Шультен навсегда запомнит свой первый визит к Бекману в Мюнхене. Это было в июле 2008 года, и во время встречи Бекман вывел Шультена на улицу, чтобы показать ему плакат на стене с изображением электронной микроскопии. И Шультен чуть не упал в обморок от восторга, увидев кое-что знакомое. Он сразу же узнал на карте нанодиск, объект, смоделированный в университете Иллинойса. Шультен помогал открывателю нанодиска визуализировать его, так что это было то, над чем Шультен работал в начале своей карьеры. В принципе, открыватель нанодиска, Стив Слигар, хотел изготовить наноразмерный кусок мембраны, чтобы удерживать мембранные белки, поскольку, как уже отмечалось, работа с мембранными белками вне мембраны представляла экспериментаторам много проблем. Итак, Слигар дал миру рецепт создания пучка липидов, удерживаемых вместе двумя белками-каркасами – маленький кусочек мембраны, на который можно посадить белок!
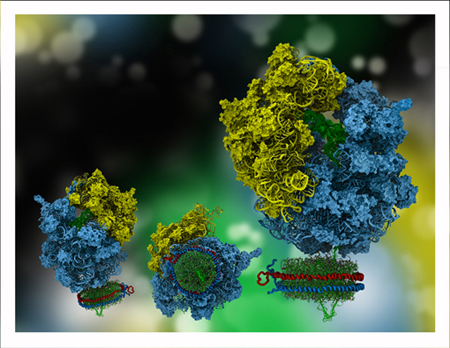
Новшество Роланда Бекмана состояло в том, что он взял рибосому, в которой зарождающийся белок еще не полностью вышел из туннеля рибосомы, и ввел в систему нанодиск – затем зарождающийся белок змеился в канале в нанодиске. В сущности, Бекман поймал моментальный снимок рибосомы с зарождающимся белком, входящим в канал в окружении мембраны. И Клаус Шультен сразу узнал нанодиск. Это о чем-то говорит, потому что, когда Шультен помогал Слигару визуализировать нанодиск еще в 2005 году, он получил лишь косвенную информацию о его форме. В сознании Шультена нанодиск выглядел очень похожим на то, что он видел на стене у Бекмана в тот летний день 2008 года, так что это было подтверждением того образа, который Шультен представил научному сообществу.
Бекман хотел, чтобы опыт Шультена в MDFF позволил создать структуру системы рибосома-нанодиск с высоким разрешением. Гумбарту казалось естественным работать над этим проектом, поскольку он включал в себя проводящий белок канал. Однако, по мнению Шультена, это был сложный проект. А ведь аспирант только начал учиться разбираться в картах электронной микроскопии. «Мне пришлось смотреть на этот канал часами, прежде чем я смог действительно начать мысленно видеть белок, выходящий из него», – рассказывает Гумбарт. Но, к счастью, с ним работали еще два студента-пионера MDFF, чтобы помочь ему разобраться в картах.
Гумбарт и Шультен в конце концов смогли разобраться в сверхсложной, но новаторской системе, которую Роланд Бекман запечатлел с помощью электронного микроскопа. Для Гумбарта это было кульминацией всей его диссертационной работы. Одна из целей, которую они с Шультеном поставили перед собой, состояла в том, чтобы увидеть, как образуются мембранные белки. Для Шультена этот проект с рибосомой и нанодиском был вершиной его карьеры. Он считает, что этот проект подчеркивает, как вычислительная техника (через MDFF) может стать ключевым партнером для экспериментов. Но самое главное, он никогда не ожидал, что снова вернется к нанодиску, и он никогда не думал, что это будет что-то настолько инновационное.
YidC: продолжение для белково-проводящего канала
Скорее всего, проект провалится. Несмотря на это предупреждение Клауса Шультена, постдок Абхишек Сингхарой решил уделить ему все свое внимание. Летом 2013 года Шультен посетил Мюнхен и вернулся с несколькими новыми проектами, один из которых был совместным с группой Роланда Бекмана. Несмотря на мрачное напутствие, Шультен, вероятно, заинтересовался этой темой, потому что она была продолжением его многолетней работы над белковыми проводящими каналами. Для полного удовлетворения рибосомы, зарождающегося белка и транслокона было недостаточно, поскольку было известно, что дополнительный мембранный белок, называемый YidC, иногда помогает каноническому белковому проводящему каналу. Это было мучительно для Шультена, который всегда думал о системах с несколькими белками. Но он полностью отдавал себе отчет в шансах на успех, когда ставил перед Сингхарой задачу: экспериментаторам нужна помощь вычислителей, завершающих работу над структурой YidC.
Видите ли, для YidC не существовало никакой кристаллической структуры. И не было похоже, что она появится в ближайшие годы или десятилетия. Но Роланд Бекман считал, что структура может быть построена даже без дифракции рентгеновских лучей. Экспериментаторы в лаборатории Бекмана, после того как не смогли получить исходную структуру для YidC, обратились к вычислительной группе в своем родном университете (Мюнхенский университет Людвига Максимилиана), известной своими программными инструментами, предназначенными для предсказания структуры белка по последовательности. И на Сингхароя легла следующая задача – работать рука об руку с группой Бекмана над усовершенствованием структуры. Сингхарой использовал бы все инструменты из арсенала группы Клауса Шультена, а экспериментаторы Бекмана, и в первую очередь аспирант Стефан Уиклз, сосредоточились бы на электронной микроскопии и биохимии. Это был прекрасный пример работы компьютера в тандеме с экспериментом. И это было путешествие, полное драм.
Вычислительная группа в Мюнхене (возглавляемая Йоханнесом Седингом) вывела исходную структуру на основе своих программных средств, использующих биоинформатику. Они не только смогли предсказать листы и спирали YidC, но также использовали эволюционный ковариационный анализ, чтобы предсказать, насколько близко одна спираль может быть к другой.
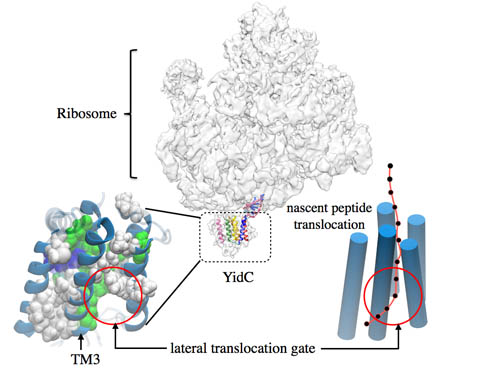
Имея под рукой «входную» структуру, Сингхарой поместил белок YidC в мембрану и начал проводить моделирование молекулярной динамики. «Но это не было обычным моделированием молекулярной динамики», – рассказывает Сингхарой. «Это была динамика ограниченная полученными ранее ковариационными измерениями». После того, как структура была запущена с ограничениями, затем без них, чтобы уравновесить и отобразить расслабленную структуру, пришло время отправить результаты сотруднику-экспериментатору, который проверяет, какие взаимодействия делают эту расслабленную структуру стабильной. Чтобы провести всю эту биохимию, Уиклз менял компоненты и тем самым устранял взаимодействия, которые предполагались как стабилизирующие. И потом весь процесс сызнова – молекулярная динамика с ограничениями и без них, затем биохимические эксперименты. Сингхарой рассказывает, что таким образом они прошли через множество итераций. Все с целью найти наиболее устойчивую структуру.
После этих утомительных повторений Уиклз нашел способ удостовериться, что очередная структура Сингхароя была истинным энергетическим минимумом, а не каким-то локальным, в котором задержался YidC, потому что время моделирования было недостаточно длительным. Уиклз провел химический эксперимент по сшиванию. В принципе, если два остатка (парочка определенных аминокислот) расположены близко, то после добавления к ним группы серы, они могут образовывать дисульфидную связь, и это может быть сравнительно просто обнаружено, таким образом доказывая, что два рассматриваемых остатка находятся рядом. Чтобы проверить структуру Сингхароя, Уиклз ввел в YidC зарождающийся белок и перекрестно связал некоторые их остатки. И о чудо, они были связаны! Это был самый сильный тест, который показал, что многие итерации окупились, и структура была значимой.
И в разгар этой тяжелой работы, Уиклз узнал немыслимое: их нагоняла другая группа! Вот-вот должна была быть опубликована кристаллическая структура бактериального YidC. Уиклз был на научной конференции, где у него был плакат о его работе над YidC, когда он увидел кристаллическую структуру на другом плакате. Если и было что-то хорошее, так это то, что Уиклз заметил, что его смоделированная структура очень похожа на кристаллическую структуру, которую он видел на конференции.
Это вызвало волну лихорадочных приготовлений к подготовке публикации. Три команды, в принципе, уже были готовы представить доклад, когда Уиклз увидел кристаллическую структуру на конференции. Наконец, после долгих испытаний и невзгод, статья была принята в июле 2014 года и вышла только через три месяца после того, как кристаллическая структура была опубликована командой из Японии. Структура, основанная на модели, которую опубликовала триада команд, была не единственным значительным результатом работы. Благодаря обширной молекулярной динамике, которой руководил Сингхарой, он начал раскрывать некоторые детали того, как на самом деле работает YidC, поскольку он мог видеть его динамически в своих симуляциях. Во-первых, моделирование показало, что дно YidC образует уплотнение. Это имеет смысл, поскольку известно, что YidC является инсертазой, то есть она берет зарождающуюся цепь из рибосомы и направляет эту цепь в сторону ее последнего пристанища в мембране. В процессе, ни один канал не открывается внизу. Вместо этого новообразованный белок проходит через ворота в боку YidC. Моделирование показало, что одна из спиралей, образующих ворота, действует очень похоже на затворку или гибкий закрылок, позволяющий зарождающемуся белку змеиться в мембрану.
В общем, этот проект с самого начала выглядел очень рискованным, но упорство исследователей возобладало. Они даже пережили оказию состоявшую в том, что другая группа тоже получила структуру, и сумели опубликовать свою статью, несмотря на тяжелую ситуацию. Сингхарой указывает, что в будущем предстоит некоторое дальнейшее уточнение моделируемой структуры на основе кристаллической структуры, хотя эти две структуры принадлежат разным бактериям. И, наконец, команды хотят объединить YidC с рибосомой, что, несомненно, принесет больше волнения и интересных исследований и, вероятно, обеспечит более тесное сотрудничество между учеными-вычислителями и учеными-экспериментаторами.
BAR-домены и мембранная скульптура
Новая аспирантка Ин Инь хорошо помнит тот день в 2006 году, когда Клаус Шультен позвал ее в свой кабинет и достал из кармана смятый клочок бумаги. Он протянул ей листок и сказал: «Мы должны поработать над этим», – на бумаге она увидела только три буквы: B…А…R. Не так уж много, для уверенного старта. Но в течение следующих нескольких лет эти три литеры приведут к проекту, в котором будут задействованы все инструменты из арсенала Schulten group. И созвездие факторов сошлось вместе, чтобы произвести прекрасное применение молекулярной динамики. Этот проект, на самом деле, является непревзойденным примером того, как вычислительная биология может дать представление о динамических процессах, связанных с мембранными белками. Ниже мы увидим, как такая клеточная активность как ваяние мембран, была полностью раскрыта от начала до конца.
Что же такое мембранная скульптура? Эукариотическая клетка – это сложное строение с множеством отсеков, отгороженных мембранами. Эти мембраны бывают самых разных форм –плоские, изогнутые, волнистые или правильной формы. Есть также везикулы в клетке, например, в аппарате Гольджи (amazon.com клеточного мира) белки упаковываются внутри мембран (один тип везикул) и отправляются в свой конечный дом, либо в цитоплазму, либо, возможно, высвобождаются наружу клетки. Дело в том, что внутри клетки существует множество мембранных систем, и каждая из них имеет уникальную форму. Но что именно отвечает за появление столь многих различных форм? Часто для «лепки» мембраны в ее окончательный вид используются белки.
Когда Клаус Шультен дал Ин Инь этот листок бумаги с тремя магическими буквами, он на самом деле подразумевал семейство белков, называемых BAR-доменами. Известно, что эти белки изгибают мембраны (во время эндоцитоза и экзоцитоза). На самом деле существует три члена семейства (N-BAR, F-BAR, I-BAR), и в центре внимания Инь вскоре оказались белки N-BAR, для которых уже была известна структура. По мере того как она начинала исследовать белок, она становилась все более и более заинтересованной и все более и более убежденной, что это тема, достойная изучения. И Инь начала обсуждать N-BAR-домены со своим женихом Антоном Архиповым, тоже аспирантом в группе Шультена. Супруги поняли, что могут сотрудничать и тем самым промоделировать то, что раньше казалось невозможным. Даже Шультен не ожидал, что такое моделирование осуществимо. О чем эта парочка догадалась?
Инь и Архипов познакомились в первые же дни учебы в аспирантуре Иллинойского университета в августе 2004 года. Они пересеклись на квалификационном экзамене и поняли, что оба – новички на физическом факультете, Инь из Китая и Архипов из России. Архипов, увлеченный нейробиологией, присоединился к группе, поскольку он узнал о прошлых работах Шультена в области нейробиологии, а затем увлекся идеей вычислительной биофизики, над которой Шультен в настоящее время работал. Инь начала работать в лаборатории физики высоких энергий, но поняла, что хочет заниматься чем-то связанным с жизнью, и Архипов предложил ей присоединиться к группе Шультена.
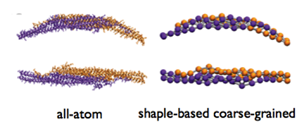
У Архипова было много разнообразных проектов в группе Шультена, и над одним из них он работал вместе с аспирантом Питером Фреддолино, а именно над реализацией крупнозернистой молекулярной динамики в NAMD. В этом методе группы атомов объединялись в эдакие «бусинки». Например, одна бусина может представлять 10 атомов. Хотя это может означать некоторую потерю мельчайших атомных деталей, это, по существу, равносильно возможности управлять молекулярной динамикой в чрезвычайно больших системах и в течение чрезвычайно длительного времени. Архипов занимался двумя видами крупнозернистой молекулярной динамики, одна из которых была основана на остатках, а другая – на форме. Первый имеет разрешение одного остатка (около 10 атомов на шарик), а второй использует группу шариков для представления целого белка (около 150 атомов на шарик).
Архипов фактически использовал крупнозернистую молекулярную динамику на вирусных капсидах в качестве приложения метода. Также в это время аспирантка Эми Ши использовала крупнозернистую молекулярную динамику для упомянутой выше системы нанодисков. «Поскольку Инь работала над BAR-доменами, я, конечно, обсуждал это с ней просто из любопытства», – рассказывает Архипов. «И мы вместе решили, что это может быть хорошим применением крупнозернистой динамики.» Супруги рассказывают, что Шультен очень поддержал их предложение о сотрудничестве. К слову, Шультен сотрудничает со своей женой, химиком, уже около сорока лет и понимает как выгоды, так и потенциальные профессиональные опасности сотрудничества мужа и жены в науке. Инь и Архипов поженились в 2008 году.
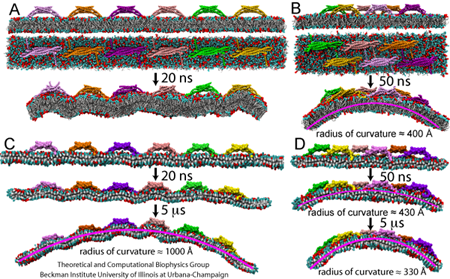
В первой работе Инь и Архипов поместили один доменный белок, который имеет форму более или менее похожую на банан, на участок мембраны и наблюдали, как молекулярная динамика показала, что мембрана рядом с белком изгибается, чтобы соответствовать кривой серповидного белка. На следующем шаге, они поместили шесть BAR-белков в линию на участке мембраны. Единственная причина, по которой они могли просто попытаться совершить такой подвиг, была новая крупнозернистая функция NAMD. Без упрощенного представления этот финт потребовал бы обсчитать несколько миллионов атомов, что не позволило бы моделировать достаточно долго, чтобы увидеть, согнули ли шесть белков мембрану. Когда шесть стержневых белков образовали волнистую форму, они попытались сложить шесть белков в виде решетки. Вуаля! Они наткнулись на конфигурацию, которая произвела красивую кривизну. Это была решетка из BAR-белков.
Шультен рассказывает, что, когда они попытались опубликовать свои результаты с решеткой BAR-доменов, у них возникли проблемы. Эксперты отмечали, что для клеток не характерны высокие концентрации BAR-белков, поэтому моделирование казалось нереалистичным. «Но потом кому-то удалось сделать электронные микрофотографии мембран вместе с BAR-доменами», – отмечает Шультен. «А потом они увидели, что те образуют именно ту решетку, о которой мы говорили!» Так что теперь казалось вероятным, что многие BAR-домены работали вместе, чтобы лепить мембраны. Вскоре после этого работа была принята.
В качестве грандиозного финала Шультен, Инь и Архипов решили действительно проверить новый метод – крупнозернистую молекулярную динамику, и посмотреть, смогут ли они сформировать трубку из плоского участка мембраны. «Психологически, и просто как демонстрация силы метода, ничто не может быть лучше, чем фактически показать формирование трубки целиком», – отмечает Архипов. Поэтому Инь поместила сеть из N-BAR-белков на кусок мембраны в 200 нанометров в квадрате, передала свою работу суперкомпьютеру и стала ждать. И ждала она почти 200 дней. Однако Инь рассказывает, что она проверяла прогресс несколько раз в день и часто видела одно и то же изо дня в день – трубка не закручивалась. Шультен велел ей набраться терпения. И вот однажды образовалась идеально закрытая трубка! Все трое ученых были в восторге. Крупнозернистая молекулярная динамика могла дать масштабный обзор процесса лепки мембраны. Как подытоживает Архипов: «Я был очень рад видеть это, потому что изобрести метод легко, но сделать его полезным сложнее.»
Шультен продолжает свою работу с BAR-доменами и по сей день. В настоящее время его аспирант Ханг Юй работает над F-BAR. Вдохновленные полученным в 2008 году криоэлектронным микроскопическим изображением решетки F-BAR-доменов на трубке, Юй и Шультен приступили к ответу на ряд вопросов, к примеру: как работает F-BAR-домен в клетке, лепит ли он мембрану подобно N-BAR-белкам? Почему клетка использует такую специфическую концентрацию F-BAR-доменов?
Юй решил посмотреть, как F-BAR-домен изгибает кусок мембраны. Когда он запустил свою симуляцию, ничего не произошло, мембрана просто осталась плоской. Он провел несколько симуляций и так ничего и не увидел. Но он использовал те же времена, что и его предшественники, Инь и Архипов. Юй, наконец, решил позволить моделированию работать очень долго, и, о чудо, он наконец увидел, как F-BAR-домен изгибает мембрану. Юй обнаружил, что F-BAR-домены менее жестки, чем N-BAR-домены, но в то же время производят меньшую кривизну.
Затем Юй попытался найти, какая оптимальная плотность белков F-BAR-домена дает наибольшую кривизну. На кусочек мембраны размером 1000 квадратных нанометров он положил 5, 8, 10, либо 16 димеров. Он увидел, что расположение 10 димеров создает наилучшую кривизну на плоской мембране. Теперь Юй был вооружен особой решеткой, которая производит наибольшую кривизну. Он был готов посмотреть, будут ли F-BAR-домены производить трубочку из плоского куска мембраны. Юй сообщает, что он и Шультен были в восторге, когда увидели, что трубка полностью сформирована.

Во всех работах по BAR-доменам Шультен утверждает, что то, что на самом деле создает кривизну мембраны, называется механизмом строительных лесов. В этом механизме есть положительно заряженные остатки на нижней стороне банановидного BAR-домена, которые притягивают отрицательные липидные головки. Это притяжение смещает липиды к BAR области и таким образом искривляет мембрану. Но многие все еще не определилось с механизмом лепки, поскольку некоторые исследователи предпочитают другой метод, называемый механизмом вставки. В этом механизме остатки BAR-домена фактически вставляются в мембрану и зажимают ее, заставляя изгибаться. Шультен признает, что иногда в клетке некоторые белки могут использовать механизм вставки для изгиба мембран. «Потому что если заглянуть в клетку, – поясняет Шультен, – то можно увидеть очень много разных форм. Я имею в виду так много, что вы никогда бы не подумали, что все они появляются в с применением только одного трюка.»
Понимание нервной системы
Когда примерно в 2005 году Клаус Шультен услышал, что была получена структура калиевого канала, он был заинтригован, поскольку это косвенно было связано с его многолетними исследованиями мозга. В то время как калиевые каналы были модной темой, Шультен был мотивирован своим давним увлечением исследованиями мозга. А калиевые каналы играют ключевую роль в функционировании нервной системы.
Нервная система у животных – это основной способ реагирования на внешний мир. Нервные клетки реагируют на раздражители и затем передают эту информацию от нейрона к нейрону, вниз по длинным аксонам. Электричество, или поток зарядов, является ключом к этой передаче, но в отличие от электроники, электричество мозга переносится не движением электронов по проводам, а градиентом ионов калия и натрия.
Но как срабатывает нервная клетка? По сути, внутри нее постоянно поддерживается небольшое отрицательное напряжение (она действует как своего рода батарея). В клетках человека внутри содержится избыток ионов калия, а жидкость, омывающая мембрану снаружи, содержит избыток ионов натрия. Когда раздражитель (звук, прикосновение, свет и т. д.) достигает клеток в органе чувств, он преобразуется в электрический сигнал, который достигает, за один шаг или после нескольких шагов, нейронов, направляющихся к мозгу. В этих нейронах натриевые каналы в мембране клетки открываются, и ионы натрия втекают внутрь. В конце концов, когда напряжение достигает определенного значения, это приводит к тому, что открывается множество других натриевых каналов, и в конечном итоге внутри клетки достигается пороговое (положительное) напряжение. Примерно через миллисекунду, возникает потенциал действия – положительное напряжение. Натриевые каналы теперь закрываются. Затем открываются калиевые каналы, и ионы калия покидают клетку, возвращая клетку к более отрицательному напряжению. Следовательно, клетка перешагивает свой порог активации и восстанавливается до своего небольшого отрицательного потенциала покоя, накачивая калий и натрий соответственно. Таким образом, этот перенос ионов происходит через мембрану и передается вниз по мембране аксона нервной клетки для передачи сигнала. И все это электрохимическое поведение основано на натриевых и калиевых каналах. Имея под рукой оцифровку калиевого канала, Клаус Шультен понял, что может исследовать ключевой элемент нейрона с точки зрения физики.
Примерно в то же время, у него также появился новый ученик, Фатима Халили-Арагхи, которая взялась изучать эту тему. Первоначально заинтересовавшись физикой высоких энергий, при поступлении в аспирантуру она вскоре поняла, что физика в группе Шультена была такой же увлекательной, как и в теории струн. Она немедленно начала исследовать калиевые каналы. Ученые знали, что это канал, и он открывается и закрывается (эффект стробирования) в зависимости от изменения напряжения. «Когда я начала изучать литературу, я поняла, что мы не знаем, как они чувствуют напряжение. Мы не знали, что происходит внутри», – вспоминает Халили-Арагхи. Ее задача состояла в том, чтобы узнать больше и прояснить механизм.

Она и Шультен впервые попытались понять проникновение ионов калия через поры. В белке есть пять аминокислот, которые образуют самый узкий сегмент канала и которые не пропускают ничего, кроме калия, поэтому он известен как селективный фильтр. Многое было постулировано о том, как ионы проходят через селективный фильтр, и одна идея заключалась в том, что калий не течет непрерывно. Когда Халили-Арагхи начала имитировать калий идущий потоком, канал не проводил. Это было странно, потому что кристаллическая структура полученная экспериментаторами, предположительно, находилась в открытом состоянии. Было перепробовано множество попыток, прежде чем пришло понимание, что происходит «инактивация» фильтра – это было нечто, что происходило спонтанно и препятствовало проводимости. В конце концов Халили-Арагхи поняла, что некоторые карбонатные группы в фильтре ответственны за непроводимость, и после многих попыток она ограничила их, после чего канал начал пропускать ионы. И, наконец, она и Шультен подтвердили, что проникновение ионов калия происходит по цепочному механизму похожему на перебор четок; в канале есть два иона калия, а затем входит третий, он остается там, но выталкивает нижний калий вниз через остальную часть канала. Хотя это подтверждение было опубликовано в Biophysical Letters, Халили-Арагхи говорит, что трудности моделирования проводимости были даже не самой сложной частью проекта.
Как-то она была на собрании Биофизического общества и завела разговор с ученым из лаборатории Бенуа Ру в Чикаго. Ру – биофизик, который также изучал калиевые каналы. Халили-Арагхи узнал, что соавтор Ру, Владимир Яров, построил модель замкнутой структуры калиевого канала, закрытого напряжением. Это вскоре стало ценным для Халили-Арагхи, и вскоре они с Шультеном начали сотрудничать с лабораторией Ру. В то время как мембранные белки традиционно трудно кристаллизовать, еще труднее кристаллизовать ионный канал в состоянии, которое существует только при приложении определенного напряжения, чтобы держать его закрытым – ибо это состояние должно происходить внутри мембраны. Но модель замкнутого состояния от Ярова не была похожа на первозданную кристаллографическую структуру. Халили-Арагхи пришлось потратить много времени на усовершенствование структуры, пока она не достигла стабильного закрытого состояния.
На этом работа не закончилась. «У нас было закрытое и открытое состояния, и мы должны были как-то проверить их, что закрытое состояние – это действительно закрытое состояние», – резюмирует она. Затем последовали серьезные вычисления – расчет стробирующих зарядов. Когда канал переходит из открытого состояния в закрытое, некоторые заряженные остатки перемещаются, и эти движения могут быть количественно оценены в экспериментах. Хотя Халили-Арагхи могла точно воспроизвести эти экспериментальные измерения, сказать, что моделирование требовало огромного компьютерного времени, было бы преуменьшением. «В тот момент я думаю, что количество компьютерного времени, которое мы использовали для этого проекта, было, вероятно, сопоставимо суммарному затраченному времени на все другие проекты», – говорит Халили-Арагхи. Но усилия того стоили, потому что они получили очень близкое совпадение с экспериментальными стробирующими зарядами. Халили-Арагхи провела еще много вычислений, чтобы проверить и улучшить закрытое состояние. В конце концов они обнаружили структуру, которая имела область сужения с отрицательно заряженными остатками. «Таким образом, все становилось на свои места, снова указывая на то, что наше закрытое состояние, вероятно, чем-то похоже на реальное закрытое состояние, обнаруженное в клеточной мембране нейрона», – утверждает она. «Это, вероятно, самое близкое, что мы можем получить, я имею в виду, пока мы не увидим это с помощью кристаллографии или любого другого метода.»
Итак, что же в конце концов обнаружило длительное моделирование нейронного калиевого канала? Фактически был получен ответ на важнейший вопрос, касающийся фундаментального свойства нейронной передачи сигналов. Она происходит через зависимость от напряжения проводимости ионов натрия и калия через мембрану нервной клетки в атональной области нервных клеток. В случае как натриевых, так и калиевых каналов проводимость реализуется центральной порой, которая с высокой специфичностью различает ионы натрия или калия. Эта пора окружена четырьмя так называемыми вентилями напряжения, которые контролируют проводимость центральной поры с целью измерения напряжения на нейронной мембране. По мере того как ионы проводятся, напряжение действительно изменяется, и соответственно изменяется проводимость. В результате ионная проводимость нелинейна по отношению к напряжению, и нелинейность формирует нервные сигналы.

Этот математически интересный способ управления нервными сигналами был открыт в 1950-х годах Ходжкином и Хаксли задолго до того, как стали известны какие-либо молекулярные подробности об ионных каналах в нейронной мембране. Ходжкин и Хаксли были удостоены в 1963 году Нобелевской премии по физиологии и медицине. Самое удивительное, что математическая форма уравнений Ходжкина-Хаксли напоминает недавно обнаруженную структуру ионных каналов, ясно указывая, что ионные каналы должны иметь четыре вентиля напряжения. До тех пор, пока Шультен не увлекся калиевыми каналами, оставалось загадкой, каким образом вентили напряжения улавливают слабые изменения напряжения, происходящие на нейронной мембране. Моделирование Халили-Арагхи и Шультена показало в случае калиевого канала, что изменение напряжения локализуется на удивительно коротком расстоянии в затворе, так что, хотя это изменение невелико, возникающая сила (которая зависит от времени изменения напряжения заряда иона и расстояния) достаточно высока, чтобы произвести сильный эффект. Физика включает в себя перераспределение высоко поляризуемых молекул воды и изменение обычной альфа-спирали белка в так называемую спираль 3-10. Эволюция открыла здесь электронное наноустройство, подобное транзистору, которое делает возможными нейронные сигналы и, следовательно, нейронные вычисления. В настоящее время группа Шультена расширяет исследования Халили-Арагхи на натриевый канал, который является более сложным по своему устройству. Шультен уверен, что вскоре он завершит мост между структурой и динамикой нейронных ионных каналов, с одной стороны, и математической феноменологией Ходжкина и Хаксли, с другой.
Грандиозный финал: серия взаимосвязанных процессов
Мы сотканы из ткани наших снов…–– Шекспир, Буря
Две мечты Клауса Шультена определили его цели на протяжении последних сорока пяти лет научной жизни. В детстве он был очарован АТФ, и он никогда не забывал это раннее очарование универсальной валютой живой клетки. В том же духе он хотел изучить ключевой мембранный белок, реакционный центр, чтобы объяснить фотосинтез, и его возмутительный план построить свой собственный суперкомпьютер в 1980-х годах направил его на путь становления вычислительным биологом. Итак, спустя четыре десятилетия удовлетворен ли Шультен своим личным пониманием АТФ или фотосинтеза? Он подобрался очень близко. И чтобы представить кульминацию жизненного призвания, он счел необходимым осветить ряд процессов фотосинтеза, которые начинаются с поглощения солнечного света и заканчиваются выработкой АТФ. «И дело в том, что то, что я хотел сделать с помощью науки, я мог сделать только через фильм», – резюмирует Шультен. Но это не голливудская постановка. Каждый отдельный атом правильно учтен, и все процессы были тщательно демистифицированы на протяжении многих лет многими, многими учеными, включая различных исследователей из группы Шультена. Никаких спецэффектов, только чистая наука. Этот ролик, предоставленный ниже, также затрагивает другую мечту Шультена, его желание описать, как несколько белков работают вместе в клетке, образуя сообщества биологической организации, что является сутью создания живой клетки. И этот фильм основан на мембранной системе, хроматофоре фиолетовых бактерий.
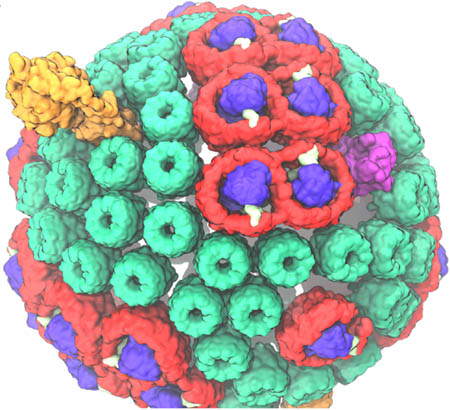
Хроматофор – это автономная единица в фиолетовой бактерии, которая действует как биологическая машина, производя АТФ под действием солнечного света. На самом деле ее называют псевдо-органеллой, поскольку она встречается у прокариот. В принципе, он выполняет автономную функцию сам по себе, и хотя он действует только в контексте клетки, он имеет такие размеры, что теперь можно моделировать эту «органеллу» во всей ее полноте, и тем самым это приближает Шультена к цели изучения целой клетки. Хотя существует много различных форм хроматофоров, один из них, показанный в видео, имеет сферическую форму, около 60 нанометров в диаметре и содержит более 100 белков, встроенных в сферическую мембрану. Внутри хроматофора происходит ряд процессов между взаимодействующими белками. «Они работают, как швейцарские часы, где маленькие колесики и шестеренки приводят друг друга в движение», – поясняет Шультен. «И именно этот часовой механизм процессов действительно заставляет систему делать то, что она делает.» В то время как ученые в течение десятилетия рассматривали отдельные процессы, выполняемые отдельными белками, целью фильма Шультена было показать последовательность процессов, которые приводят к созданию АТФ из солнечного света, и проиллюстрировать взаимосвязь всех процессов.
Но как Шультен прошел путь от увлечения реакционным центром (одним из пяти типов белков, встроенных в хроматофор) до понимания всех типов белков, составляющих хроматофор? Как только структура реакционного центра была получена в 1985 году Гартмутом Мишелем, Шультен немедленно приступил к вычислениям этого мембранного белка, лежащего в основе фотосинтеза. И тогда он взялся за рискованный проект. Однажды вечером в Урбане в 1995 году на вечеринке Шультен и Мишель начали обсуждать смелый план по определению структуры светосборочного белка. В то время как реакционный центр имеет решающее значение для фотосинтеза, существует ряд белков, собирающих свет (показаны красным и зеленым на изображении), которые фактически направляют энергию в реакционный центр, где она затем преобразуется в перенос электронов. Белки собирающие свет, в основном действуют как вспомогательные антенны, чтобы поглощать больше доступного света для использования хроматофором. Пакт Шультена с Гартмутом Мишелем был на самом деле сумасшедшим, потому что Шультен не был экспертом в структурной биологии, а кристаллографические данные Гартмута упускали ключевую часть информации (фазовые углы). Но Шультен вместе с бесстрашным постдоком Сиче Ху фактически использовал вычисления, чтобы в конечном итоге выяснить структуру белка, называемого светосборочным комплексом. Таким образом, Шультен начал расширять свои знания о белковых компонентах хроматофора.
Моделирование LHC II (light harvesting complex) привело к тому, что Шультен называет своим самым большим успехом в области исследований мембранных белков, над которыми он работал с начала 1990-х годов. В тот момент Шультен снял фуражку структурного биолога и надел шляпу квантового физика. С выдающимся дуэтом аспирантов, Торстеном Ритцем и Анной Дамьянович, а также Сиче Ху, команда разгадала, как каротиноиды и хлорофиллы, составляющие светосборный комплекс II, функционируют как единое целое и используют квантовую физику для достижения эффективного поглощения фотонов и передачи энергии в реакционный центр. С одной стороны, Шультен был биофизиком, который занимался моделированием белков. «С другой стороны, я был физиком-теоретиком, который хорошо знал квантовую физику, и поэтому в тот момент, внезапно эта моя вторая половина мозга проснулась. И это было, я думаю, самое замечательное, что случилось со мной.»
Таким образом, первоначально Шультен был очарован реакционным центром, а затем в середине 1990-х годов он начал работать над двумя типами вспомогательных белков, которые направляют энергию в реакционный центр. Кроме того, примерно в 2005 году Шультен начал амбициозный проект с постдоком Мелихом Сенером, чтобы собрать воедино все экспериментальные данные за последние десятилетия и фактически смоделировать полный хроматофор, вплоть до каждого последнего атома. Эта работа стала возможной в значительной степени благодаря сотруднику Шультена в Шеффилде, Нилу Хантеру. Было бы невозможно проиллюстрировать все взаимосвязанные процессы в хроматофоре до тех пор, пока не будет реализована его полная структура.
В хроматофоре есть пять ключевых белков-игроков. Первые два (светосборочные комплексы I и II) действуют как антенны, а третий белок, реакционный центр, преобразует собранную энергию в перенос электронов. Таким образом, остаются два типа белков, необходимых для окончательного превращения солнечного света в АТФ. Эти два комплекса называются bc1-комплексом и АТФ-синтазой. После того, как свет попадает на антенны хроматофора, он поступает в реакционный центр, который использует эту энергию, чтобы протолкнуть электрон вниз по цепи. Затем специальная молекула (хинон) активируется двумя электронами и двумя протонами (становится хинолом) и проплывает через маслянистую мембрану к bc1-комплексу. Затем bc1 перекачивает протоны хинола с внешней стороны сферического хроматофора внутрь. И тогда хорошо известная АТФ-синтаза использует протонный градиент, чтобы стимулировать производство АТФ. (Для полноты картины, здесь задействован шестой белок – цитохром, который переносит электроны от bc1 обратно к реакционному центру.)
Группа Шультена должна была использовать инструменты квантовой химии для описания сложных реакций переноса электронов и протонов, которые происходят в bc1-комплексе, усилия, возглавляемые совсем недавно аспиранткой Анджелой Барраган. Она провела очень тщательные крупномасштабные квантово-химические расчеты, чтобы точно определить, что на самом деле происходит в процессе создания протонного градиента.
Как и следовало ожидать, работа группы Шультена над АТФ-синтазой дорога его сердцу. Ему потребовалось много лет, чтобы достичь подходящего понимания этого мембранного белка. Поначалу все шло медленно, поскольку первоначальные структуры не были достаточно полными, чтобы Шультен мог полностью погрузиться в объяснение его внутренней работы. «Поэтому тогда я был очень осторожен и опубликовал только то немногое, что понял», – рассказывает Шультен о своей многолетней работе над АТФ-синтазой. «И сегодня я, наконец, думаю, что у меня все получилось.» Причина, по которой Шультен считает, что он, наконец, может объяснить АТФ-синтазу и ее функцию, затрагивает тему его фильма о хроматофоре в целом: совместная работа всех взаимосвязанных частей. АТФ-синтаза содержит шесть белков. Только сегодня, благодаря работе, недавно выполненной фантастическим постдоком Абхи Сингхарой, Шультен может описать сложность системы, а именно, как шесть белков работают вместе, чтобы преобразовать протонный градиент в крутящий момент, а затем в настоящую АТФ. Хотя он все еще проверяет некоторые шаги, используемые АТФ-синтазой, он находится в пределах досягаемости своих детских мечт об АТФ.
Фильм «Хроматофор», таким образом, заключает в себе множество тем, которые извивались в мозгу Шультена в течение последних пятидесяти лет. Он с детства хотел исследовать молекулы жизни, особенно важнейшую АТФ. Поэтому он принял решение изучать молекулярную физику в аспирантуре Гарварда – дисциплину, которую все его друзья считали скучной и недостойной внимания. Во время своей первой работы он был знаком с областью фотосинтеза, но мог проводить только ограниченные исследования на эту тему, поскольку не было намеков, что важнейшие мембранные белки, лежащие в основе фотосинтеза, будут когда-либо оцифрованны. В Мюнхене в 1980-х годах Шультен имел место в первом ряду для получения структуры первого мембранного белка, реакционного центра. Но реакционный центр имел и другой глубокий эффект, поскольку он подтолкнул Шультена к использованию компьютера в качестве инструмента, который, если его отточить, может стать бесценным для биологии. И, наконец, он всегда настаивал на моделировании все больших и больших структур с явной целью описания биологической организации, что переводится в рассмотрение того, как взаимодействуют кластеры из сотен или даже тысяч белков. И у него были программные средства, которые он разработал для вычислительной биологии, VMD и NAMD, и с помощью этих самых инструментов он был способен сделать фильм про хроматофор, который требовал моделирования и анализа огромного числа атомов (около 100 миллионов). Имея все это в виду, Шультен утверждает, что: «Идея о фильме напрашивалась сама собой.»
Фильм «Хроматофор» является подходящим завершением этой истории о мембранных белках. С богатым набором мембранных белков, которые Шультен и его группа уже демистифицировали, удивительно, что Шультену пришлось ждать почти тридцать лет, пока он смог смоделировать белок и мембрану вместе. Правда, его путь не всегда был легким, но Шультен смотрел вперед и не зацикливался на невзгодах. Его успехи в этой области идут рука об руку с достижениями в области вычислительных инструментов, которые разрабатывает его группа. На самом деле, с помощью компьютера Шультен неплохо зарабатывал себе на жизнь, хотя получение структур мембранных белков с помощью кристаллографии все еще происходит довольно медленно. Хотя роль вычислительного биолога иногда недооценивается, Шультен любит свое жизненное призвание. «Итак, теперь я разбираюсь в живых системах с помощью своего математического ума, и я очень, очень доволен этим».
Статья была написана в 2014 г. Через год хроматофор (100 миллионов атомов) промоделировали на суперкомпьютере «Титан». В октябре 2016-го Клаусс Шультен умер в возрасте 69 лет, но его дело продолжается его учениками из Theoretical and Computational Biophysics Group.
Материалы для дальнейшего погружения: подборки видео (раз, два, три, четыре) и более академичный обзор моделирования клеточных мембран (с сопутствующими семью сотнями ссылок), а также обзоры подходов к цельноклеточному моделированию (раз, два, три +статья 70-го года (для сравнения) с вставками на фортране).


