Логика включения оперонов разных путей обмена веществ у кишечной палочки близка к элементам AND и OR. Поэтому на их основе можно сделать генную конструкцию, реализующую произвольную логическую схему (не слишком сложную). Существуют программы, например Cello, которые из описания логики на языке Verilog делают последовательность генной конструкции, реализующей эту логику.
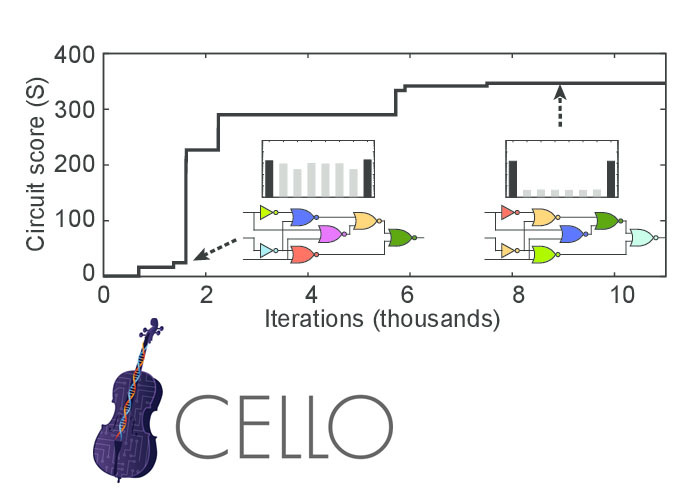
Cложнее оказывается обратная задача: из последовательности природной ДНК получить описание логики ее регуляции. Начнем с простых случаев, где нет сложных петель обратных связей и интеграции множества сигналов на одном опероне. Почти вся регуляция генов кишечной палочки удовлетворяет этим условиям. Если взять все известные регуляторные связи между генами кишечной палочки и построить сеть из них, то можно подсчитать статистику «мотивов» этой сети (способов соединения элементов) и выделить самые часто используемые.
Динамика переключения генов
В прошлой статье мы моделировали работу лактозного оперона простой моделью с четырьмя параметрами. Время в эту модель не входило. Поэтому она, вообще-то, описывает только равновесные состояния, когда уровни входных сигналов долго остаются постоянными. Для моделирования быстрых процессов при включении и выключении генов надо учитывать дополнительные факторы.
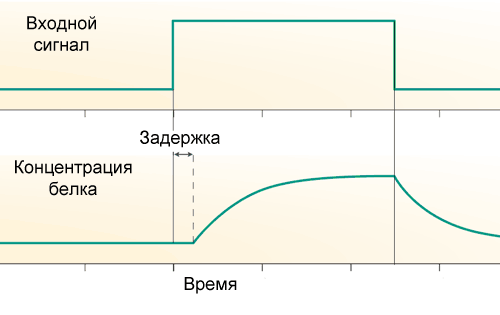
Во-первых, существует транскрипционная задержка: от начала работы РНК-полимеразы до окончания синтеза мРНК, а затем белков, проходит заметное время, порядка 10 минут у кишечной палочки и от часа и более у человека. Поэтому скорость появления новых молекул белка зависит не от состояния промотора его гена прямо сейчас, а от состояния промотора сколько-то минут назад.
Во-вторых, каждый белок не только синтезируется, но и распадается. В простейшем случае распад белка не управляется и каждую минуту в клетке распадается фиксированная доля молекул данного белка. Чем больше их есть, тем больше их и распадается. То есть у белка есть период полураспада, за который его концентрация падает в два раза.
Для описания динамики включения и выключения гена нам нужно писать диффур:
где А — активность гена (та самая входная функция из прошлой статьи), tau – время транскрипционной задержки, а k – скорость распада белка. Если A сначала равна нулю, а потом повышается скачком и держится на постоянном уровне, то изменения количества белка со временем будут выглядеть так:
Мотивы в генных сетях и их функции
Самый простой мотив из характерных для кишечной палочки — петля обратной связи — состоит из одного гена, который регулирует сам себя. Чаще ген является для себя репрессором, то есть обратная связь в петле отрицательная. Если это основной регуляторный вход, то такая обратная связь обычно служит для стабилизации уровня белка, кодируемого геном. Такая петля обратной связи, например, поддерживает постоянный уровень лактозного репрессора в клетке. Если, кроме отрицательной обратной связи, есть и другие регуляторные входы, то обратная связь ускоряет реакцию гена на внешний сигнал.
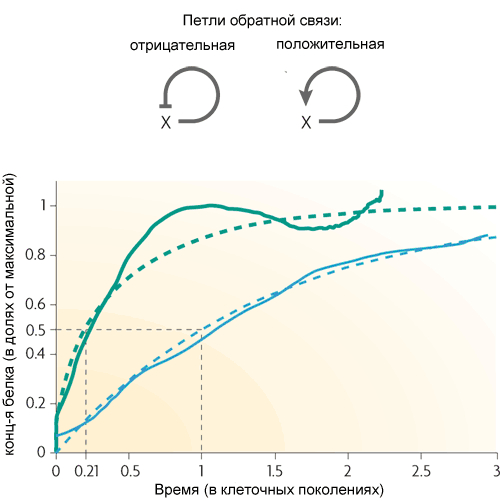
(пунктирные линии — теоретические кривые, сплошные — результат эксперимента. Зеленые — с отрицательной обратной связью, синие — без нее)
Положительная обратная связь (белок активирует свой собственный ген) приводит обычно к триггерному поведению. У такого гена есть два устойчивых состояния: он либо не работает совсем, либо работает на полную мощность. Сильный, но короткий внешний сигнал может перевести ген из одного устойчивого состояния в другое, в котором он останется до следующего сигнала. Такой мотив может служить элементом памяти. Если ген «ловит» на регуляторный вход шум, то положительная обратная связь приведет к сильному разбросу по активности гена между соседними клетками, растущими в одинаковых условиях. Это используется для поддержания разнородности бактерий, растущих вместе, чтобы внезапный стресс не убил сразу всех.
Например, многие антибиотики нарушают процесс синтеза белка. Если клетка не растет и не синтезирует белки, то она легко может пережить добавление в среду антибиотиков и вернуться к росту позже. У кишечной палочки даже в идеальных условиях до 0,01% клеток находятся в такой спячке на случай внезапного отравления среды. Эти спящие клетки (они называются «персисторы») не отличаются от остальных по ДНК, они входят и выходят из спячки под управлением гена с положительной обратной связью и входом для шума.
Другой обычный мотив генных сетей немного сложнее. Он называется «feed-forward loop» (петля прямой связи) и состоит из трех генов: ген X регулирует гены Y и Z, ген Y регулирует Z. Каждая из трех связей в петле может быть активацией или репрессией, поэтому в принципе возможны 8 типов таких петель. Реально встречаются обычно два типа из восьми: либо оба гена X и Y — активаторы (когерентная петля 1 типа), либо X — активатор Y и Z, Y — репрессор Z (некогерентная петля 1 типа).
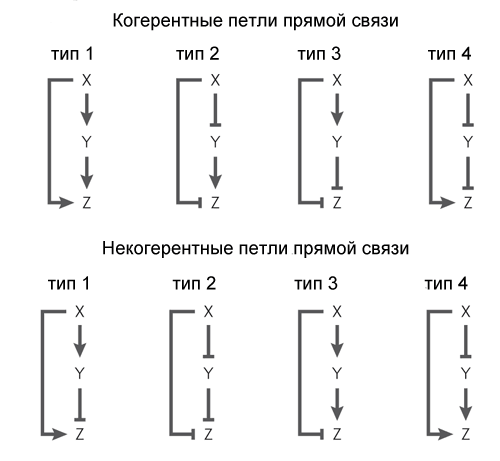
Поведение петли с двумя активаторами зависит от логики взаимодействия входов на Z. Если в петле выходной ген работает как AND, то петля работает как фильтр нижних частот, не пропускающий на выход короткие импульсы. Чтобы в такой петле появился сигнал на выходе, вход (X) должен получать сигнал достаточно долго, чтобы накопился белок X, а затем белок Y. Только совместное действие белков X и Y включит ген Z.
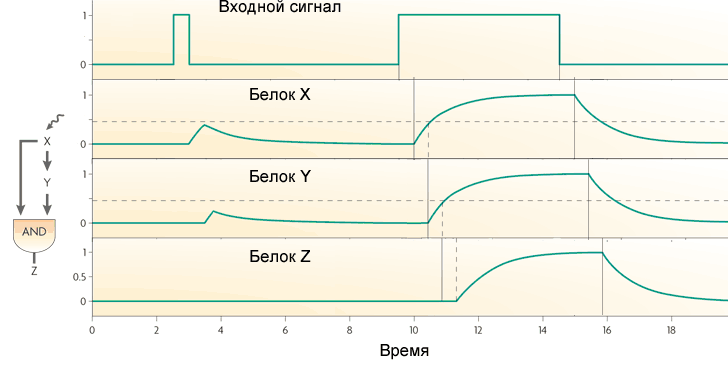
Если ген Z работает как OR, то функция петли становится противоположной: она пропускает на выход все импульсы, а короткие превращает в длинные. Зато она не пропускает короткие паузы между импульсами.
Петля прямой связи с активатором X и репрессором Y работает как фильтр верхних частот. Она выдает на выходе импульсы небольшой фиксированной длины (равной транскрипционной задержке гена Y) в ответ на передние фронты входных сигналов.
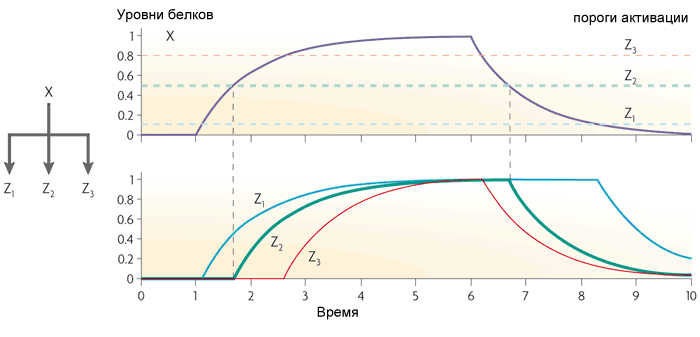
Третий частый мотив в генных сетях кишечной палочки — это одновходовой модуль (single-input module). Это просто группа генов, управляемых одним и тем же регуляторным геном. Обычно гены в такой группе имеют разные пороги активации, поэтому плавный рост концентрации транскрипционного фактора включает гены в определенном порядке. Такая схема используется, например, в управлении ответами на стрессы.
Четвертый, самый сложный мотив — многовходовой модуль (multi-input module, или dense overlapping regulon). Он состоит из нескольких регуляторных генов, управляющих несколькими «выходными» генами.
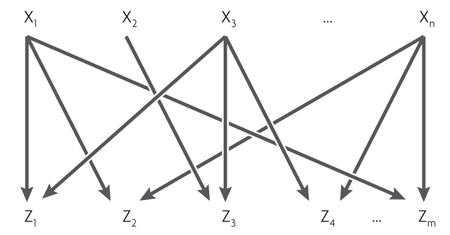
В зависимости от логики регуляции каждого выходного гена этот мотив может работать очень по-разному. Его можно сравнить со сборкой логических элементов, которая в зависимости от соединений может быть дешифратором, счетчиком или еще чем-нибудь. Полных описаний логики работы таких мотивов пока не существует.
Этими четырьмя мотивами практически исчерпывается структура генных сетей кишечной палочки или дрожжей. На их основе уже делают разные искусственные схемы. Например, бактерии с генератором колебаний, который к тому же синхронизируется у соседних клеток, и выходом на люминесцентные белки (http://www.taldanino.com/blinking-bacteria/) — полный аналог «поморгать лампочкой» у микроконтроллерщиков и «Hello World» у остальных программистов. Добавив к этой системе «чувство кворума» (когда бактерии воспринимают, сколько собратьев их окружает), и сменив выход с люминесценции на токсины, ученые собрали бактерии, которые ползут внутрь раковых опухолей, и накопившись в большом количестве, дружно погибают, высвобождая токсины и убивая опухоль (http://www.nature.com/nature/journal/v536/n7614/full/nature18930.html).
Но это бактерии и дрожжи. Генные сети животных устроены намного сложнее. В следующей части разберем одну из хорошо изученных генных сетей животных и те проблемы, которые возникают с их изучением и моделированием.
Источник
