Человеческий мозг является одной из самых сложных и загадочных структур во вселенной. Он содержит около 80 миллиардов нейронов, которые взаимодействуют друг с другом, создавая сложные сети и обрабатывая огромное количество информации. Но какие процессы регулируют работу отдельных нейронов и как происходит поддержание функционирования столь масштабной биологической сети?
Моделирование человеческого мозга является святым граалем современной нейробиологии, предоставляющим инструмент для понимания того, как работает наш мозг и как бороться с его патологиями, такими как инсульт, эпилепсия, болезнь Альцгеймера и другими.
Три подхода
На текущий момент существует 3 подхода к моделированию мозга:
-
наноскопический (клеточный), в рамках которого делается акцент на отдельной нервной клетке;
-
микроскопический (популяционный), при котором моделируются взаимодействия между клеточными популяциями;
-
мезоскопический (региональный), рассматривающий не отдельные нейроны, а целые области мозга.
Микроскопический подход к построению моделей является многообещающим направлением, способным в будущем прояснить физиологические механизмы и сигнальные пути, участвующие в поддержании нейронных связей. Однако на текущий момент применимость этого подхода сильно ограничена высокой вычислительной сложностью соответствующих моделей.
Мезоскопический подход осуществим уже сегодня и способен генерировать различные электрофизиологические сигналы мозга пациента (например, ЭЭГ). Но используемые в подходе модели зачастую основаны лишь на математических рассуждениях и, как следствие, используемые в них параметры лишены биологической интерпретации, что существенно затрудняет обоснование получаемых результатов.
Модели наноскопического подхода позволяют симулировать биофизические процессы, происходящие в отдельном нейроне, и в большинстве случаев обладают выраженным биологическим смыслом. Но они не способны воспроизводить данные макроуровня, такие как сигналы ЭЭГ, из-за чего слабо применимы к реальным пациентам.
The Virtual Brain
Больших успехов в мезоскопическом подходе добился проект под руководством Виктора Джирсы The Virtual Brain, находящийся сейчас на клиническом испытании, где моделирование мозга используется для прогноза результатов при хирургии эпилепсии.
В то же время существует большое количество данных по геному, транскриптому, липидому, говорящих о том, что на возникновение эпилептических припадков также оказывают влияние факторы наноскопического уровня: динамика клеточных рецепторов, генные и метаболические сети, пути передачи сигнала в нейроне и так далее. Однако наноуровень совершенно никак не учитывается в моделях The Virtual Brain.
BioUML
Для описания наноскопического уровня хорошо подходит разрабатываемая нашей командой (ООО «Биософт.Ру», Федеральный Исследовательский Центр Информационных и Вычислительных Технологий и Университет «Сириус») платформа BioUML, которая используется в ряде международных и российских проектов для формального описания и модульного моделирования сложных биологических систем. Про BioUML также можно почитать в недавно опубликованной на Хабре статье: Может ли биолог починить радио? 20 лет спустя.
Основные возможности платформы BioUML:
-
поддержка общепринятого стандарта описания моделей биологических систем SBML (Systems Biology Markup Language) и графической нотации SBGN (Systems Biology Graphical Notation) для их визуального представления;
-
визуальное моделирование биологических систем – пользователь может создавать и редактировать математические модели, используя различные графические элементы, что делает процесс создания моделей доступным даже для людей без математического образования;
-
поддержка различных математических формализмов – переменные, функции, обыкновенные дифференциальные уравнения, алгебраические уравнения, дискретные события;
-
модульная архитектура платформы, позволяющая легко добавлять новые «блоки»-модели к уже реализованным моделям;
-
возможность использования как локальной версии программы, так и веб-интерфейса, не требующего установки.
Идея многоуровневой модели
Как мы поняли, каждый подход к моделированию мозга обладает своими достоинствами и недостатками. В связи с этим естественным образом возникает идея скомбинировать модели различных уровней в единую модульную структуру. Причем у нас есть примеры очень успешных региональных моделей, используемых в The Virtual Brain (наиболее активно используется модель «Эпилептор», в которой каждый отдельный регион мозга описывается всего лишь пятью дифференциальными уравнениями), а также платформа BioUML, отлично подходящая для описания клеточного уровня и конструирования модульных моделей.
В рамках работы над магистерским дипломом в Университете «Сириус» мной было решено воспроизвести в BioUML существующие простые, но функциональные модели эпилепсии, позволяющие качественно воспроизводить ряд наблюдаемых во время припадков феноменов, а затем соединить региональный и клеточный уровни друг с другом, минуя популяционный. Для этого необходимо было разработать способ передачи рассчитанных характеристик отдельных нервных клеток на уровень нейронных полей. Это позволит получить модель нейронных полей, учитывающую взаимодействия внутри отдельных нейронов, но избавленная от сложностей описания взаимодействий клеточных популяций.
Предварительные сведения
Для комфортного восприятия построенной многоуровневой модели желательно обладать базовыми знаниями в области биофизики и нейробиологии, поэтому далее мы галопом по Европам кратко рассмотрим процессы, составляющие основу передачи сигналов между нейронами, узнаем, какую роль в этом играют рецепторы и нейромедиаторы, а также познакомимся с концепцией моделирования мозговой сети на основе коннектомов.
Нервная клетка
Клетки мозга включают нейроны, являющиеся основными элементами для генерации и передачи сигналов, и клетки нейроглии, выполняющие вспомогательные функции по поддержанию специфического окружения для нейронов.
Нейрон или нервная клетка – это возбудимая клетка, являющаяся структурно-функциональной единицей нервной системы, которая предназначена для приема, обработки и передачи информации с помощью электрических и химических сигналов.
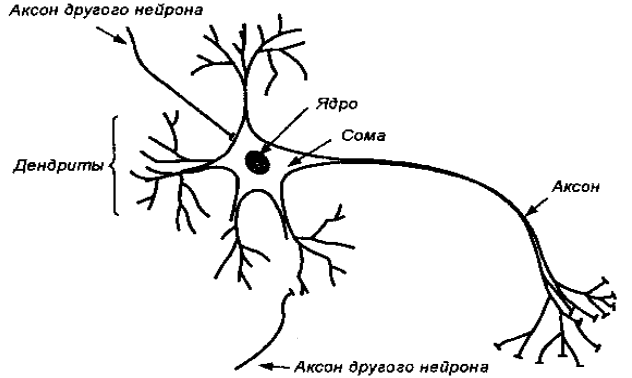
Типичный нейрон состоит из: тела клетки, ядра и отростков. Отростки подразделяются на два типа: дендриты и аксоны. Дендрит – короткий разветвленный отросток, через который тело нейрона с помощью электрического сигнала получает информацию от аксонов других нейронов. Аксон – длинный отросток, по которому информация передается от тела нейрона к другим нервным клеткам. Как правило, нейрон имеет множество дендритов и лишь один аксон.
Потенциал покоя и потенциал действия
Мембрана всех живых клеток поляризована: ее внутренняя сторона имеет отрицательный заряд по сравнению с межклеточным пространством. Поддержание разности потенциалов осуществляется каналами, проницаемыми для ионов калия (K+), натрия (Na+), кальция (Ca2+) и хлора (Cl-), которые управляют избирательной проницаемостью мембраны. Этот факт обуславливает способность клеток реагировать на раздражители, что составляет основу механизма передачи сигнала. Разность электрических потенциалов между внутренней и наружней сторонами мембраны называется мембранным потенциалом.
Потенциал покоя – значение мембранного потенциала клетки, находящейся в состоянии физиологического покоя. Его средняя величина в нервных клетках составляет примерно минус 70 милливольт.
Если нанести на возбудимую клетку раздражение выше некоторого порогового значения, то произойдет кратковременная (миллисекунда) перезарядка мембраны: ее внутренняя часть станет заряжена положительно относительно наружней, в результате чего потенциал мембраны резко возрастет, а затем вернется до потенциала покоя. Такое резкое возрастание мембранного потенциала называется потенциалом действия, а также нервным импульсом, разрядом, спайком или пиком.
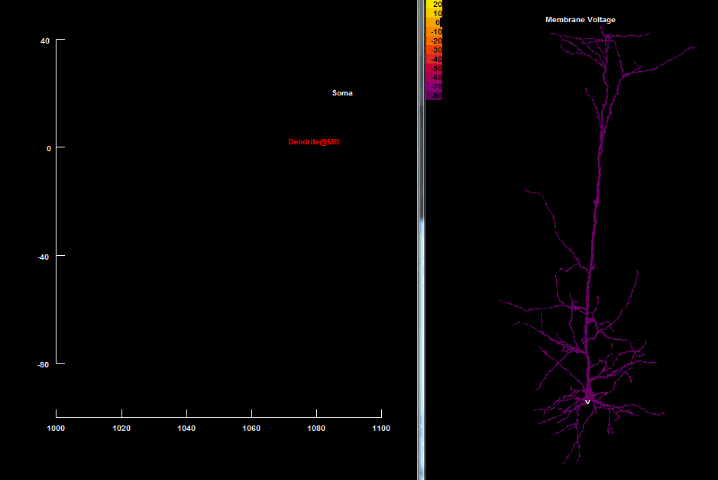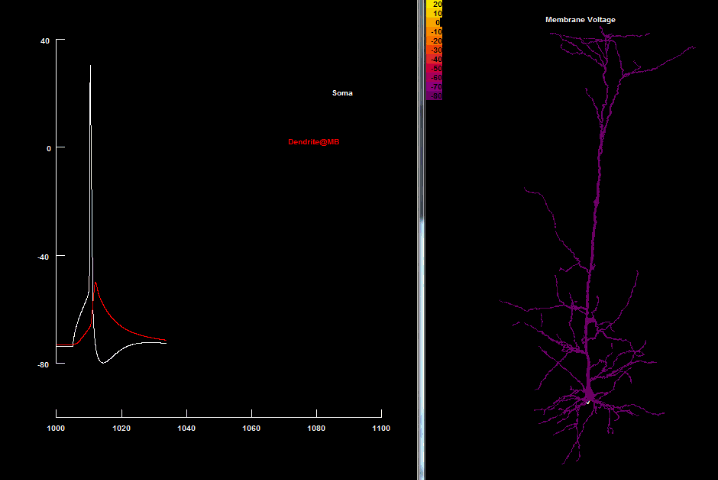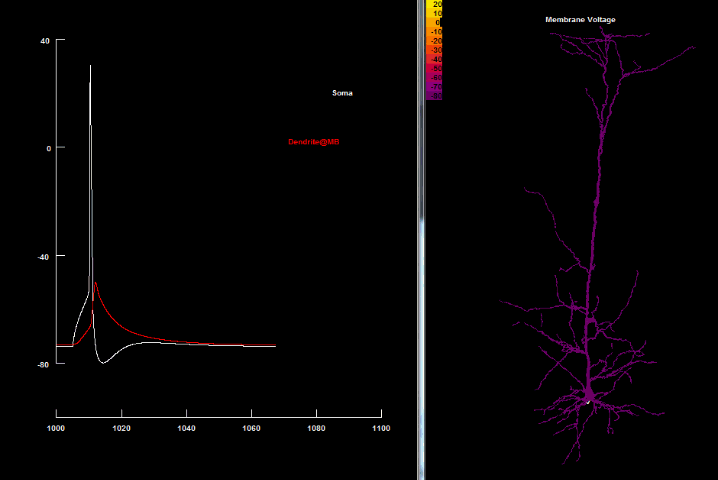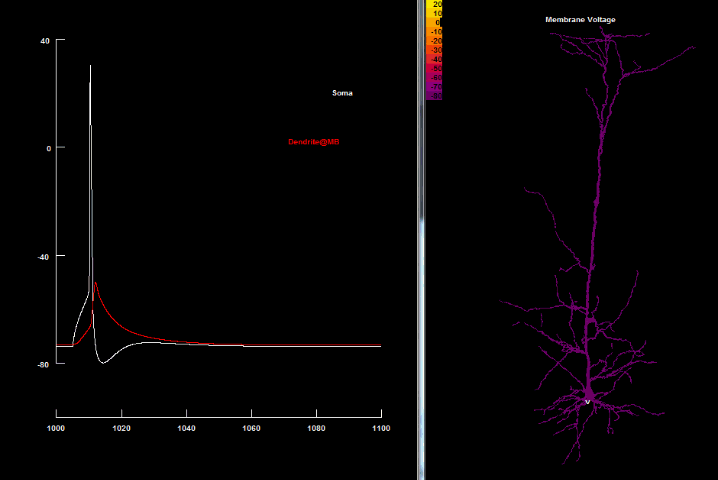
на оси абсцисс – время в миллисекундах.
Увеличение потенциала мембраны относительно уровня покоя называют деполяризацией, а уменьшение – гиперполяризацией.
Концентрации ионов и ионные каналы
Формирование мембранного потенциала происходит за счет избирательной проницаемости клеточной мембраны. Как известно, мембрана представляет собой двойной слой липидов, через который движение заряженных молекул затруднено. Белки, встроенные в мембрану, могут избирательно изменять проницаемость мембраны для различных ионов, в зависимости от приходящих стимулов. При этом ключевую роль в генерации потенциала действия играют ионы калия, натрия и хлора.
Большинство ионов распределяются неравномерно во внутри- и внеклеточном пространствах. Концентрация ионов калия внутри клетки выше, чем снаружи, а ионов натрия, кальция и хлора – наоборот, выше снаружи, чем внутри.
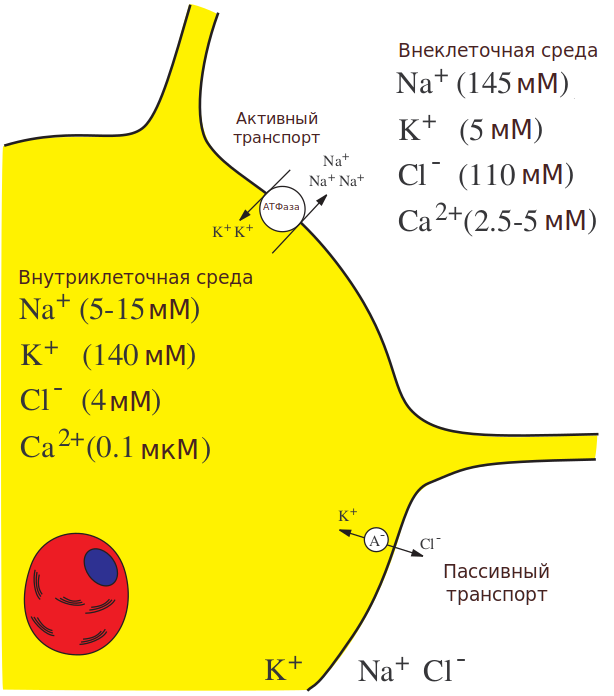
Ионные каналы – мембранные белки, структура которых содержит пору для обеспечения пассивного транспорта ионов по градиенту концентрации (из области с высокой концентрацией в область с более низкой концентрацией). Энергией для такого транспорта служит разность концентрации ионов по обе стороны мембраны. Из-за открытия и закрытия ионных каналов изменяются концентрации ионов по разные стороны мембраны, что приводит к сдвигу мембранного потенциала.
Также важную роль в регуляции концентраций ионов играет активный транспорт: определенные белки (например, натрий-калиевая АТФаза) способны переносить ионы против их градиентов концентрации с затратой энергии молекул АТФ.
Рецепторы и нейромедиаторы
Синапс – место контакта между нервными клетками, обеспечивающее передачу нервного импульса от нейрона другому нейрону. В синапс выплескиваются молекулы нейромедиатора, которые способствуют передаче нервного импульса путем связывания с клеточными рецепторами. Сами клеточные рецепторы это белки на поверхности клетки, которые изменяют свою пространственную конфигурацию в ответ на присоединение специфических молекул (в нашем случае – нейромедиаторов) и передают сигнал внутрь клетки.
Процесс передачи нервного импульса называется синаптической передачей. При этом нейрон, от которого в данный момент передается импульс, называется пресинаптическим, а нейрон, принимающий сигнал – постсинаптическим. Эффективность синаптической передачи не фиксирована и может меняться в зависимости от текущей нейрональной активности.
Типичный синапс состоит из кончика аксона пресинаптического нейрона, дендрита постсинаптического нейрона и синаптической щели – пространства между пресинаптическим и постсинаптическим отростками.
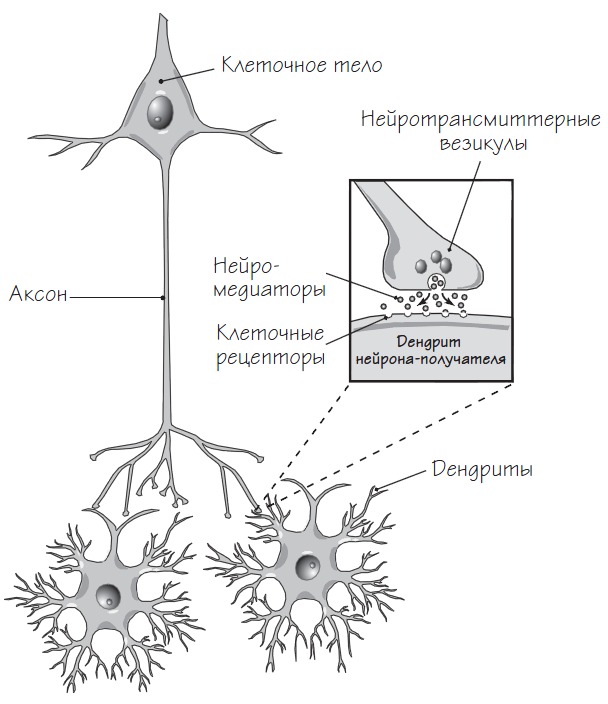
Нервный импульс, поступающий в отростки пресинаптического нейрона, вызывает выброс в синаптическую щель молекул нейромедиатора, находящихся в везикулах на кончике аксона этого нейрона. Молекулы нейромедиаторов, попадая в синаптическую щель, связываются с клеточными рецепторами постсинаптического нейрона, инициируя последовательность биохимических реакций, вызывающих изменение тока ионов через мембрану, в результате чего происходит деполяризация мембраны и возникает потенциал действия.
Основным возбуждающим нейромедиатором в центральной нервной системе является глутамат (глутаминовая кислота), а тормозящим – ГАМК (гамма-аминомасляная кислота).
Наиболее распространенными типами глутаматных рецепторов являются АМПА- и НМДА-рецепторы, которые при связывании с глутаматом открывают канал для ионов Na+, K+ и Ca2+, что приводит к деполяризации мембраны и возбуждению нейрона. Ключевое отличие АМПА- и НМДА-рецепторов заключается в том, что АМПА-рецепторы способны динамически перемещаться между мембраной и цитоплазмой клетки, в то время как НМДА-рецепторы занимают стабильное положение в поверхности мембраны. Кроме того, для активации НМДА-рецепторов, в отличие от АМПА-рецепторов, помимо наличия нейромедиатора, необходимо чтобы мембрана находилась в деполяризованном состоянии.
Основным типом ГАМК-рецепторов являются ГАМК-А-рецепторы, которые при связывании с нейромедиатором ГАМК открывают канал для Cl-, в результате чего мембрана гиперполяризуется, а передача сигнала тормозится.
Эпилепсия
Теперь, когда мы кратко познакомились с основами биофизики мембранных процессов, можно наконец охарактеризовать наш объект моделирования.
Эпилепсия – это неврологическое заболевание, характеризующееся склонностью организма к спонтанному возникновению судорожных приступов. От нее страдает порядка 70 миллионов человек по всему миру.
В мозгу человека, подверженного эпилепсии, возбуждающая система превалирует над тормозящей. Это приводит к тому, что целые группы нейронов начинают синхронно генерировать разряды большой мощности. Эти разряды способны распространяться на другие части нервной системы, что приводит к возникновению приступа. Сам приступ является лишь верхушкой айсберга, способом избавления мозга от избыточного напряжения.
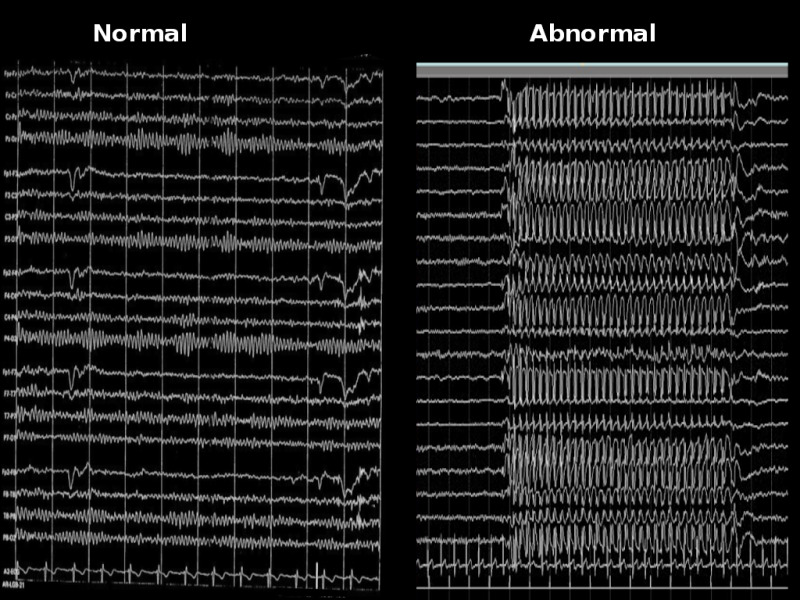
Противоэпилептические препараты могут существенно уменьшить патологическую активность нейронов или полностью ее подавить. Однако несмотря на наличие более 30 противоэпилептических препаратов с разнообразными механизмами действия (блокировка ионных каналов, ингибирование глутаматных рецепторов, активация ГАМК-рецепторов, регуляция везикулярного транспорта и т.д.), примерно треть пациентов с эпилепсией невосприимчива к медикаментозному лечению. Подробнее про мишени существующих противоэпилептических препаратов можно почитать, например, этой работе.
Связность мозга
Мы поняли какие биофизические процессы составляют основу синаптической передачи на уровне отдельных нейронов. Но эпилептический припадок возникает в целых областях мозга и способен распространяться по структуре мозговой сети.
Поэтому моделирование мозга при эпилепсии как правило проводится на основе коннектомов: для конкретного пациента мозг разбивается на определенное число регионов, делаются снимки МРТ и с помощью алгоритма МРТ-трактографии рассчитываются пациент-специфичные матрицы связности и задержек. Полученные матрицы определяют силу передаваемого между областями мозга сигнала и временные задержки его передачи, вызванные ограниченностью скорости распространения нервного импульса.
Кстати, совсем недавно вышла статья, авторам которой удалось получить МРТ-снимки мозга мыши с разрешением в 64 миллиона раз выше стандартных. Коннектомы, полученные на основе настолько четких снимков могут существенно улучшить понимание пространственно-временных паттернов различных нейродегенеративных заболеваний.
На этом заканчивается наше краткое знакомство с основными теоретическими аспектами биофизики и нейробиологии, и теперь каждый читатель подготовлен к дальнейшему описанию многоуровневой модели.
Схема многоуровневой модели
В результате магистерской работы мной была построена многоуровневая математическая модель эпилепсии, которая впервые позволяет проводить исследование динамики возникновения, распространения и затухания эпилептических припадков сразу на нескольких уровнях организации мозга.
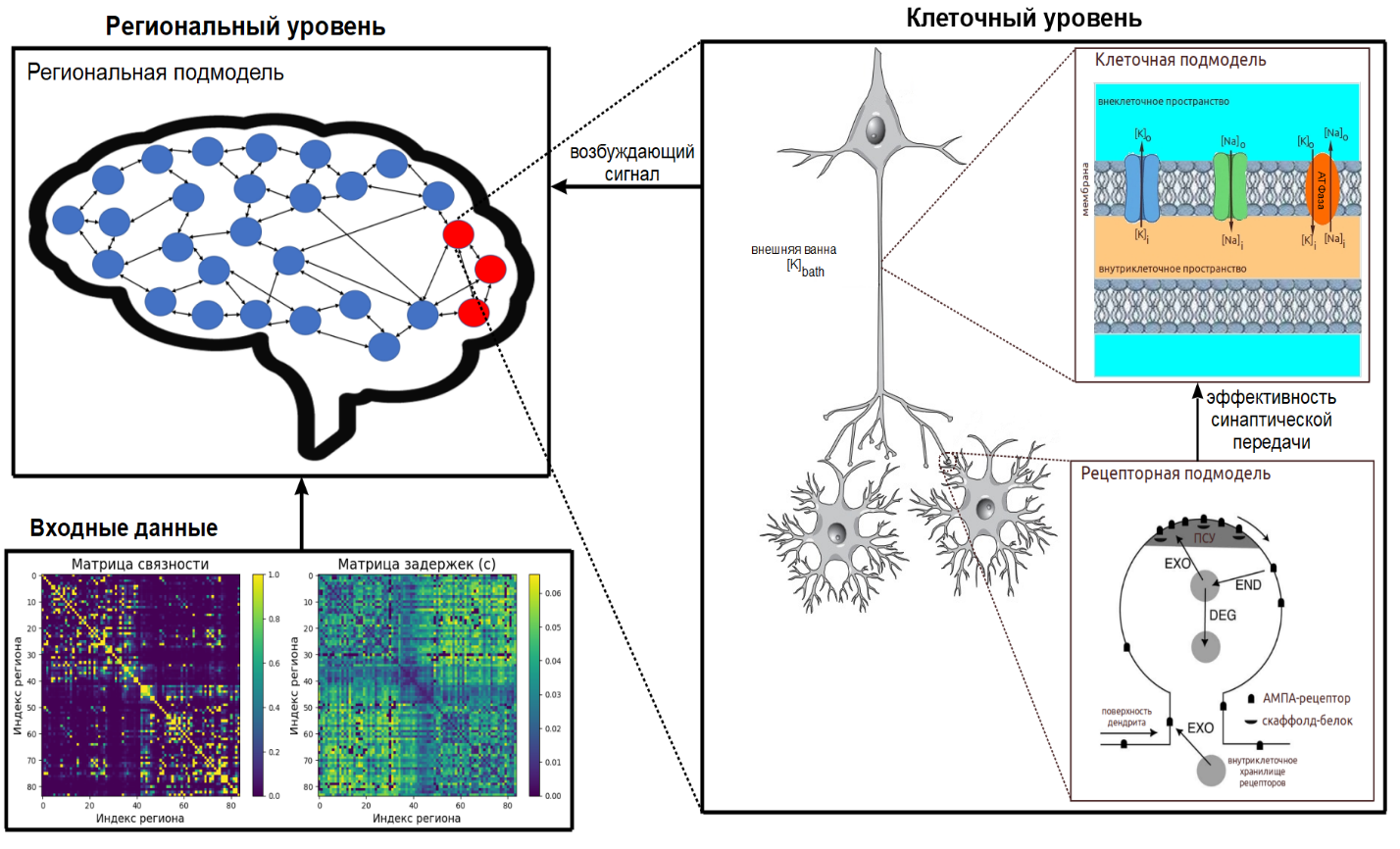
Генерация многоуровневой модели проводилась на основе матриц связности и задержек, о которых мы говорили выше.
Построенная модель содержит одну региональную подмодель, моделирующую взаимодействия между регионами мозга, каждому региону которой соответствует клеточная подмодель, рассчитывающая динамику концентраций ионов, и рецепторная подмодель, определяющая динамику клеточных рецепторов.
При этом рецепторная подмодель определяет эффективность синаптической передачи соответствующей клетки, а клеточная подмодель является источником возбуждения для соответствующего региона.
Региональная подмодель
Региональная подмодель основана на оригинальной модели «Эпилептор» и рассчитывает взаимодействия между взаимосвязанными регионами мозга. Подмодель реализована в BioUML в виде математических уравнений, генерируемых на основе передаваемых пользователем матриц связности и задержек, что позволяет моделировать распространение эпилептического припадка по различным областям мозга для конкретного пациента. Ключевым фактором, определяющим возникновение эпилептиформной активности в мозговой сети, является возбуждающий сигнал, поступающий в каждый регион из соответствующей клеточной подмодели.
Клеточная подмодель
Клеточная подмодель включает в себя три компартмента (отсека/области): внутриклеточное пространство (пространство внутри клетки), внеклеточное пространство (область вблизи нейрона) и внешнюю ванну (сосудистую сеть мозга).
Подмодель рассчитывает динамику концентраций ионов, кислорода (использующегося при синтезе молекул АТФ, которые расходуются на обеспечение активного транспорта ионов), потенциала мембраны и иных клеточных процессов, обуславливающих развитие эпилептиформной активности. Это объясняет природу возникновения возбуждающих сигналов, используемых в региональной подмодели. При этом учитывается изменение синаптической эффективности в результате перемещений АМПА-рецепторов. В BioUML клеточные подмодели также реализованы в виде математических уравнений.
Рецепторная подмодель
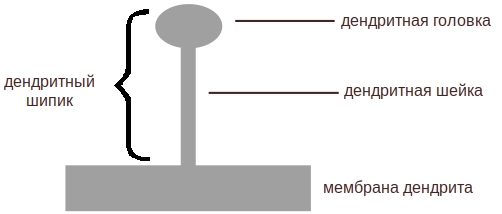
Рецепторная подмодель симулирует динамику перемещений АМПА-рецепторов в дендритном шипике (помним, что АМПА-рецепторы динамически перемещаются между мембраной и цитоплазмой клетки, определяя тем самым силу синаптической передачи). При этом дендритный шипик – это вырост на поверхности мембраны дендрита, способный образовывать синаптические соединения.
Подмодель состоит из четырех компартментов: постсинаптического уплотнения (ПСУ), экстрасинаптической мембраны (ЭСМ), внутриклеточного хранилища рецепторов и поверхности дендрита. Постсинаптическое уплотнение представляет собой область головки дендритного шипика, богатую рецепторами и находящуюся близко к активной зоне синапса. Под экстрасинаптической мембраной понимается вся остальная часть головки шипика. В BioUML рецепторные подмодели реализованы в виде SBGN диаграмм.
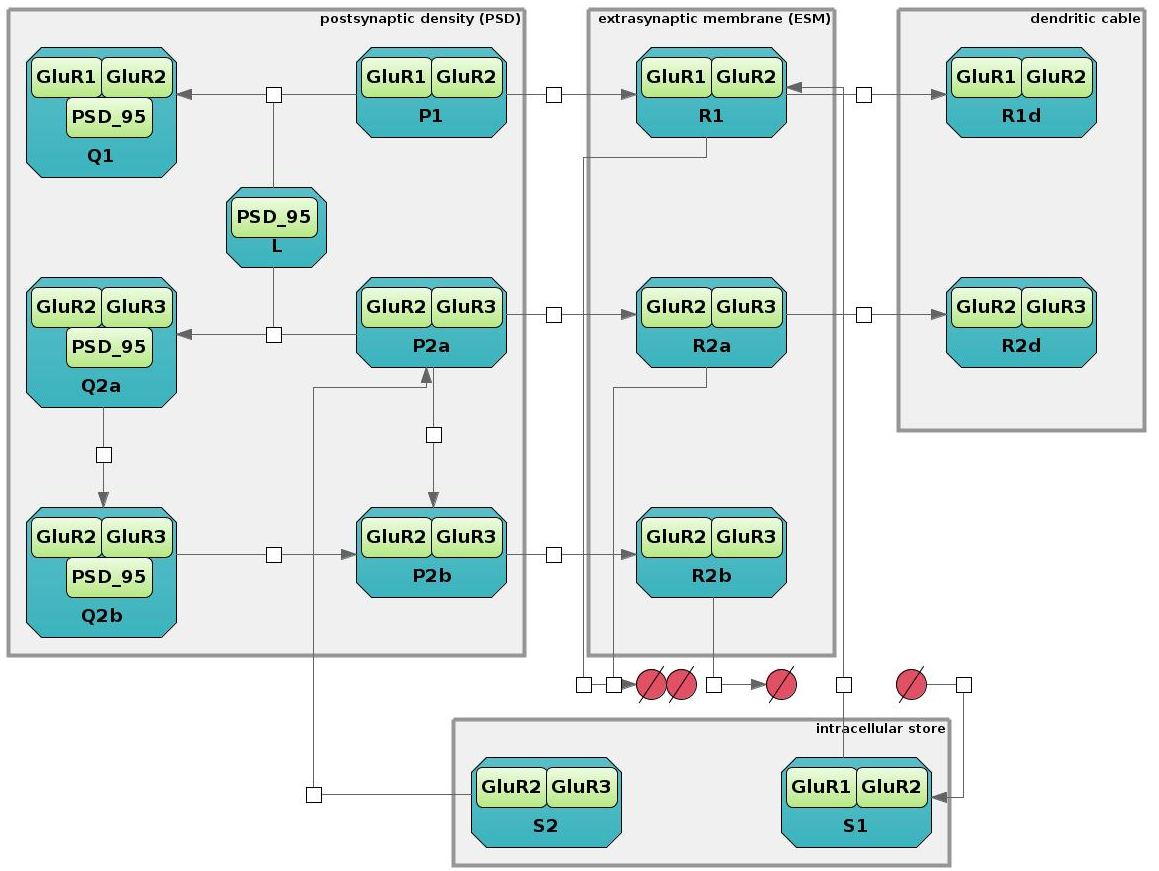
В состав большинства АМПА-рецепторов мозга входит субъединица GluR2 в сочетании либо с GluR1, либо с GluR3. Рецепторы, состоящие из GluR1 и GluR2 обозначаются в подмодели как рецепторы первого типа, а состоящие из GluR2 и GluR3 – как второго типа.
Рецепторы могут диффундировать между ПСУ и ЭСМ, а также между ЭСМ и поверхностью дендрита. Также происходит встраивание рецепторов в ПСУ и ЭСМ из внутриклеточного хранилища и их деградация путем экзоцитоза.При этом в ПСУ присутствуют скаффолд-белки (скаффолд – это каркас, временная поддержка), на примере белка PSD-95, связывание с которыми закрепляет рецепторы в ПСУ.
Модульная структура многоуровневой модели
Построение многоуровневой модели проводилось на платформе BioUML с использованием модульного подхода, позволяющего разбивать систему любой сложности на элементарные составляющие – модули.
Для создания модульной модели необходимо задать подмодели, обозначить в них входные и выходные переменные, и соединить их соответствующими связями.

Без ограничения общности модульная структура многоуровневой модель представлена на рисунке ниже для системы, состоящей всего из 2 регионов.
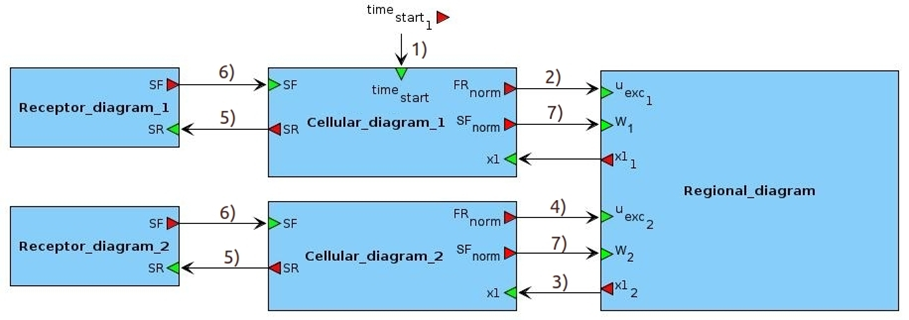
При этом первый регион сделан эпилептогенным, то есть связанная с ним клеточная подмодель является очагом возникновения эпилептических припадков, а второй – здоровым, то есть связанная с ним клетка не может самостоятельно проявлять эпилептиформную активность.
Клеточные и рецепторные подмодели, связанные с эпилептогенными или здоровыми регионами, также именуются эпилептогенными или здоровыми.
Развитие припадков в многоуровневой модели происходит по следующему механизму.
Вначале в эпилептогенные клетки передается временной триггер, по достижении которого они возбуждаются и генерируют возбуждающие сигналы для соответствующих регионов.
За счет структуры сети припадок распространяется и на здоровые регионы, а начало каждого регионального припадка сопровождается возбуждением соответствующих здоровых клеток.
В случае развития синаптической активности эпилептогенные рецепторные подмодели переходят в состояние долговременной потенциации, характеризующееся увеличением количества рецепторов в синапсе, а здоровые рецепторные подмодели переходят в режим долговременной депрессии, приводящий к снижению синаптической эффективности.
Путем линейной интерполяции числа рецепторов в синапсе рецепторные подмодели определяют синаптическую эффективность соответствующих клеток.
При этом клетки определяют синаптические силы соответствующих регионов, которые используются при вычислении глобальной силы связности (является коэффициентом масштабирования связности всей сети).
Результаты клеточного уровня
Развитие припадков на клеточном уровне происходит по следующему механизму. Вначале в результате патологических изменений происходит накопление избытка калия во внеклеточном пространстве, в результате чего мембрана деполяризуется и клетка генерирует потенциалы действия. При этом сила генерируемых разрядов определяется динамикой АМПА-рецепторов.
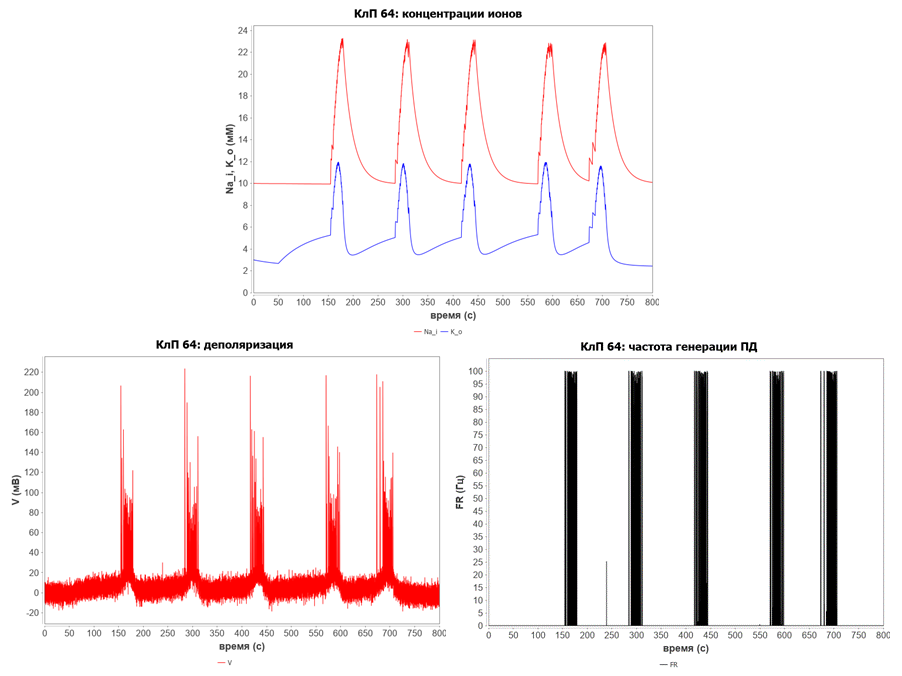
Аномальная частота возникновения потенциалов действия передается в соответствующий клетке регион региональной подмодели в качестве возбуждающего сигнала.
Результаты регионального уровня
Для расчета региональной подмодели мозг разбивался на 84 региона. На рисунке ниже представлены модельные потенциалы, фиксируемые во внеклеточном пространстве рассматриваемых регионов (такие внеклеточные потенциалы называются потенциалами локального поля, от английского Local Field Potential, LFP). Красной линией выделен определенный для конкретного пациента очаг возникновения эпилептических припадков (регион с индексом 64).
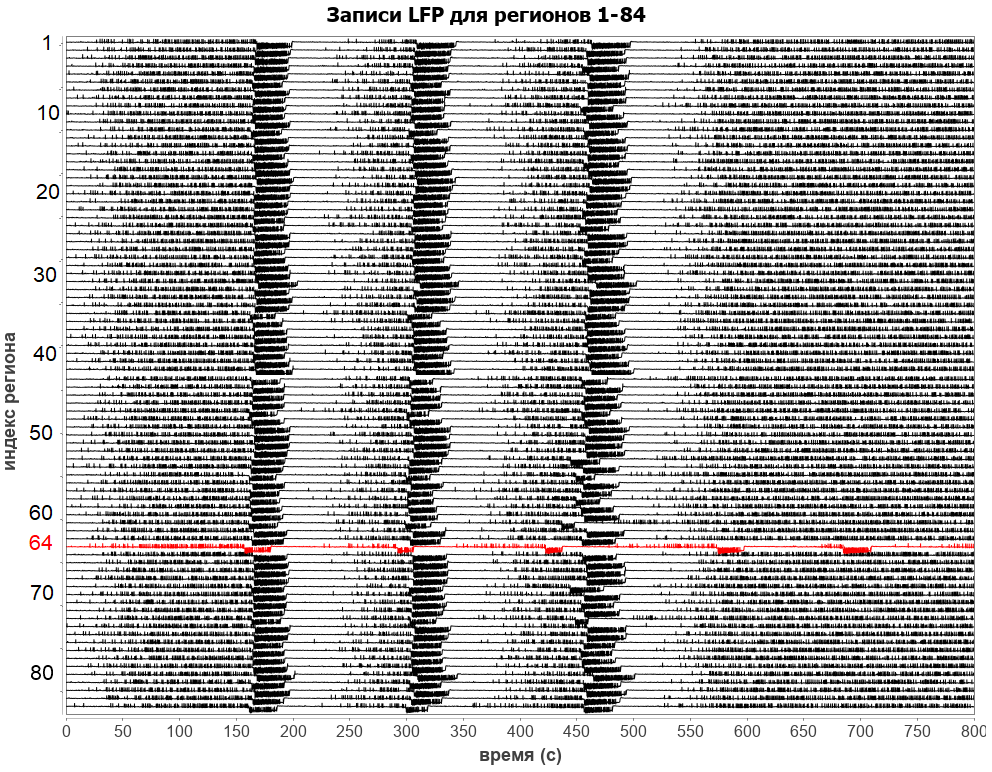
За все время симуляции в 64 регионе произошло пять периодов припадков. При этом видно, что каждый возникающий припадок может либо распространиться по мозговой сети (первые три припадка), либо локализоваться в его источнике (последние два). В случае распространения припадка у пациента будут наблюдаться различные двигательные симптомы, в то время как локализованные припадки зачастую протекают бессимптомно.
Воспроизводимость результатов
Весьма распространенной проблемой в области математического моделирования является невозможность воспроизведения результатов моделей ввиду отсутствия выложенного авторами программного кода и/или некорректного изложения уравнений и параметров.
Порой доходит до абсурда, когда воспроизведение результатов некоторой модели сравнимо по временным затратам с разработкой собственной модели с нуля.
Поэтому наш коллектив придерживается принципа, что все полученные результаты должны быть выложены в свободный доступ вместе с полным набором файлов и руководством по их использованию.
Построенная многоуровневая модель, Jupyter-ноутбук, позволяющий воспроизвести результаты ее расчета, и README-файл с руководством выложены в открытом репозитории по ссылке. Там же можно ознакомиться с текстом моего магистерского диплома.
Университет «Сириус»
Выполнение данной работы проводилось в рамках магистратуры по биоинформатике в Научно-технологическом Университете «Сириус».
В конце июня 2023 г. «Сириус» выпустил первый набор магистрантов (в число которых вхожу и я), тем самым успешно состоявшись как Университет.
Сейчас в самом разгаре идет прием в магистратуру, в том числе на биоинформатику.
Подать документы и сдать экзамены можно онлайн. Прием заявок на вторую волну заканчивается 28 июля.
Напоследок оставлю для заинтересовавшихся ссылку на отличное учебное пособие по биофизике за авторством Андрея Борисовича Рубина и порекомендую книгу Евгения Ижикевича для погружения в вычислительную нейробиологию.
Кондрахин Павел,
Младший научный сотрудник направления «Вычислительная биология»
Научный центр информационных технологий и искусственного интеллекта
Университет «Сириус»


