Современная диагностика заболеваний путем визуализации насчитывает множество методов: МРТ, КТ, ФА, УЗД и т.д. Каждый из них по-своему уникален и предоставляет определенный спектр информации про здоровье пациента. Однако у всего есть свои недостатки, и вышеперечисленные методы не исключение. Ученые из Стэнфордского университета решили разработать новый метод визуализации, который будет объединять в себе сильные стороны сразу нескольких классических методов, но при этом будет лишен их недостатков. Основой изобретения стал разработанные ими контрастный агент, с помощью которого можно проводить раннюю диагностику ишемической болезни сердца пациентов, у которых пока еще нет видимых симптомов. Что лежит в основе нового метода и как он работает? Об этом мы узнаем из доклада ученых. Поехали.
Основа исследования
Одной из самых распространенных причин смерти в мире является ишемическая болезнь сердца (ИБС), когда коронарное кровообращение нарушается, что приводит к поражению миокарда. Острая форма ИБС выражена инфарктом миокарда, а хроническая — периодическими приступами стенокардии. Однако до проявления очевидных симптомов заболевание протекает достаточно скрытно, от чего больной далеко не сразу знает о том, что он болен.
Ввиду отсутствия явных симптомов на ранних этапах развития ИБС обнаружить ее признаки достаточно сложно даже с помощью КТ (компьютерная томография). Если же болезнь находится на «заметной» для диагностического оборудования стадии, то тут возникают другие сложности: например, МРТ не может точно определить нагрузку на атеросклеротические бляшки и степень их стеноза (сужение любой полой структуры организма), что значительно усложняет прогнозирование сердечных приступов. Следовательно, чем раньше диагностирована ИБС, тем больше шансов предотвратить разрыв бляшек.
Исследователи считают, что неинвазивные методы визуализации патобиологии бляшек могут быть ключом к успешной ранней диагностики ИБС. В ядерной визуализации уровень поглощения фтордезоксиглюокозы (наиболее распространенная ПЭТ-метка*) напрямую коррелирует со степенью инфильтрации бляшек в макрофагах в большинстве воспаленных артерий по сравнению со здоровыми артериями.
ПЭТ-метка* — радиоактивный препарат (радиолиганда), используемый в позитронно-эмиссионной томографии (ПЭТ) в качестве маркирующего вещества.
К примеру, болезнь Гортона (гигантоклеточный артериит) и синдром Такаясу (неспецифический аортоартериит) выявляют и количественно определяют с помощью метки [11C]PK11195 в сочетании с ПЭТ и КТ.
В свою очередь МРТ может быть использовано для выявления накопления оксида железа макрофагами, что является признаком атеросклеротического воспаления композитных бляшек. Визуализация наночастиц оксида железа как правило осуществляется посредством последовательностей градиентных эхо-сигналов. Эти последовательности создают устойчивые контрасты в паренхиматозных органах, таких как миокард (сердце), печень и поджелудочная железа, генерируя гипоинтенсивность сигнала или отрицательный контраст, окружающий область наночастиц оксида железа. Однако при таком подходе трудно отобразить стенки сосуда из-за отсутствия подходящего фона для негативного контраста из-за присутствия большого количества воздуха в структурах, окружающих стенку сосуда в области грудной клетки и шеи.
Еще одним методом диагностики является фотоакустическая визуализация. Этот относительно молодой метод используется для обнаружения скоплений липидов, специфичных для бляшек, в структуре коллагена и тромбоза сонной артерии в диапазоне длин волн 1130–1250 нм. Однако и у этого метода есть свои существенные недостатки.
В данном исследовании ученые решили создать новый метод диагностики, который сможет конкурировать по эффективности с МРТ, КТ или фотоакустической визуализацией, но без их недостатков. Основой метода является разработанный авторами исследования контрастный NIR-агент (NIR — ближний инфракрасный диапазон), названный NET (NIR эритроцитарный датчик). В дополнение к NET были использованы системы фотоакустической (ФА) и флуоресцентной визуализации, что в совокупности позволило выявлять воспаления в коронарных артериях.

Изображение №1: схема экспериментальной установки нового метода диагностики.
Процесс работы нового метода можно описать так: во время ФА визуализации, когда неионизирующий лазерный импульс попадает в коронарную артерию, он может обнаружить стеноз или закупорку вследствие термоупругого расширения от поглощения энергии NET внутри воспалительных клеток. Далее эти расширения будут обнаружены ультразвуковым преобразователем как волна акустического давления и преобразованы в ФА сигналы.
На данном этапе исследования все опыты проводились на лабораторных мышах с лигированием* левой передней нисходящей коронарной артерии.
Лигирование* — наложение на кровеносный сосуд лигатуры (специальной нити) для остановки кровотечения. В случае данного исследования — для имитации закупорки артерии.
Подготовка NET
NET были изготовлены из эритроцитов мышей вида Swiss Webster Sentinel. Забор крови производился с помощью шприцов, покрытых 3% гепарином. Далее выполнялось центрифугирование (1000 х g в течение 5-10 минут при 4 °С) для отделения эритроцитов.
Плазму и лейкоцитарную оболочку удаляли перед повторным суспендированием осадка эритроцитов в физиологическом растворе с фосфатным буфером (PBS) с осмотической концентрацией* около 320 миллиосмоль. Далее эритроциты повторно центрифугировали (1000 х g в течение 5–10 минут при 4 °C) и трижды промывали с помощью PBS.
Осмотическая концентрация* — суммарная концентрация всех растворенных частиц.
После каждого промывания выполнялось удаление супернатанта*.
Супернатант* — жидкость, остающаяся после того, как нерастворимые вещества осаждаются в процессе центрифугирования.
Затем эритроциты подвергали гипотонической обработке путем повторного суспендирования в 0,25хPBS (≈ 80 миллиосмоль) и оставляли инкубироваться в течение ≈10 минут перед центрифугированием (20000 х g в течение 20 минут при 4 °C).
Надосадочную жидкость, содержащую гемоглобин, удаляли, а гипотоническую обработку повторяли до тех пор, пока осадок эритроцитов не приобретал белый цвет, что указывало на их гемоглобиновое истощение (EG).
Для формирования наноразмерных частиц осадок эритроцитов 20 раз просеивали через поликарбонатные пористые мембраны (400 нм и 200 нм). После чего процесс центрифугирования и промывания был повторен еще несколько раз.
Результаты экспериментов
NET показал пиковое распределение гидродинамического диаметра в пределах 89.92 ± 3.35 нм на основе динамического рассеяния света (2а) и сильное поглощение на 600–800 нм из-за присутствия ICG* (2b).
ICG* (индоцианин зеленый) — цианиновый краситель, добавленный в состав NET для лучшей визуализации.
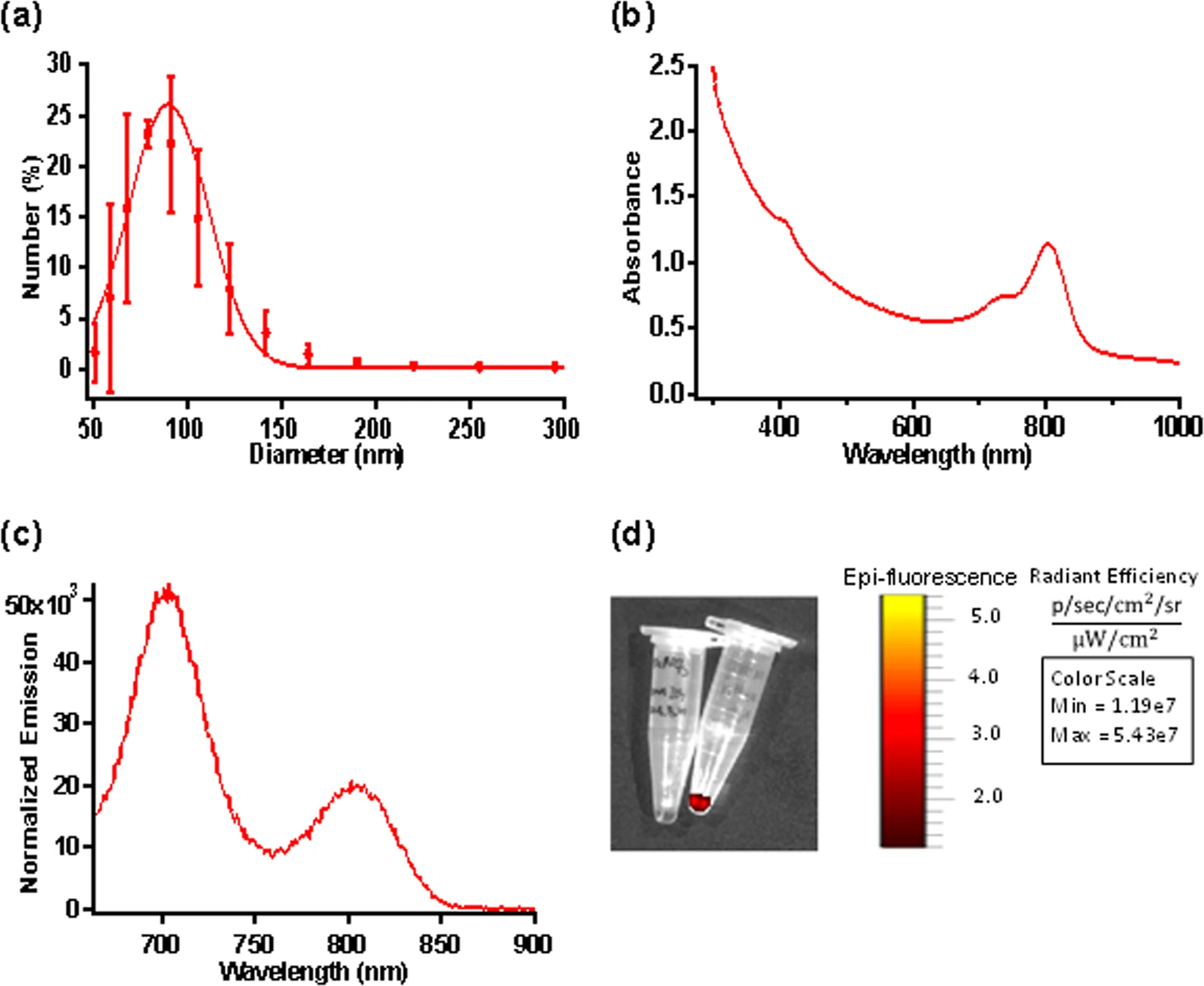
Изображение №2: характеристика NET.
В ответ на фотовозбуждение при 650 нм наблюдались пики флуоресцентного излучения при ≈ 700 и 790 нм, соответствующие H-подобным и мономерным формам ICG (2c).
Чтобы определить правильную концентрацию дозы NET, была проведена оценка эффективности излучения двух вариантов концентрации: 20 мкМ и 1 мМ (2d). Этот анализ показал, что эффективность излучения для 20 мкМ составила 5.43 х 107 (ф/с/см2/ср) / (мкМ/см2).
ф/с/см2/ср* — количество фотонов в секунду, которые покидают квадратный сантиметр ткани и излучаются в телесный угол в один стерадиан.
При этом для варианта концентрации в 1 мМ ничего обнаружено не было, что свидетельствует об агрегационном подавлении. Потому было принято очевидное решение использовать для запланированных опытов на мышах исключительно 20 мкМ NET.
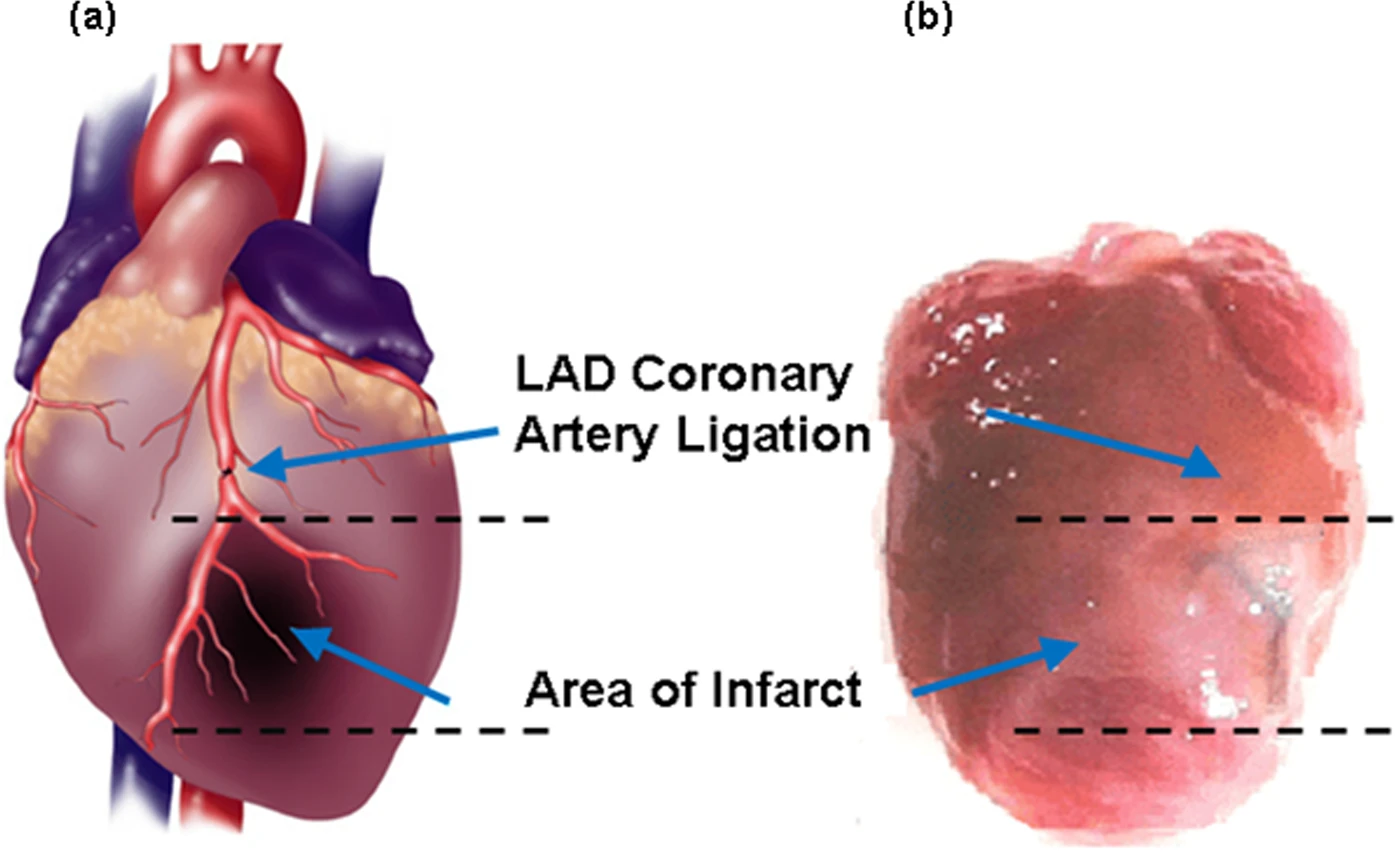
Изображение №3: схема сердца мыши, на которой видно место проведения лигирования артерии и область инфаркта.
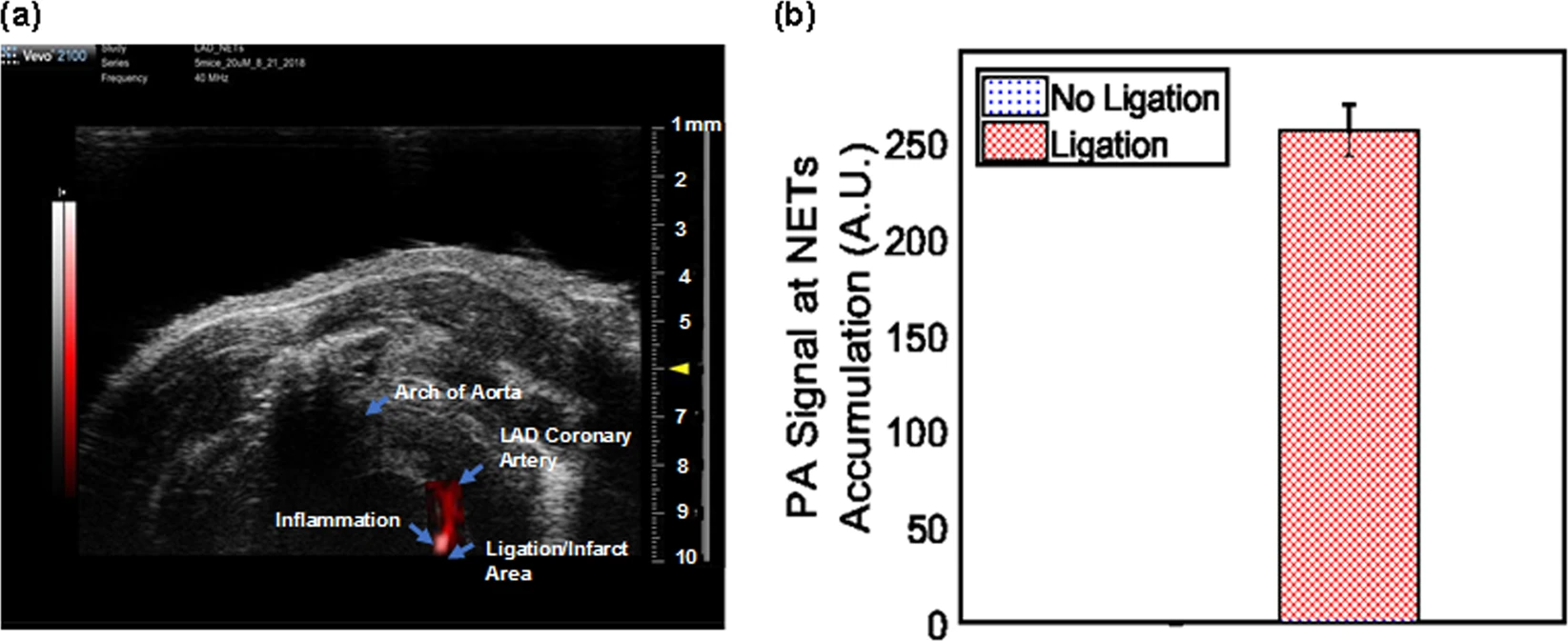
Изображение №4: визуализация области лигирования артерии спустя 1 час после введения NET.
1.5 мм область над точкой лигирования (4а, желтая стрелка) соответствует накоплению NET, ввиду чего фотоакустический сигнал этого участка (4b) был в 256 раз сильнее (±13.73), чем сигнал участка без лигирования.
При этом накопление NET в коронарной артерии, тимусе и печени обеспечивало сильные флуоресцентные сигналы при визуализации через целую кожу (5a), т.е. без необходимости инвазивного вмешательства.

Изображение №5: визуализация накопления NET в области лигирования, подтвержденная диссекцией.
Подобные сигналы, исходящие от сердца, наблюдались и после диссекции грудной клетки (5b).
Область инфаркта с фиброзной тканью также была успешно идентифицирована ниже перевязки (5c, синяя стрелка) коронарной артерии (5c, зеленая стрелка).

Изображение №6: сравнение сигналов при визуализации с целой или раскрытой грудной клеткой.
Также наблюдалось усиление флуоресцентных сигналов на 1.6-2 при визуализации открытой грудной клетки, чем при неинвазивной диагностике. Это объясняется ослаблением света, возникающего в результате рассеяния на костях грудной клетки, кожи и жировых слоев. Именно потому печень показала одинаковые сигналы в обоих вариантах визуализации.
Сравнение сигналов от разных областей показало, что сигнал коронарной артерии с лигированием в 1.32 раза выше, чем сигнал тимуса, и в 1.96 раза выше, чем сигнал печени.
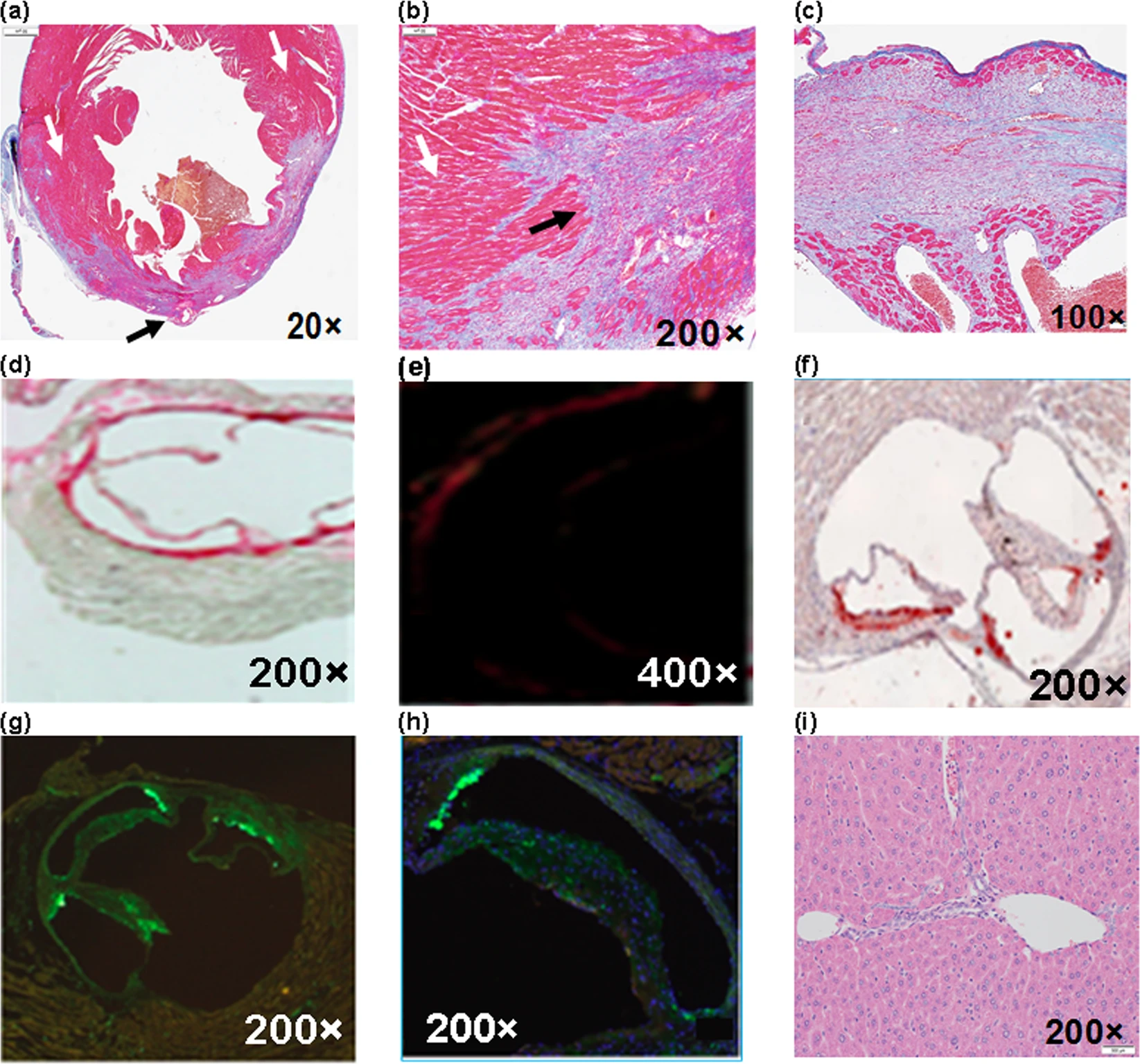
Изображение №7: визуализация области инфаркта.
Область инфаркта (3b), состоящая из рубцов и некроза тканей в левом желудочке сердца, находилась непосредственно под перевязанной коронарной артерией (7a и 7b).
Целые жизнеспособные миоциты (мышечные клетки) наблюдались только в правом желудочке. Окрашенная трихромом перегородка между левым и правым желудочками была выделена синим коллагеном, указывающим на область инфаркта с рубцеванием, грануляцией и фиброзом (7c). Маркер визуализации Picrosirius red указывает на деградированный коллаген (7d) в пораженной коронарной артерии. Поляризованный свет был использован для идентификации типа деградированного коллагена (7e). Посредством Oil Red O (лизохромный азокраситель) было определено количество липидов вблизи области лигирования (7f). А Mac-2 и Dapi позволили выявить сильное воспаление из-за накопления крупных макрофагов в области лигирования (7g и 7h).
Окрашенная H&E печень показала нормальный портальный тракт (7i), отсутствие паренхиматозного некроза, воспаления, фиброза или других патологических изменений, что указывает на высокий уровень биосовместимость NET.
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых.
Эпилог
По словам исследователей, их метод диагностики объединяет в себе сильные стороны классических методов, и это не просто громкие слова. Комбинирование фотоакустической и флуоресцентной визуализации позволяет более точно обнаруживать окклюзии и, возможно, воспалительные клетки, таких как макрофаги.
Когда внедренный в организм агент NET активируется посредством импульсного лазерного излучения, генерируются ФА сигналы, которые можно преобразовать в изображения.
Реконструкция фотоакустических изображений аналогична ультразвуковым, но с пространственной картой оптического поглощения эндогенными и экзогенными составляющими. Оптическое поглощение и ультразвуковое рассеяние тканей коронарной артерии делают его оптимальным для фотоакустической визуализации с высоким разрешением и глубиной до 3–5 см. Тогда как флуоресцентная визуализация ограничена как в плане разрешения, так и в плане глубины (несколько миллиметров).
Одной из важнейших особенностей разработанного контрастного агента NET является то, что он не поглощается мышечными клетками, тем самым снижая фоновый шум, который обычно присутствует при использовании стандартных ПЭТ-агентов (например, 18F-FDG).
В проведенных экспериментах ученые рассматривали сердце, как объект для диагностики. Однако новый метод можно применять и для других органов, тем самым позволяя медикам получать столь важную информацию о пациентах, даже когда симптоматика еще не столь явная.
Работа диагноста сравнима с формулой-1, но вместо болида соперника, врач соревнуется в скорости с заболеванием, а призом в этой гонке является жизнь пациента. Когда на кон поставлена чья-то жизнь, дорога каждая секунда, потому создание новых методов ранней диагностики столь важны.
Благодарю за внимание, оставайтесь любопытствующими и отличных всем выходных, ребята! 🙂
Немного рекламы 🙂
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99, уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5-2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Equinix Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?


