Даже в абсолютно пустой комнате, где на первый взгляд никого нет, бурлит жизнь. Речь, конечно же, о микроорганизмах, которых не увидеть без специального оборудования. Но, как говорится, суслика не видно, а он есть. Микробы по распространенному мнению — это злобные мелкие существа, от которых добра не жди. И в этом есть смысл, так как огромное число разнообразных микроорганизмов (бактерий, вирусов и грибков) являются патогенами самых разных заболеваний. Однако даже в такой недружелюбной толпе имеются и весьма полезные индивиды. Мы (т.е. ученые и врачи) это можем прекрасно понимать, чего не скажешь про нашу иммунную систему. А потому ученые из Колумбийского университета (США) создали систему, которая маскирует полезные бактерии, главной функцией которых является обнаружение и ликвидация раковых клеток. На чем основана данная система, каков ее функционал, и насколько она эффективна? Ответы на эти вопросы мы найдем в докладе ученых. Поехали.
Основа исследования
Человек это не просто самостоятельный организм, бегающий по земле в поисках пищи, крова над головой и бесплатного Wi-Fi. Наш организм является домом для множества полезных и вредоносных микроорганизмов, которые в совокупности составляют наш микробиом. С вредными все ясно — они используют наше тело в своих целях, что приводит к негативным последствиям для носителя, т.е. нас. Но вот с полезными бактериями у нас за долгие годы ко-эволюции выработался своеобразный симбиоз. К примеру, в пищеварительной системе человека имеются бактерии, которые сопутствуют перевариванию пищи. Потому нет ничего удивительного в повышении интереса к созданию методик применения живых бактерий в лечении различных заболеваний.
Ученые отмечают, что такие микробы могут быть запрограммированы как интеллектуальные живые лекарства, которые чувствуют окружающую среду и реагируют на нее. Они могут направляться в определенную область тела, доставляя терапевтические средства туда, где они наиболее необходимы.
Но, как и в любой нестандартной разработке, тут также имеются проблемы и ограничения. К примеру, было установлено, что токсичность живых бактерий для носителя ограничивает переносимую дозу и эффективность, что в некоторых случаях приводит к прекращению клинических испытаний. Более того, в отличие от обычных носителей лекарственных средств (инъекции, таблетки и т.д.), уникальные способности бактерий непрерывно размножаться и перемещаться требует надежного и временного контроля бактериальной фармакокинетики in vivo (т.е. внутри живой ткани или внутри живого организма).
Одним из подходов к преодолению иммуногенности и токсичности терапии живыми бактериями является создание генетических нокаутов (т.е. «отключения») иммуногенных бактериальных поверхностных антигенов, таких как липополисахарид (ЛПС или LPS от lipopolysaccharide). Данный метод действенный, даже слишком, так как приводит к постоянному ослаблению штамма и уменьшению колонизации бактерий.
Альтернативой может стать метод маскировки бактерий посредством поверхностной модуляции, т.е. создания синтетического покрытия микробных поверхностей определенными молекулами (например, альгинат, хитозан, полидофамин, липиды и т.д.). Но такие одноразовые статические модификации бактерий не допускают модуляции in situ (т.е. в естественной среде / на месте зарождения) и могут привести к неконтролируемому росту, нецелевой токсичности тканей или нарушению клеточной функции, что приводит к снижению эффективности. А потому вопрос остается открытым.
В рассматриваемом нами сегодня труде ученые предложили решение этого вопроса в виде настраиваемой системы инженерии микробной поверхности с использованием синтетических генных цепей для динамического контроля взаимодействия бактерий с окружающей средой. Основное внимание было уделено поверхностному капсулярному полисахариду бактерий (CAP от capsular polysaccharide), т.е. природному внеклеточному биополимеру, который покрывает внеклеточную мембрану и защищает микробы от различных опасностей окружающей среды. В организме человека CAP способствует выживанию и колонизации бактерий, защищая микробы от различных иммунных факторов, таких как опсонины комплемента и фагоциты.
Важной особенностью созданной системы является программируемость экспрессии CAP, которая регулирует бактериальную поверхность с помощью внешнего индуктора, тем самым модулируя взаимодействие бактерий с противомикробными препаратами, бактериофагами, кислотностью и иммунитетом носителя. Это позволяет точно контролировать иммуногенность и выживаемость бактерий in vivo, позволяя тем самым увеличить дозировку и транспортировку in situ, чтобы максимизировать терапевтическую эффективность и безопасность (изображение №1).
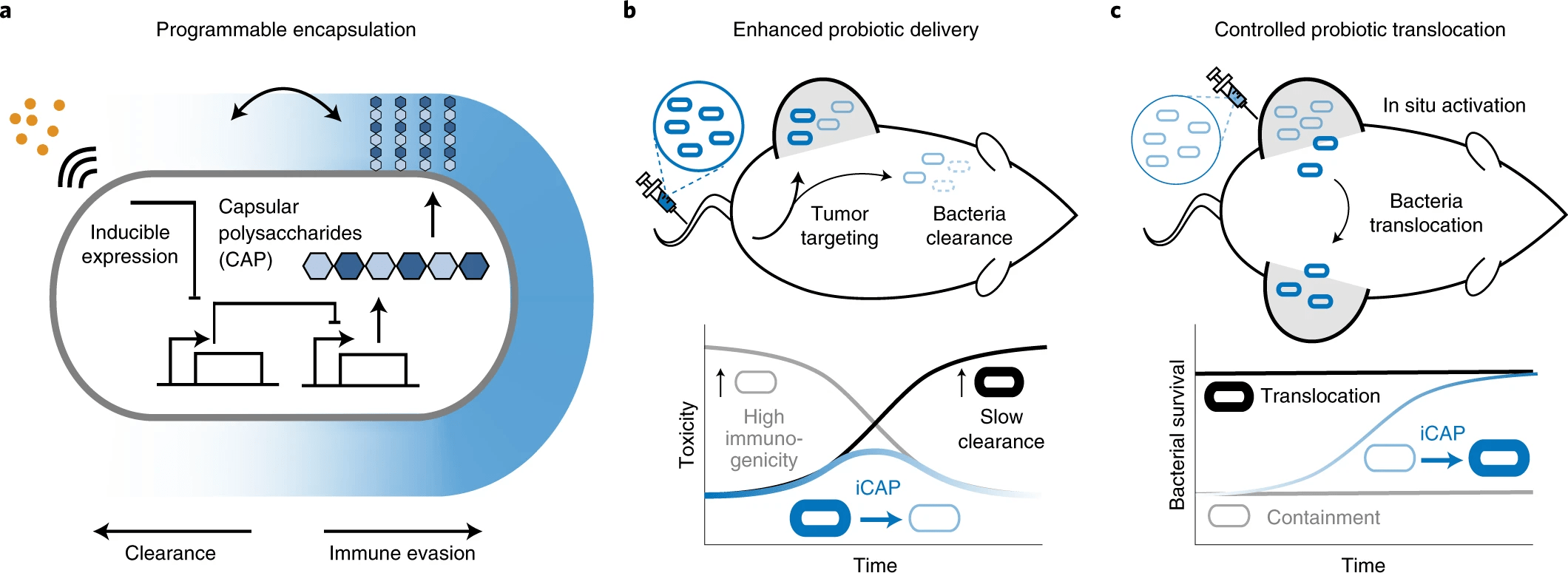
Изображение №1
Результаты исследования
Поскольку для терапевтических целей использовались различные бактерии, ученые сравнили иммуногенность и жизнеспособность нескольких штаммов Escherichia coli и Salmonella typhimurium. Сравнение показало, что E. coli Nissle (EcN) — пробиотический штамм с благоприятными клиническими профилями имеет высокую жизнеспособность в цельной крови человека. При введении мышам EcN вызывал наименьший иммуногенный ответ в крови.
Поскольку было показано, что CAP типа K5, полученный из EcN, изменяет взаимодействие с иммунной системой носителя, было решено генетически модифицировать его биосинтетический путь. CAP типа K5, полученный из EcN, также известный как гепарозан, состоит из полимерной цепи чередующихся β-D-глюкуроновой кислоты (GlcA) и N-ацетил-α-D-глюкозамина (GlcNAc), присоединенных к 3-дезокси-D- линкер манно-окт-2-улозоновой кислоты (Kdo) (2а).
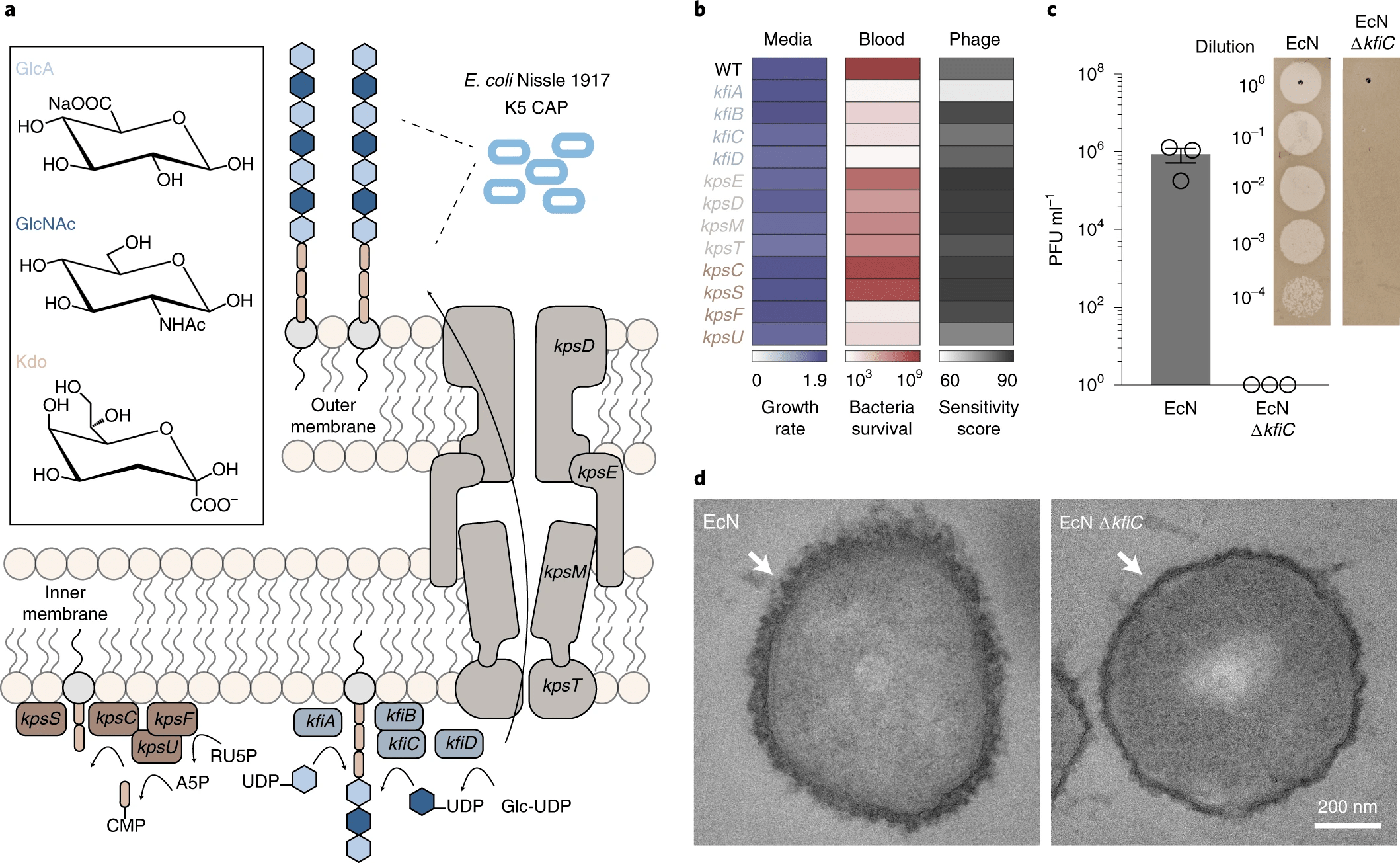
Изображение №2
Гликотрансферазы генов kfiABCD полимеризуют чередующиеся субъединицы GlcA и GlcNAc. Гены kpsCSFU кодируют белки, ответственные за синтез поли-Kdo линкера на концевом липиде, а гены kpsEDMT кодируют переносчики CAP на клеточную поверхность.
Ученые говорят, что они хотели идентифицировать ключевые гены CAP, способные изменять реакцию на антибактериальные факторы, встречающиеся во время терапевтического введения. Для этого была создана библиотека штаммов с нокдауном (KD от knockdown) с использованием синтетических малых РНК (sRNA), которые снижают экспрессию генов kfi и kps посредством комплементарного связывания с мРНК.
Чтобы первоначально оценить эффект подавления каждого из генов, был проведен скрининг роста KD штаммов в: богатой питательными веществами среде; в цельной крови человека и в фаге*, нацеленном на CAP.
Бактериофаги (фаги)* — вирусы, заражающие бактериальные клетки.
Рост в среде, богатой питательными веществами, показал небольшое изменение максимальной удельной скорости роста (мкм) штамма EcN дикого типа, экспрессирующего CAP (2b). Это позволяет предположить, что подавление генов-мишеней в пути биосинтеза CAP не сильно влияют на пригодность EcN при отсутствии угроз окружающей среды. Однако наблюдалось снижение жизнеспособности KD штаммов по сравнению с EcN после инкубации в цельной крови в течение 30 минут. После 6-часовой инкубации в цельной крови KD штаммы в синтезе CAP (гены kfi и kpsFU) проявляли более низкую жизнеспособность, чем штаммы KD в транспорте CAP (kpsEDMT).
Чтобы оценить, вызывает ли каждый нокдаун гена полную или частичную потерю CAP у KD штаммов, был использован литический бактериофаг ΦK1-5, который специфически связывается с гепарозаном* EcN.
Гепарозан* — эндогенный гликозаминогликан, известный как природный биопредшественник гепарина у млекопитающих.
Бактерии, которые экспрессируют остаточные уровни CAP гепарозана, чувствительны к этому фагу, но полная потеря CAP дает иммунитет.
Далее, чтобы отменить эффект остаточной экспрессии CAP гена, была создана библиотека штаммов с нокаутом (KO от knockout) путем удаления генов синтеза CAP (kfiABCD) из генома EcN.
Примечательно, что KO штаммы продемонстрировали повышенную чувствительность в крови. Это указывает на то, что уровни CAP могут быть генетически настроены для изменения чувствительности к антибактериальным факторам.
На основании приведенных выше результатов ученые решили дополнительно охарактеризовать kfiC — хорошо изученный ген, кодирующий гликотрансферазу GlcNAc. KfiC играет центральную роль в производстве гепарозана, образуя связанный с мембраной комплекс с KfiA и KfiB, а потеря этой важной гликотрансферазы приводит к прекращению производства CAP. Результаты показали, что подавление kfiC с помощью нокдауна sRNA сенсибилизирует* бактерии в крови, подтверждая его ключевую роль в регуляции бактериальной защиты. Также было установлено, что делеция* kfiC приводит к максимальному повышению чувствительности в крови. Это указывает на то, что уровень защиты можно изменить, контролируя экспрессию генов.
Сенсибилизация* — приобретение организмом специфической повышенной чувствительности к чужеродным веществам.
Делеция* — хромосомные перестройки, при которых происходит потеря участка хромосомы.
Чтобы подтвердить потерю CAP с бактериальной поверхности, была проведена характеризация поверхностных свойств EcN штамма ΔkfiC. Анализ образования фаговых бляшек подтвердил полный иммунитет против ΦK1-5 (2с).
Дополнительно была проведена просвечивающая электронная микроскопия (ПЭМ) с окрашиванием рутениевым красным для оценки изменений морфологии поверхности бактерий. CAP был виден как слой полисахаридов толщиной ~ 80 нм, покрывающий снаружи клеточную мембрану. А вот EcN ΔkfiC имеет меньший размер полисахаридного слоя на уровне ~ 40 нм (2d).
На следующем этапе ученые исследовали способность CAP защищать клетки от широкого спектра антимикробных факторов. В дополнение к измененной чувствительности к цельной крови человека и бактериофагам EcN ΔkfiC продемонстрировал значительное снижение клеточной защиты от панелей антибиотиков (спектиномицин, ампициллин, гентамицин, канамицин и стрептомицин) и экстремальных кислот (pH 2.5) по сравнению с EcN.
Вместе эти результаты демонстрируют, что потеря CAP изменяет структуру клеточной поверхности и защиту от антимикробных факторов.
Далее ученые создали программируемую систему CAP, которая может воспринимать индукционные стимулы и реагировать на них, а также модулировать свойства клеточной поверхности.

Изображение №3
Сначала kfiC клонировали под контролем промотора lac, который может быть активирован низкомолекулярным индуктором изопропил-b-D-тиогалактопиранозидом (IPTG от isopropyl-b-D-thiogalactopyranoside) (3а). Была создана небольшая библиотека плазмид с различным числом копий kfiC, затем тестировались различные комбинации с lacI, экспрессированными из генома EcN, или с плазмидой для оптимизации жесткой регуляции продукции CAP. EcN ΔkfiC, трансформированный плазмидой с низким числом копий, продемонстрировал полный иммунитет против ΦK1-5, что указывает на сильную репрессию на базальном уровне. Индукция IPTG восстанавливала чувствительность фага, подтверждая возможную модуляцию CAP на клеточной поверхности.
Далее ученые исследовали возможность настройки этой индуцируемой системы CAP (iCAP от inducible CAP), охарактеризовав несколько условий индукции. SDS-PAGE показал увеличение продукции CAP из EcN, несущего систему iCAP (EcN iCAP), при инкубации с повышением уровня IPTG (3b). Совместная инкубация с ΦK1-5 также показала снижение жизнеспособности EcN iCAP с повышением уровня IPTG.
Затем был использован ПЭМ (просвечивающий электронный микроскоп) для исследования влияния системы iCAP на морфологию клеточной поверхности (3d). Повышение уровня IPTG привело к смещению средней толщины бактериальной мембраны с 44 нм до 81 нм, что подтверждает возможность перестройки системы. Промежуточная активация iCAP при 100 нМ выявила бимодальное распределение толщины мембраны, предполагая, что kfiC регулирует уровень продукции, но не длину полисахаридных полимеров. Этот результат согласуется с данными SDS-PAGE, которые не показали различий в миграции полосы CAP в зависимости от концентрации IPTG (3b).
Впоследствии была оценена динамика производства и восстановления системы iCAP. После добавления IPTG с течением времени на SDS-PAGE наблюдалась повышенная продукция CAP, достигающая почти максимального уровня через 6 часов (3c). Аналогичным образом удаление IPTG приводило к постепенному снижению САР вплоть до полной репрессии спустя 6 часов.
Чтобы использовать систему iCAP для лечения рака in vivo, сначала необходимо проверить способность контролировать жизнеспособность бактерий в цельной крови человека, содержащей функциональные бактерицидные факторы носителя in vitro (т.е. «в пробирке»).

Изображение №4
После индукции IPTG наблюдалась повышенная выживаемость EcN iCAP по сравнению с неиндуцированной контрольной группой (4a и 4b). Повышение уровня IPTG улучшало выживаемость бактерий по крайней мере в 105 раз.
Ученым удалось достичь модуляции скорости бактериального клиренса из крови путем титрования (постепенного изменения) уровней IPTG (4c). EcN дикого типа сохранялся более 6 часов, тогда как EcN ΔkfiC быстро снижался до уровней ниже предела обнаружения в течение первых же 30 минут. Также наблюдалась защитная роль CAP в цельной крови мышей.
Чтобы исследовать влияние системы программируемого CAP на взаимодействие бактерий с отдельными иммунными факторами в цельной крови, была выполнена оценка того, как изменения CAP модулируют фагоцитоз, опосредованный макрофагами, и уничтожение, опосредованное комплементом.
Для изучения фагоцитоза EcN инкубировали с мышиными макрофагами костного мозга (BMDM от bone-marrow-derived macrophages) (4d).
Активация iCAP перед совместной инкубацией с макрофагами приводила к снижению поглощения бактерий макрофагами по сравнению с базовым контролем, демонстрируя контролируемую защиту от распознавания клеточным иммунитетом.
Подсчет бактериальных колоний лизатов макрофагов и визуализация флуоресцентной микроскопии подтвердили примерно в 10 раз меньший фагоцитоз с бактериями, индуцированными IPTG, по сравнению с неиндуцированным контролем (4e и 4f).
Чтобы оценить воспалительную реакцию фагоцитов, было проведено совместное культивирование EcN с моноцитарными клетками человека THP-1 и измерение уровней различных цитокинов, продуцируемых в ответ на обнаружение микробов (4g). Отсутствие CAP повышало уровни многих воспалительных цитокинов (4h—4j), что указывает на способность CAP маскировать микробное распознавание иммунной системой. Активированный EcN iCAP был способен снижать воспалительные реакции до уровня, аналогичного EcN.
Чтобы изучить защиту от циркулирующих противомикробных препаратов носителя, EcN подвергли воздействию плазмы человека. Наличие CAP улучшило выживаемость бактерий по крайней мере в ~ 105 раз. Это показывает, что CAP защищает бактерии от растворимых бактерицидных факторов носителя.
Совокупность вышеописанных результатов говорит о том, что внутривенная доставка бактерий внутрь организма позволяет получить доступ к различным очагам заболевания в организме. Однако задача по доставке, по мнению ученых, все еще остается крайне сложной. Связано это с быстрой реакцией иммунной системы носителя, которая старается максимально быстро очистить организм от бактерий. Следовательно, требуется увеличение численности популяции вводимых бактерий. Но это чревато тем, что часть из них может быть уничтожена лишь частично. Это может привести к бактериемии и сепсису. Другими словами, необходимо удержать очень хрупкий баланс.
Потому ученые решили сделать так, чтобы бактерии были защищены разработанной системой iCAP в период доставки. После этого защитная CAP оболочка должна распасться, что позволит иммунной системе ликвидировать уже отработанные бактерии.
Дабы изучить защитную роль CAP in vivo, ученые первым делом охарактеризовали биодоступность пробиотиков и здоровье носителя на мышах. После внутривенного введения EcN ΔkfiC количество жизнеспособных бактерий в кровотоке быстро упало ниже определяемого уровня (200 КОЕ/мл, где КОЕ — колониеобразующая единица). Напротив, EcN оставался обнаруживаемым в течение первых 4 часов, демонстрируя защитную функцию CAP in vivo.
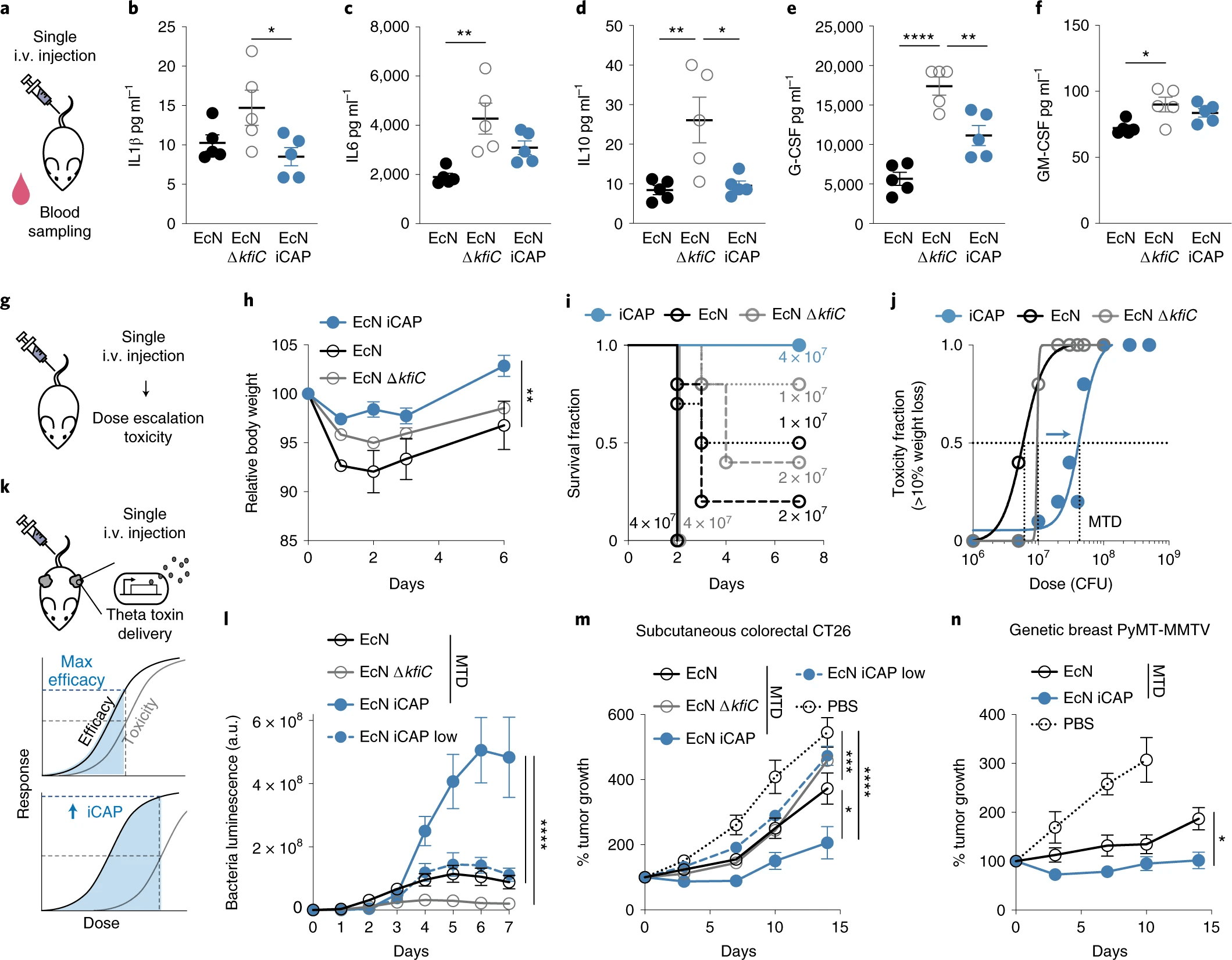
Изображение №5
Чтобы изучить реакцию хозяина на инкапсулированный (т.е. дикий тип) по сравнению с неинкапсулированным (т.е. ΔkfiC) EcN, были измерены уровни цитокинов в сыворотке (5а). Были обнаружены более низкие уровни цитокинов у мышей, которым вводили EcN, по сравнению с EcN ΔkfiC (5b—5f), что соответствует наблюдениям in vitro.
Анализ показал, что хотя CAP может улучшить биодоступность и снизить первоначальную иммуногенность, статическая защита может привести к персистенции бактерий и воспалительной реакции, создавая риски токсичности.
Ученые предположили, что временная активация системы iCAP может улучшить свойства доставки бактерий. Индукция экспрессии CAP перед инъекцией должна повысить биодоступность и маскирует индукцию цитокинов, а потеря CAP в отсутствие индуктора in vivo позволит эффективно избавиться от бактерий и свести к минимуму долгосрочные иммунные реакции.
Чтобы проверить эту теорию, сначала EcN iCAP индуцировали с 10 мкМ IPTG, потом внутривенно вводили возрастающие дозы бактерий, а затем оценивали здоровье носителя и максимальную переносимую дозу (5g).
При 5 х 106 КОЕ EcN iCAP вызывал меньшее снижение массы тела по сравнению с EcN и EcN ∆kfiC со статической клеточной поверхностью (т.е. с или без CAP соответственно) (5h). Примечательно, что EcN iCAP снижал токсичность по сравнению с EcN и EcN ΔkfiC в более высоких дозах. EcN и EcN ΔkfiC вызывали тяжелую конечную токсичность (смерть или потеря веса >15%) у мышей, получавших дозы выше 1 х 107 КОЕ в течение 2 дней, тогда как ни у одной мыши не наблюдалось тяжелой токсичности после инъекции предварительно индуцированного EcN iCAP в тех же дозах (5i). По этим данным была построена кривая зависимости токсичности от дозировки (5j).
Анализ состояния здоровья мышей также показал, что примерно в 10 раз меньше EcN и EcN iCAP было обнаружено в периферических органах (печень и селезенка) по сравнению с EcN ΔkfiC. Это указывает на то, что начальной индукции EcN iCAP было достаточно для обеспечения защиты от системы мононуклеарных фагоцитов.
На следующем этапе исследования ученые проверили, может ли программируемая система CAP быть использована для бактерий, целью которых будет доставка препаратов противоопухолевого действия (5k). Сравнительный анализ показал, что EcN iCAP демонстрирует значительно более высокие сигналы в опухолях по сравнению со всеми другими группами (5l). После введения бактерий в течение 14 дней у мышей, получивших EcN, EcN ΔkfiC и низкие дозы EcN iCAP, наблюдалось умеренное подавление роста опухоли по сравнению с группой, не получавшей лечения.
А вот однократное введение максимальной переносимой дозы EcN iCAP приводило к значительному подавлению роста опухоли примерно на 400% по сравнению с группой, не получавшей лечения (5m). EcN iCAP привел к улучшенному подавлению роста опухоли примерно на 100% по сравнению с EcN в течение 14 дней (5n).
Вышеописанные результаты говорят о том, что система iCAP позволяет увеличить переносимые дозы бактерий и улучшить терапевтическую эффективность.

Изображение №6
Ученые считают, что одним из возможных вариантов доставки бактерий в область применения является инъекция прямо в опухоль. Этот метод позволяет бороться не только с центральной опухолью, но и ее дистальными частями.
Для оценки этой теории была создана модель внутриопухолевой доставки, показавшая, что индукция EcN iCAP in situ в опухоли увеличивает биодоступность бактерий в кровотоке и облегчает транслокацию бактерий в дистальные опухоли (6а).
На практике это было проверено путем введения неиндуцированного EcN iCAP (то есть без CAP) в опухоль, содержащую опухоли CT26 (6b). Для активации системы iCAP in situ мышей поили водой, содержащей IPTG. Через 3 дня наблюдалось заметное увеличение бактериальной транслокации в дистальные опухоли по сравнению с неиндуцированными бактериями (6с).
Затем ученые проверили работоспособность своей системы на модели ортотопического рака молочной железы (жировой слой молочной железы 4T1) и модели мышей MMTV-PyMT (MMTV — mouse mammary tumor virus, т.е. вирус рака молочной железы мышей).
Последовательно наблюдалось усиление бактериальной транслокации в дистальные опухоли посредством активации iCAP in situ в обеих моделях опухолей (6d—6f). Примечательно, что инъекция EcN iCAP в одну опухоль в модели MMTV-PyMT приводила к микробной транслокации во множественные дистальные опухоли по всему телу после индукции IPTG. Затем была выполнена доставка терапевтических средств к опухолям посредством сконструированного EcN, экспрессирующего полезную нагрузку противоопухолевого ТТ (тета-токсин; 6g).
После инъекции терапевтического EcN в одну опухоль в модели CT26 транслокацию в неинъецированные опухоли контролировали путем кормления мышей водой IPTG или без нее. Другой группе мышей вводили инъекцию EcN iCAP без ТТ в качестве нетерапевтической контрольной группы. iCAP-опосредованная бактериальная транслокация была подтверждена бактериальной биолюминесценцией. Затем производилась подкожная инъекция AHL, чтобы вызвать экспрессию ТТ.
Терапевтическая эффективность в дистальных (неинъецированных) опухолях наблюдалась только тогда, когда мышей кормили водой IPTG с последующей индукцией ТТ посредством подкожной инъекции AHL (6h). Это показывает успешную терапевтическую доставку к дистальным опухолям с использованием метода iCAP-опосредованной бактериальной транслокации. Масса тела подопытных из всех тестовых групп восстановилась до исходного уровня в течение нескольких дней после процедуры.
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых и дополнительные материалы к нему.
Эпилог
В рассмотренном нами сегодня труде ученые продемонстрировали методику маскировки бактерий, которые могут быть использованы для доставки терапевтических веществ внутри организма. Подобная маскировка необходима, так как данные бактерии могут восприниматься иммунной системой как угроза, которую необходимо максимально быстро ликвидировать. Если же увеличивать численность популяции вводимых бактерий, то это может привести к негативным эффектам, несмотря на их первоначальную положительную роль.
Немаловажно и то, что созданная система маскировки может быть деактивирована в определенный момент. Это позволит иммунной системе уничтожить отработанные бактерии, которые уже успели доставить лекарство.
Подобного рода методика может значительно улучшить системы бактериального лечения опухолей, учитывая что доставка препарата может осуществляться не только по области вокруг инъекции, но и в отдаленные участки.
В будущем ученые намерены провести множество опытов, так как существует огромное число вариантов инкапсуляции для одной только E. coli, использованной в данном труде. Кроме того, необходимо будет рассмотреть возможность использования и других микроорганизмов для доставки лекарств. А это означает необходимость в изменении и совершенствовании методики их маскировки.
Немного рекламы
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99, уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5-2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Maincubes Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?


