Что такое ГИ и зачем она нам нужна? Почему бактерии так популярны у генных инженеров? В каком виде проще всего внести нужный ген в бактерию? С какими трудностями можно столкнуться, работая с этими организмами? Что произошло раньше: создание первой генноинженерной бактерии или открытие структуры ДНК и генома? Об этом и многом другом читайте под катом.
0. Краткий ликбез по биологии
В данном пункте приведено краткое описание так называемой Центральной догмы молекулярной биологии. Если вы обладаете базовыми знаниями в молекулярной биологии, то смело переходите к пункту 1.

Центральная догма молекулярной биологии в одной картинке
Итак, начнём. Вся информация о всех стадиях развития и свойствах любого организма, будь то прокариоты (бактерии), археи или эукариоты (все остальные одно- и многоклеточные), закодирована в геномной ДНК, которая представляет собой комплекс двух комплементарных друг другу полинуклиотидных цепей, образующих двойную спираль (комплементарные нуклеотиды ДНК: A-T и G-C). Хромосомы эукариот представляют собой линейные двухцепочечные молекулы ДНК, а хромосомы прокариот закольцованы. Зачастую гены составляют лишь небольшую часть всего генома (у человека — около 1,5%).
Примеры мономеров ДНК и РНК. «Дезокси» в названии ДНК означает отсутствие атома кислорода в положении 2′ (на рисунке положение 2′ обведено красным).
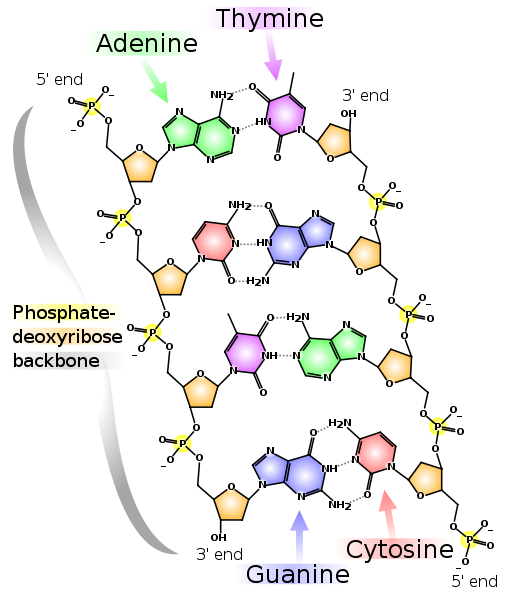
Две комплементарные друг другу цепи ДНК. Пунктирными линиями показаны водородные связи между основаниями. Как видно, аденин и тимин образуют между собой две водородные связи, а гуанин и цитозин — три. Поэтому связь G-C прочнее и GC-богатые участки двухцепочечной ДНК сложнее разделить на две цепочки.
Обратите внимание, что у каждой из цепей обозначены 5′-конец и 3′-конец. Видно, что около 5′-конца левой цепи находится 3′-конец правой и наоборот, поэтому цепи называют «антипараллельными». Также 5′- и 3′-конец есть и у РНК. Сами положения 5′ и 3′ выбраны для обозначения начала и конца потому, что именно через них образуются ковалентные связи в цепочках ДНК и РНК.
Цепочки ДНК и РНК.
Последовательности ДНК и РНК всегда записывают от 5′-конца к 3′-концу. На то есть ряд причин:
- Синтез новых цепочек ДНК и РНК начинается с 5′-конца (ДНК-полимеразы (ферменты, синтезирующие комплементарную цепь ДНК на матрице ДНК или РНК) и РНК-полимеразы (ферменты, синтезирующие комплементарную цепь РНК на матрице ДНК или РНК) идут по матрице в направлении 3′ -> 5′, стало быть новая цепь синтезируется в направлении 5′ -> 3′);
- Рибосома читает кодоны, передвигаясь по мРНК в направлении 5′ -> 3′;
- Последовательность аминокислот записана в кодирующей цепи ДНК в направлении 5′ -> 3′ (значащая часть мРНК представляет собой точную копию участка кодирующей цепи ДНК с заменой тимина на урацил и с гидроксильной группой (-OH) вместо водорода в положении 2′, разумеется);
- Наконец, просто удобно иметь общепринятое правило записи.
Ген — это участок геномной ДНК, задающий последовательность нуклеотидов молекулы РНК:
- Кодирующей РНК: матричной РНК (мРНК), в которой в виде кодонов зашифрована аминокислотная последовательности соответствующего белка. Также можно встретить название «информационная РНК», тогда аббревиатура выглядит как «иРНК»;
- Некодирующей РНК: транспортной РНК, рибосомной РНК и других.
Роль тРНК состоит в доставке к комплексу мРНК-рибосома аминокислот. Кроме того, именно тРНК отвечает за распознавание кодонов мРНК, для этого в состав каждой тРНК входит так называемый «антикодон» — триплет, комплементарный кодону мРНК.
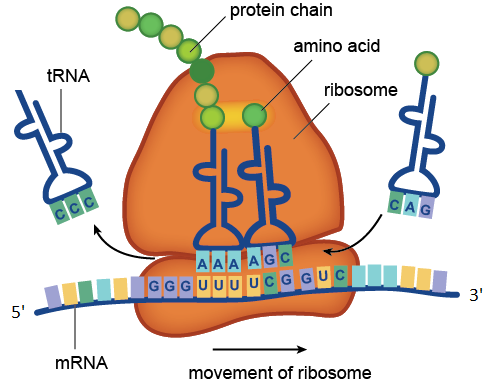
Процесс трансляции, катализируемый рибосомой. На рисунке находящиеся в составе мРНК кодоны UUU и UCG распознаются находящимися в составе молекул тРНК антикодонами AAA и AGC. Транспортная РНК с антикодоном CCC уже отдала свою аминокислоту растущей белковой цепочке, а тРНК с антикодоном CAG ждёт своей очереди. Показанный на рисунке участок молекулы мРНК состоит из четырёх кодонов: GGGUUUUCGGUC. Кодон GGG соответствует аминокислоте глицину, UUU — фенилаланину, UCG — серину, GUC — валину. Значит данный участок мРНК кодирует фрагмент белка с аминокислотной последовательностью глицин-фенилаланин-серин-валин.
Рибосомные РНК — незаменимые компоненты рибосомы. Основной функцией рРНК является обеспечение процесса трансляции: она участвует в считывании информации с мРНК при помощи адапторных молекул тРНК и катализе образования пептидных связей между присоединёнными к тРНК аминокислотами и растущей цепью белка.
Основные типы молекул РНК (на самом деле их куда больше).
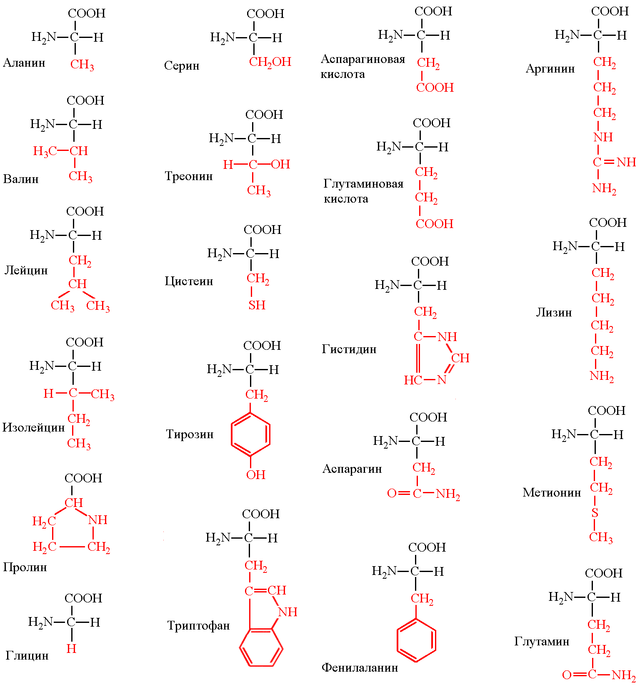
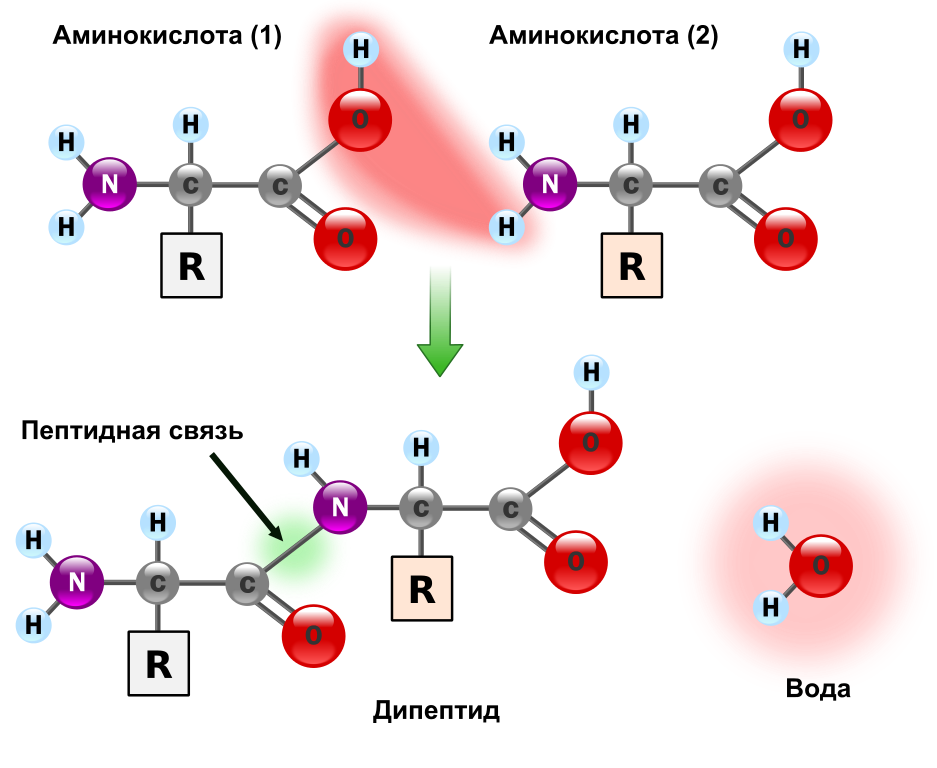
Белок же представляет собой цепочку аминокислот, ковалентно связанных между собой через пептидную связь (про то, что это такое можно посмотреть в спойлере чуть дальше). После синтеза цепь аминокислот должна принять определённую пространственную структуру — «конформацию» (про пространственную структуру белков на Geektimes уже рассказывали до меня). Кроме того, многие крупные белки на самом деле состоят из нескольких белков, объединённых гидрофобными взаимодействиями и водородными связями в единую устойчивую конструкцию. В этом случае каждый из «строительных белков» называют «субъединица», а получившийся крупный белок называют «мультисубъединичным».

Рибосомный комплекс. Картинка взята из публикации OlegKovalevskiy «3D-печать моделей молекул белка».
В случае с генами, кодирующими белок процесс расшифровки генетической информации выглядит так:
- РНК-полимераза узнаёт промотор и связывается с ним (если он «открыт», про регуляцию активности промотора речь пойдёт дальше);
- На матрице ДНК фермент РНК-полимераза по принципу комплиментарности синтезирует «заготовку» матричной РНК (пре-мРНК, у эукариот) или готовую функциональную мРНК (у прокариот). Данный процесс называется «транскрипция»;
- (только у эукариот) Молекула пре-мРНК подвергается модификациям («созревает») и становится функциональной мРНК;
- мРНК распознаётся рибосомой — ферментом, расшифровывающим триплетный код мРНК и на его основе синтезирующим пептид/белок. Аминокислоты, из которых рибосома строит белок доставляются в комплексе с транспортными РНК (тРНК). Данный процесс называется «трансляция»;
- Пептид/белок может подвергаться посттрансляционным модификациям («созревание» по аналогии с мРНК) и становится функциональным. Важным фактором является то, что система посттрансляционной модификации эукариот гораздо сложнее и разнообразнее, нежели у прокариот, поэтому не каждый эукариотический белок может быть правильно синтезирован бактерией.
Кроме кодирующих участков в составе генома есть многочисленные фрагменты, которые также так или иначе участвуют в транскрипции. Участки, расположенные близко к гену и называемые промоторами распознаются РНК-полимеразами (при этом говорят, что ген находится под контролем данного промотора). Разные промоторы узнаются разными РНК-полимеразами. Например, ген под контролем промотора бактериофага не будет транскрибироваться в бактерии, если в ней не синтезируется РНК-полимераза соответствующего бактериофага. Вообще.
Также у каждого гена может быть несколько регуляторных последовательностей, которые могут находиться как непосредственно вблизи промотора (или даже перекрываться с ним), так и на расстоянии десятков тысяч пар нуклеотидов от него. Элементы, усиливающие транскрипцию называются «энхансерами», подавляющие транскрипцию называются «сайленсерами», а взаимодействующие с ними белки называются «факторами транскрипции». Хотя также факторами транскрипции принято называть и необходимые компоненты комплекса инициации транскрипции, без которых транскрипция невозможна в принципе. Дело в том, что только для запуска синтеза молекулы РНК на матрице ДНК у эукариот и архей необходима сборка целого супрамолекулярного комплекса. Простейший подобный комплекс включает в себя холофермент РНК-полимеразу и шесть так называемых «общих факторов транскрипции» (TFIIA, TFIIB, TFIID, TFIIE, TFIIF, и TFIIH). Сам комплекс называется «Transcription preinitiation complex» (видео, каждый компонент комплекса выделен тем или иным цветом).
Прокариотический транскрипционный комплекс устроен совершенно иначе, поэтому нет смысла встраивать в бактерию эукариотический ген вместе с эукариотическим промотором. Прокариотическим аналогом общих факторов транскрипции эукариот и архей можно назвать белок, называемый «сигма фактор».

Прокариотический транскприпционный комплекс. Указанные на рисунке буквы являются общепринятыми обозначениями соответствующих субъединиц. σ70 — сигма фактор генов домашнего хозяйства E. coli
Геномы прокариот и эукариот имеют много общих черт, да и упомянутая ранее Центральная догма молекулярной биологии является справедливой для обоих надцарств. Однако, существует также много существенных отличий. Например, для бактерий типична система оперонов — сгруппированных вместе генов, которые участвуют в одном и том же процессе и транскрибируются не по отдельности, а в составе одной длинной мРНК. У эукариот всё совсем иначе: гены, участвующие в одном процессе разбросаны по разным хромосомам, а сами гены разделены на кодирующие фрагменты «экзоны» некодирующими участками «интронами». При этом сначала ген транскрибируется полностью, а потом, уже на стадии РНК, интроны вырезаются, а экзоны сшиваются с образованием кодирующей мРНК. Данный процесс называется «сплайсинг». При этом в готовую мРНК могут быть вшиты не все доступные экзоны, а только часть из них, в данном случае говорят об «альтернативном сплайсинге». Таким образом, эукариотическая клетка может синтезировать несколько белков, транскрибирую при этом один и тот же ген. Кроме прочего это даёт очень важное следствие: вставлять ген эукариота в бактерию «как он есть в хромосоме» зачастую не имеет смысла, так как бактерия просто не в состоянии производить сплайсинг.
Существует и другое важное отличие. Для прокариот характерно наличие ДНК-ового генетического материала вне кольцевой «хромосомы», так называемых «плазмид» — небольших кольцевых двухцепочечных молекул ДНК. Кроме того, у прокариот нет органоидов, в том числе и ядра: все компоненты бактериальной клетки вольны путешествовать по всему внутриклеточному пространству. У эукариот же нет плазмид, зато есть пластиды и митохондрии, в геном которых плазмиды входят (согласно наиболее обоснованной гипотезе пластиды и митохондрии — это «потомки» имевших прокариотическую архитектуру генома цианобактерий и бактерий, захваченных внутрь себя древними одноклеточными протоэукариотами). При этом для эукариот уже типично наличие ядра и других внутриклеточных компартментов, окружённых собственной мембраной. Поэтому генная инженерия эукариотической клетки требует иных подходов, нежели генная инженерия бактерий.
Сам генетический код устроен следующим образом. Каждый ген/экзон состоит из набора триплетов/кодонов — последовательностей из трёх нуклеотидов, между которыми нет никаких промежутков. Триплетная организация справедлива как для генов в составе ДНК, так и для кодирующей части мРНК. В процессе трансляции транспортные РНК (тРНК), несущие определённую аминокислоту, «узнают» соответствующие им трёхбуквенные триплеты. Рибосома отсоединяет аминокислоту от тРНК и присоединяет её к растущей аминокислотной цепочке, которая по окончанию трансляции либо сразу станет зрелым полнофункциональным белков, либо перед этим дополнительно пройдёт ряд модификаций. При этом каждому триплету соответствует только одна аминокислота, но одной аминокислоте может соответствовать несколько разных кодонов. Оно и понятно, ведь в стандартном генетическом коде насчитывается 61 кодирующий кодон, а протеиногенных аминокислот всего 20 (всего кодонов, конечно, 4*4*4=64, но три из них являются некодирующими, вместо этого они служат сигналом остановки трансляции и называются «стоп-кодонами»).

Кодоны в стандартном генетическом коде. Спасибо википедии за картинку.
Так вот белки — это как раз те самые элементы, которые являются последним звеном цепочки между геномной ДНК и свойствами организма, так называемым «фенотипом». Поэтому для того, чтобы как-то изменить нужную нам характеристику важного для нас организма нам нужно таким образом изменить его ДНК, чтобы в итоге в его клетках появились определённые белки, которые и обеспечат нам целевой результат. В этом заключается основная идея всей генной инженерии.
1) Для каких целей используются бактерии в генной инженерии и почему именно они
Итак, мы разобрались с тем, как и почему последовательность геномной ДНК влияет на свойства и характеристики организма. Разумеется, будет очень хорошо, если признак полностью определяется всего одним геном — встройка небольшого фрагмента уже давно не является серьёзной проблемой. Например, часто устойчивость растения к гербициду или вредителю определяется одним геном, поэтому создание сортов с нужной резистентностью в таких случаях не составляет труда (в отличие от вывода такого растения на рынок). То же самое справедливо и для многих резистентностей бактерий к антибиотикам (на самом деле у бактерий много защитных механизмов против антибиотиков, но они работают в независимом друг от друга ключе). Противоположным примером является, например, попытка учёных научить растения усваивать азот из атмосферы. Дело в том, что единственным источником азота для растений является почва, в которой подходящие для усвоения растением азотсодержащие соединения синтезируются микроорганизмами (либо внесены в виде удобрений заботливым садоводом или проходившей мимо собачкой). Очевидно, что создание растения с альтернативным механизмом питания было бы весьма полезным для сельского хозяйства. Но, к сожалению, данный процесс настолько сложен, что проблему его «переноса» из микроорганизма в растение не удалось решить до сих пор.
Наконец, если нашей целью является получение белка для каких-то конкретных целей (исследование структуры и функций белка, создание медицинских препаратов или лабораторных реактивов на его основе, etc.) то нас, очевидно, также вполне устраивает встраивание одного единственного гена в клетку, которую в данном случае принято называть «организм-продуцент».
Бактерия в генной инженерии — это потенциальный исходный материал для создания:
- продуцента нужного нам белка в лабораторных или промышленных масштабах;
- активного агента в неком химическом превращении одного соединения в другое, будь то процесс брожения в пищевой промышленности, создание более благоприятных условий для роста растений за счёт внедрения «бактериального производителя удобрений» в почву или утилизация стального лома;
- клонотек генов (тема, хорошее описание которой увеличит размеры статьи до неприличных);
- медицински значимого препарата, например, для восстановления микрофлоры ЖКТ.
*что-то мог забыть, так что дополнения в комментариях приветствуются.
Интересным является тот факт, что первые успешные опыты в области генной инженерии бактерий произошли задолго до эпохальной работы Уотсона и Крика. Более того, на основании этих опытов был доказан сам факт того, что информация содержится именно в ДНК, после чего учёные могли не тратить своё время на гипотезы об РНК и белке.
Данная работа, проведённая в 1944 году, известна, как Эксперимент Эвери, Маклеода и Маккарти, основой для которого послужила работа Фредерика Гриффита, в ходе которой было установлено, что заражение убитым патогенным и живым непатогенным штаммами пневмококка вызывает развитие болезни, в том время как по отдельности они не вызывают значительных симптомов. Из данного эксперимента был сделан вывод, что убитая бактерия способна что-то передать непатогенной «коллеге», в результате чего та становится опасной. Но что они передают друг другу? К 1944 году было три основных кандидата: ДНК, РНК и белок. Для того, чтобы установить переносчик был проведён элегантный эксперимент: в то время уже были доступны ферменты, способные разрушать отдельно ДНК (ДНКаза), отдельно РНК (РНКаза) и отдельно белки (протеиназа). Было показано, что передача патогенных свойств не происходила только в тех случаях, когда препарат мёртвого патогенного штамма был обработан ДНКазой и при этом не зависела от обработки препарата РНКазой и протеиназой.
Таким образом, было доказано, что носителем информации о признаках является именно ДНК. Кроме того, было наглядно показано, что возможно самопроизвольное проникновение инородной молекулы ДНК в бактериальную клетку.
Почему бактерии так популярны при очевидных недостатках (например, отсутствие эукариотических посттрансляционных модификаций)? Всё просто. Они неприхотливы в работе, просты в использовании и не требуют дорогих питательных сред.
2) Как создаётся генетическая конструкция, которую внедряют в бактерию
Современная генная инженерия бактерий в основном представляет собой внедрение плазмидного вектора (модифицированной бактериальной плазмиды, содержащей целевой ген и набор других необходимых элементов, о которых речь пойдёт ниже). Изменение хромосомы бактерии менее типично, но эта процедура также не является чем-то диковинным: например, ген РНК-полимеразы бактериофага Т7 был введёт в хромосому кишечной палочки с помощью вектора на основе профага λ в процессе создания одного из популярных в лабораторной плактике штаммов. Причин, по которым зачастую исследователь выберет внедрение гена в составе плазмидного вектора две:
- во-первых, внедрить плазмидный вектор в бактерию дешевле, чем встроить что-то в хромосому;
- во-вторых, методология обеспечения стабильности и наследования плазмидного вектора в бактериальной клетке, а также сама процедура создания нужной генетической конструкции хорошо отработана и проста в исполнении;
- в-третьих, с плазмидными векторами всё и так прекрасно работает.
Типичный плазмидный вектор для работы с бактериями представляет собой небольшую кольцевую двухцепочечную молекулу ДНК, несущую ген целевого белка под контролем определённого промотора и ряд необходимых генов и регуляторных элементов, присутствие которых обеспечивает постоянное количество плазмиды в клетке («контроль копийности»). Очевидно, что даже в случае сверхэффективного синтеза мРНК от вектора мало толку, если он существует в бактерии в количестве пары штук: в процессе деления банально будет высока вероятность образования дочерней клетки без нужной плазмиды.
Кроме гена и промотора основными элементами плазмидного вектора являются:
- ori — область начала репликации плазмиды. Нужна для поддержания постоянного количества плазмиды и её наследования дочерними клетками;
- маркерный ген — ген, придающий бактерии, несущей плазмидный вектор определённое свойство, позволяющее отличать её от немодифицированной бактерии. Чаще всего в качестве маркера используется резистентность к антибиотику, тогда трансформированная клетка способна жить и делиться на среде, содержащей антибиотик («селективная среда»). Кроме того, наличие антибиотика в питательной среде позволяет защитить клеточную культуру от заражения нежелательными организмами, которые могут случайно проникнуть в питательную среду. Часто в работе хватает одного гена резистентности, но вполне типичным является использование и двух генов резистентности сразу.
Другим примером может служить, использование гена β-глюкуронидазы (GUS). Данный фермент превращает определённые соединения в окрашенные или флуоресцирующие, что может быть обнаружено визуально по окрашенности колонии. Естественно, данные соединения нужно добавлять в питательную селективную среду. Ещё один пример — использование гена зелёного флуоресцентного белка (GFP) (хотя использование GUS и GFP более типично для работ с клетками растений и животных);
- участок, отвечающий за контроль копийности (мало плазмид в клетке — плохо, много — тоже плохо);
- полилинкер — нуклеотидная последовательность, содержащая несколько уникальных перекрывающихся сайтов узнавания эндонуклеаз рестрикции (разрезают двухцепочечную ДНК в определённом месте). Полилинкер нужен для того, чтобы встраивать целевой ген в «пустой» вектор.
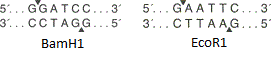
На рисунке представлены сайты рестрикции эндонуклеазами BamH1 и EcoR1. Оба фермента узнают определённый участок из шести пар оснований и вносят одноцепочечные разрывы в разных местах (на рисунке обозначены стрелками-треугольниками). В данном случае места разрыва цепей не совпадают, значит образуются «липкие концы» (если совпадают, то образуются «тупые концы»).
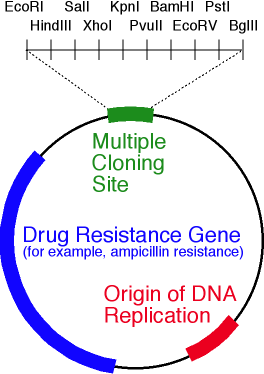
Упрощённая схема плазмидного вектора. На рисунке обозначены ori, ген резистентности к антибиотику и полилинкер, содержащий 10 сайтов рестрикции эндонуклеазами.
Что ж, вектор у нас на руках. Как в него встроить ген? И вообще, где этот ген взять?
Допустим, что мы знаем последовательность нуклеотидов нужного нам гена. Тогда поступают следующим образом:
- Химически синтезировать короткие одноцепочечные полинуклеотиды таким образом, чтобы они частично перекрывались;
- Объединить эти фрагменты с помощью ПЦР.
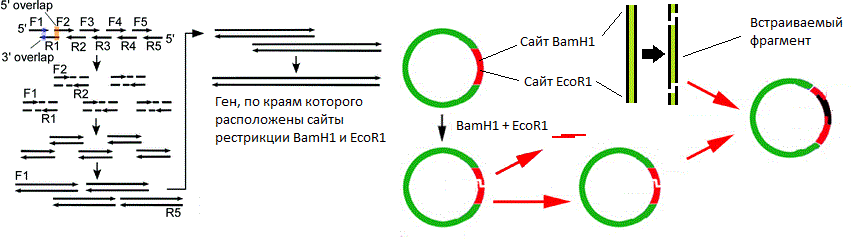
Слева изображён процесс сборки гена методом перекрывающихся праймеров (более подробно процедура описана в спойлере ниже). Справа изображён процесс вставки гена в вектор.
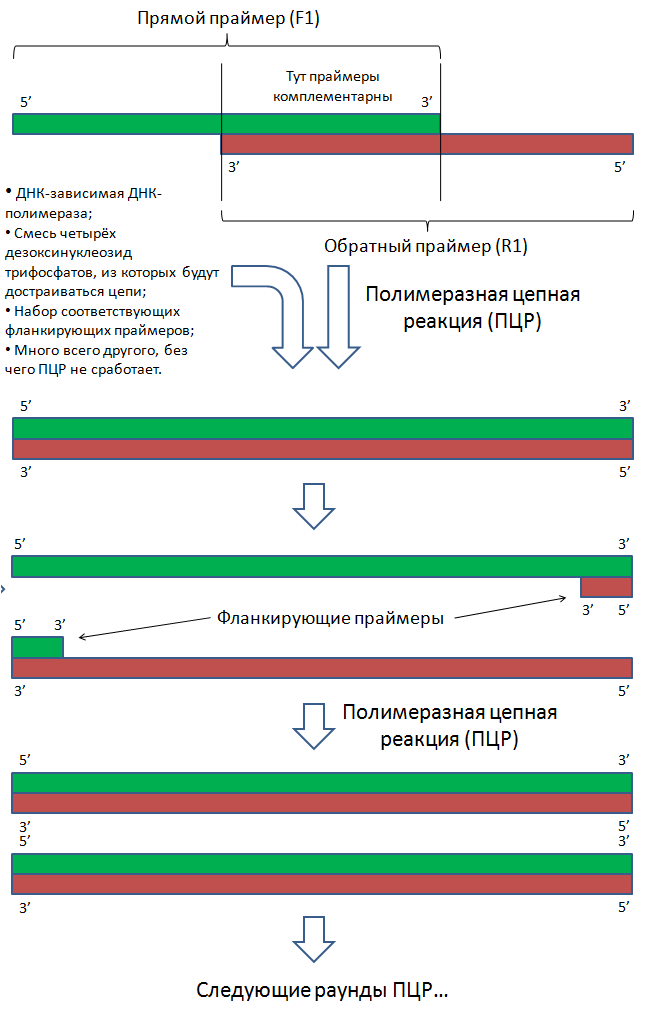
Перекрывающиеся праймеры синтезированы таким образом, что после сборки образуется полноразмерный ген, по бокам которого расположены сайты разрезания теми же эндонуклеазами, сайты которых расположены в полилинкере вектора. Таким образом, если обработать нужными эндонуклеазами (в моём примере это ферменты BamH1 и EcoR1) вектор и собранный ген, то на них образуются липкие концы, которые могут «узнать друг друга» за счёт комплементарных взаимодействий нуклеотидов липких концов. Но одного узнавания мало, так как пока что липкие концы держаться друг за друга исключительно за счёт непрочных водородных связей. Эта проблема решается за счёт добавления в реакционную смесь одновременно разрезанного вектора, разрезанного гена и фермента ДНК-лигазы, который устраняет разрывы цепей в двухцепочечных молекулах ДНК.
Также важным фактором при сборке гена является тот факт, что частоты тех или иных кодонов у разных организмов различны, при этом в клетках как правило больше тех тРНК, которые соответствуют более «популярным» кодонам. Поскольку многие аминокислоты кодируются несколькими кодонами, то велика вероятность того, что бездумно скопировав ген из одного организма в другой мы рискуем получить сильную задержку процесса трансляции. Действительно, если в новом организме многие кодоны этого гена редки, то рибосома будет дольше «ждать» когда же наконец приплывёт нужная тРНК.
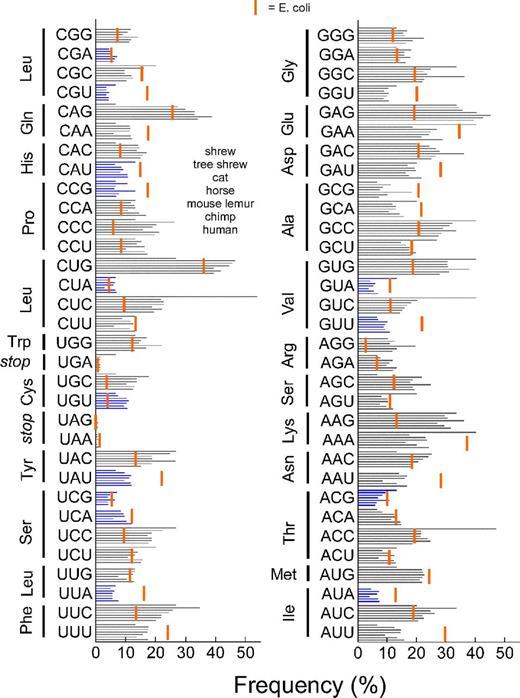
На рисунке синими полосками показаны частоты кодонов у землеройки, тупайи, домашней кошки, лошади, мышиного лемура, шимпанзе и человека. Красной полосой отмечена частота кодонов у кишечной палочки E. coli.
Теперь несколько слов о промоторе. Выбор подходящего промотора очень важен, так как процесс транскрипции во многом зависит от него. Промоторы условно делят на сильные, средней силы и слабые. «Сила» промотора определяется тем, насколько активно транскрибируются гены под его контролем при прочих равных: чем активнее транскрипция, тем сильнее промотор. Очевидно, что когда мы хотим создать продуцент белка, то начинать следует с сильных промоторов. В некоторых случаях чрезмерно быстрая транскрипция (следовательно, и активная трансляция) наносит вред клетке, в таком случае можно попробовать использовать более слабый промотор. Хотя на деле повлиять на активность транскрипции уже имеющегося продуцента куда проще, чем создавать новый.
Важно другое. Зачастую кодируемые вектором белки оказывают крайне негативное влияние на жизнеспособность бактерии. Мало того, что синтез этих белков забирает на себя большое количество ресурсов (а количество целевого белка по хорошему должно быть не ниже 10% от общей сухой массы клетки), так они к тому же мёртвым грузом плавают туда-сюда по цитоплазме! Поэтому до поры до времени лучше экспрессию чужеродного для клетки гена вообще выключить. С этой целью были разработаны контролируемые экспрессионные системы, позволяющие «включать» экспрессию нужного нам гена «по команде». Наиболее распространены:
- Система на основе регуляторных элементов лактозного оперона E. coli (lac-оперона) и сильного промотора.
Дело в том, что у кишечной палочки есть свои правила питания. Во-первых, существует механизм подавления активности lac-оперона, который включён только тогда, когда в клетку не поступает лактоза. Это логично: зачем тратить силы на синтез того, что не пригодится? Но как только лактоза начинает поступать в клетку в достаточном количестве этот механизм выключается. Однако, есть второй механизм подавления активности lac-оперона. Если в среде есть глюкоза, то клетка питается исключительно глюкозой, так как она активирует второй механизм ингибирования транскрипции lac-оперона. Таким образом, lac-оперон активен только тогда, когда в окружающем клетку пространстве есть только лактоза. Минусом лактозного оперона является крайне слабый промотор, поэтому в штаммах продуцентах он заменён на сильный. Сильные промоторы часто получают из патогенов. Наиболее широко используемые в генной инженерии прокариот сильные промоторы выделены из бактериальных вирусов — бактериофагов. Например, широко используется промотор фага Т7.
К слову, некоторые сильные промоторы для генной инженерии растений также выделены из вирусов, например, это промотор вируса мозаики цветной капусты.

Как было указано выше, у E. coli нет РНК-полимеразы, которая бы узнавала промоторы бактериофагов, поэтому предварительно в продуцент встраивают ген РНК-полимеразы соответствующего бактериофага.Популярная система синтеза белка на основе E. coli несёт ген РНК-полимеразы фага Т7 под контролем промотора бактериальной РНК-полимеразы, регулируемый по механизму lac-оперона. Если данный штамм трансформировать вектором, несущим целевой ген под контролем комплекса «промотор фага Т7 + регуляция промотора по типа lac-оперона», то возникнет двухуровневый механизм ингибирования транскрипции целевого гена.
При использовании такой конструкции в питательную среду добавляют одновременно глюкозу и лактозу. В течение некоторого времени клетки будут питаться глюкозой и спокойно делится, так как синтез чужеродного белка полностью подавлен. К тому моменту, когда закончится глюкоза и клетки перейдут на метаболизм лактозы в культуре будет уже достаточно биомассы, как раз самое время начинать синтез нужного нам белка. Такая процедура называется «автоиндукция».
Можно поступить и по-другому: вообще не добавлять в питательную среду глюкозу и лактозу, а потом, когда культура дорастёт до нужной плотности, добавить то, что клетка примет за лактозу, но не сможет метаболизировать или разрушить. Сейчас в качестве такого индуктора используют ИПТГ.
- Система на основе регуляторного механизма промотора pL бактериофага λ
Данный промотор инактивируется белком-репрессором cI. При этом была обнаружена термочувствительная форма этого белка, названная cI857: данный фактор транскрипции сохраняет функциональность при температуре около 30⁰С и теряет её при 42⁰С. Поэтому при использовании такой системы сначала бактериальную культуру растят до нужной плотности при 30⁰С, а затем поднимают температуру до 42⁰С, тем самым запуская синтез целевого белка.
Ну что же, вектор разработан. Дальше дело за малым — найти подходящий метод для его внесения в бактериальную клетку. Но это уже совсем другая история.
Источник
![[Из песочницы] Генная инженерия бактерий: с чего всё начиналось и как это работает в лаборатории сегодня [Из песочницы] Генная инженерия бактерий: с чего всё начиналось и как это работает в лаборатории сегодня](https://habrastorage.org/files/205/c3c/017/205c3c017a5d4117acbfa050382bae16.jpg)


