
Итак, у нас на руках есть плазмидный вектор и есть подходящий для данного вектора штамм бактерии, осталось внести вектор в бактерию.
В предыдущей статье упоминалась работа Фредерика Гриффита, которая наглядно демонстрирует тот факт, что ДНК может самопроизвольно проникать в бактериальные клетки. Способность бактериальной клетки поглотить находящуюся в окружающей среде молекулу ДНК называется «компетентность» (что рождает большой простор для шуток на тему того, что даже одноклеточные в пробирке компетентны, а твой коллега по лаборатории нет). Если поглощение происходит не под влиянием каких-то искусственно созданных условий, то мы говорим о «естественной компетентности». Как происходит подобный транспорт ДНК внутрь бактерии?
1) Строение клеточной оболочки бактерий
Для начала рассмотрим вкратце строение оболочки грамположительных и грамотрицательных бактерий.
Оболочка грамотрицательной бактерии состоит из двух липидных бислоёв: внешней мембраны и внутренней мембраны (внутреннюю ещё называют плазматической). Между ними находится периплазматическое пространство, заполненное выполняющими важные функции белками и пептидогликаном.
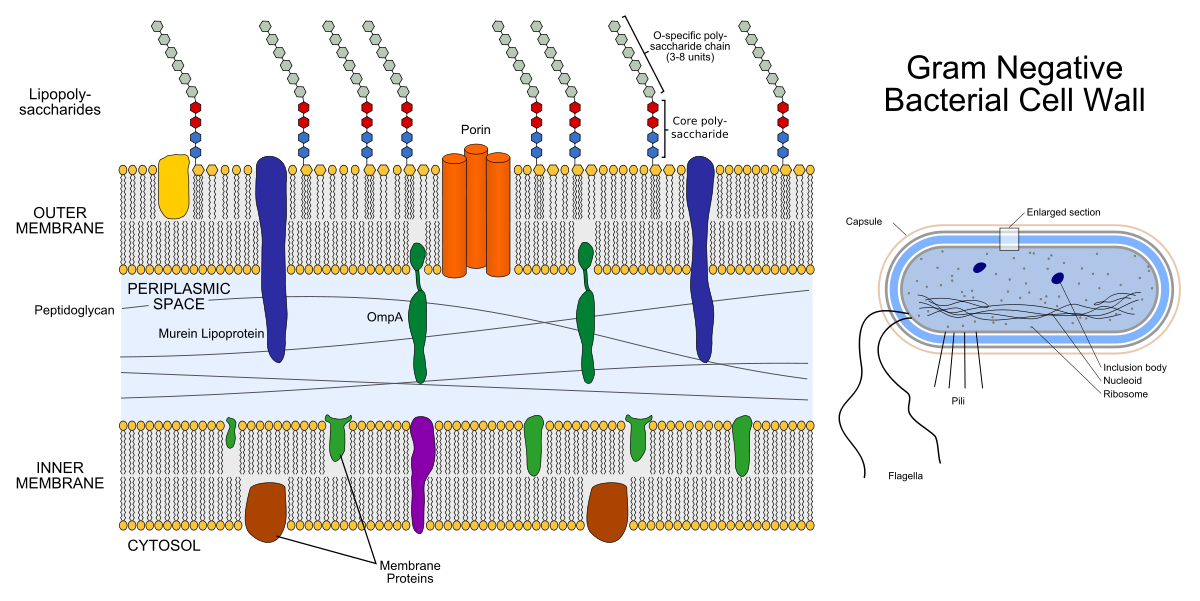
Слева — строение оболочки грамотрицательной бактерии. Цветные штуковины внутри мембран это мембранные белки, а торчащие наружу цепочки — липополисахариды. Справа — строение самой грамотрицательной бактерии.
Пептидогликан — это гетерополимер, состоящий из ковалентно сшитых N-ацетилглюкозамина (NAG) и N-ацетилмурамовой кислоты (NAM). Получается цепочка ….-NAG-NAM-NAG-NAM-NAG-…. «Гетеро» в слове «гетерополимер» означает, что полимер состоит не из одних и тех же элементов (как полиэтилен), а из двух разных. Синтезирующий пептидогликан фермент транспептидаза является мишенью для β-лактамных антибиотиков (пенициллиновые антибиотики и цефалоспорин): они подавляют его активность, в результате в процессе деления бактерии не образуется достаточного для обеих дочерних клеток количества пептидогликана. Также пептидогликановый слой является мишенью для фермента лизоцима: он разрушает ковалентную связь между NAG и NAM. В медицине лизоцим используется в качестве антисептика, например, он является активным компонентом некоторых препаратов для лечения больного горла, а в пищевой промышленности его могут использовать в качестве консерванта (пищевая добавка E1105 — это и есть лизоцим).

Пептидогликан. На рисунке изображена часть, соответствующая одному NAG (он слева) и одной NAM (она справа), которые соединены между собой через атом кислорода. (Для тех, кто не любит такие вольности в химии: эта «связь через атом кислорода» называется β-(1,4)-гликозидной).
Оболочка грамположительных бактерий состоит только из внутренней (плазматической) мембраны, очень тонкого периплазматического пространства и внешнего, более толстого, чем у грамотрицательных бактерий слоя пептидогликана.
Подобные препятствия, стоящие на пути любого соединения в бактериальную цитоплазму являются непреодолимыми для всего, кроме воды, а также небольших неполярных и гидрофобных молекул (молекулярные кислород и азот, углекислый газ и другие). Проникновение данных соединений через оболочку называется «пассивный транспорт» («простая диффузия»), он всегда происходит по градиенту концентрации. Неполярные молекулы способны свободно проходить через мембраны потому, что внутренний объём мембран также неполярен (внутри мембраны состоят из гидрофобных остатков жирных кислот), а неполярные соединения хорошо растворяется в неполярных растворителях (спирт, ацетон, жирные кислоты).
Шуточная картинка, на которой обыгрывается гидрофобность (водобоязнь) остатков жирных кислот, находящихся внутри двухслойной мембраны.
В свою очередь крупные полярные молекулы (аминокислоты, моносахариды, нуклеотиды), заряженные частицы (ионы) и макромолекулы (ДНК, белки) проникнуть через клеточную оболочку просто так не могут, так как они хорошо растворимы только в полярных растворителях (например, в воде). Тогда как молекулы ДНК попадают внутрь бактериальной клетки?
2) Механизмы индуцированного транспорта соединений в клетки из внешней среды
Прежде всего у нас на руках есть очевидный факт, что бактерия не может прожить только на воде, кислороде и углекислом газе, для жизнедеятельности ей нужны многие другие соединения. Значит есть и способы доставки этих соединений внутрь клетки. Такими способами являются «облегчённая диффузия» и «активный транспорт».
2.1) Облегчённая диффузия
Примером облегчённой диффузии (хотя этот конкретный случай наоборот для бактерии вреден) является транспорт ионов калия через оболочку бактериальной клетки в комплексе с валиномицином — антибиотиком, который синтезируется некоторыми грибами. Свободный валиномицин не может проникнуть внутрь клетки, так как у него наружу экспонированы полярные группы. Иону калия также «путь закрыт».

Скульптура, изображающая трёхмерную структуру комплекса валиномицина и иона калия (ион изображён в виде шара в центре). Установлена перед входом в Институт биоорганической химии РАН имени М. М. Шемякина и Ю. А. Овчинникова (Москва), в котором был установлен механизм антибактериальной активности валиномицина и трёхмерная структура его комплекса с ионом калия.
Зато после образования комплекса валиномицина с ионом калия он изменяет свою трёхмерную структуру таким образом, что вся его внешняя поверхность становится гидрофобной (неполярной), а все гидрофильные группы спрятаны внутри. Ион калия при этом спрятан внутри молекулы валиномицина, поэтому комплекс «валиномицин+ион калия» может проникнуть через мембрану. Комплекс может распасться на свободный валиномицин и ион в любой момент как внутри клетки, так и снаружи, но в целом облегчённая диффузия ионов приводит к уравниванию их концентрации как во внутриклеточном, так и во внеклеточном пространстве, а клетка неспроста контролирует транспорт ионов: высокая их концентрация губительна. Именно на этом и основан антибактериальный эффект валиномицина.
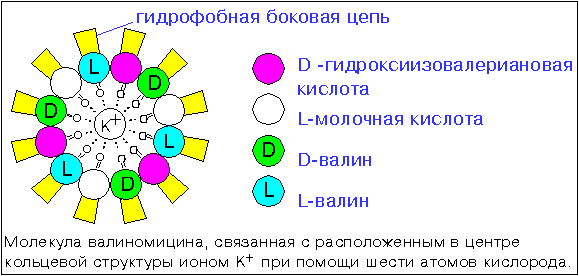
Схематичное изображение грибкового антибиотика валиномицина, образовавшего комплекс с ионом калия.
Другим примером могут служить неконтролируемые поры, которые представляют собой большие трансмембранные белки, позволяющие определённым веществам беспрепятственно проходить через мембрану согласно градиенту. Примером такой трансмембранной поры может служить α-токсин золотистого стафилококка Staphylococcus aureus (другое название токсина: α-гемолизин. Оно состоит из частей «гемо» и «лизин». «Гемо» — значит мишенью токсина являются клетки крови эритроциты; «лизин» — от слова «лизис», то есть «клеточная смерть»)
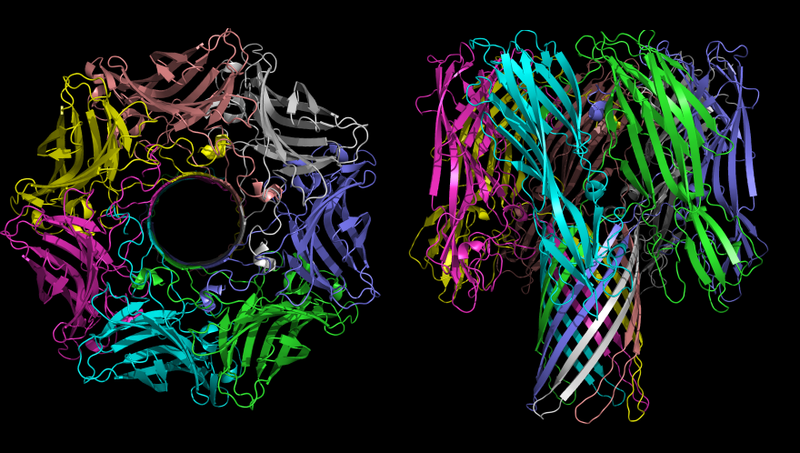
Трёхмерная структура олигомера α-гемолизина — токсина бактерии Staphylococcus aureus. На рисунке слева хорошо видна пора.
Основной функцией α-гемолизина в патогенном процессе является создание некотролируемых каналов в мембране клетки, которые в зависимости от окружающих условий могут пропускать моновалентные ионы, ионы кальция или АТФ. Как было указано выше, ионный дисбаланс крайне токсичен, а транспорт АТФ из клетки является вредным, так как АТФ — это незаменимое звеном почти всех химических процессов любой клетки.
2.2) Активный транспорт
Как видно из приведённых выше примеров, облегчённая диффузия не требует затрат энергии. Напротив, активный транспорт — это поглощение или выделение чего-либо клеткой с затратой энергии на каждый акт переноса. Это может быть транспорт крупных полярных молекул или ионов, причём транспорт ионов может осуществляться как по градиенту концентрации, так и против него. Разумеется, активный транспорт — это контролируемый процесс, в котором участвует целый набор внутриклеточных и трансмембранных белков. Таким образом, сначала клетке нужно затратить ресурсы на то, чтобы синтезировать все эти белки, а затем ещё раз затратить энергию на использование этой транспортной системы.
Примером активного транспорта может служить система энергозависимого транспорта гидрофобных и амфифильных соединений из клетки обратно в окружающую среду (эффлюкс).

Система активного транспорта антибиотика из бактериальной клетки наружу, состоящая из трёх белков, образующих единый трансмембранный комплекс. На рисунке отражён тот факт, что белок efflux transporter (фиолетовый) может «ловить» молекулы лекарств как непосредственно в цитоплазме, так и в мембране.
Эта система представляет особый интерес потому, что она является причиной мультирезистентности некоторых бактерий к антибиотикам: клетка избавляется от них до того, как они смогут ей серьёзно навредить. При этом более половины случаев мультирезистентности синегнойной палочки Pseduomonas aeruginosa связанны именно с активным транспортом антибиотиков. Что ещё более важно, уже обнаружены системы активного эффлюкса «новых» антибиотиков, которые применяются против бактерий, резистентных к широко используемым антибактериальным препаратам. Например, используемый при неэффективности классических антибиотиков препарат Линезолид выбрасывается обратно системой эффлюкса на основе белков AcrAB и TolC. Интересен ещё и тот факт, что умная бактерия не тратит силы на крупномасштабный синтез белков системы эффлюкса в тех ситуациях, когда они не нужны. Но как только появляются вредные для клетки вещества синтез стремительно активизируется и бактерия начинает активно сопротивляться. К слову, эффлюкс это не единственный механизм защиты бактерий от антибиотиков, про остальные способы я тоже как-нибудь напишу статью.
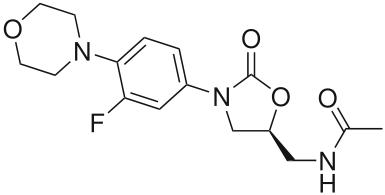
Структура линезолида — антибиотика, применяемого против устойчивых штаммов грамположительных бактерий.
3) Компетентность бактериальных клеток
Итак, мы рассмотрели механизмы трансмембранного транспорта соединений, которые не могут проникнуть через этот барьер без посторонней помощи. В естественных условиях транспорт ДНК в бактерию осуществляется только посредством активного транспорта за счёт кооперации целого спектра как внутриклеточных, так и трансмембранных белков. Неиндуцированная способность клетки поглощать ДНК извне называется «естественной компетентностью».
3.1) Естественная компетентность бактериальных клеток
Наиболее обоснованной гипотезой возникновения естественной компетентности бактерий является предположение, согласно которому данный механизм позволяет бактериям выживать в экстремальных для них условиях (экстремальные для клетки условия называют «стресс»). Дело в том, что стресс зачастую приводит к повреждениям «хромосомной» ДНК бактерии и если клетка хочет выжить, то ей нужно как-то «ремонтировать» свою «хромосому» (такой «ремонт» называется «репарация»). При этом известно, что если ввести в клетку последовательность ДНК, схожую с некоторым участком собственной ДНК клетки, то она с высокой вероятностью встроит этот «новый» кусок в свой геном. Что происходит при стрессовых условиях? Какие-то клетки гибнут, становясь донорами ДНК для тех своих собратьев, которые ещё борются за жизнь. Действительно, в пределах одной бактериальной культуры очень велика вероятность того, что геномы представителей очень схожи, поэтому выжившие бактерии могут использовать ДНК погибших сородичей для репарации своего генома.
При этом в комфортных условиях в культуре клеток лишь часть из них обладает естественной компетентностью, а доля компетентных клеток от общего их числа является наибольшей тогда, тогда культура находится в определённой фазе роста — log-фазе.

Типичный график зависимости количества бактерий в культуре от времени. Log-фаза — это фаза роста, за которой следует выход на плато и стадия угасания, на которой клеткам уже не хватает питательных веществ и накапливаются токсины.
Конечно, исследователю хотелось бы сделать процесс переноса плазмидного вектора внутрь клетки как можно более эффективным: чем эффективнее процесс трансформации, тем меньше нужно плазмидного вектора для того, чтобы гарантировать хорошие результаты. Поэтому в лабораторных условиях обычно не надеются на саму клетку, а вместо этого создают клетки с искусственной компетентностью.
3.2) Искусственная компетентность бактериальных клеток
Существует два основных метода создания искусственной компетентности бактерий: обработка клеточной культуры двухвалентными ионами с последующим кратковременным нагреванием и так называемая электропорация.
3.2.1) Обработка клеточной культуры двухвалентными ионами с последующим кратковременным нагреванием.
Как правило в лаборатории есть холодильник с температурой около -80 градусов по Цельсию (иногда их у нас по аналогии с «ксероксами» называют «кельвинаторами» в честь одной из фирм-производителей), забитый пробирками с клетками, находящимися в log-фазе. Это сделано для того, чтобы не тратить время на их создание каждый раз, когда они необходимы (а времени это занимает довольно много, быстрее, чем за сутки их сделать не получится). А чтобы во время хранения клетки не погибли из-за заморозки в среду добавляют криопротекторы: глицерол, пропиленгликоль или диметилсульфоксид.
Лабораторный холодильник в представлении автора рисунка.
Когда исследователю нужно трансформировать определённый штамм он достаёт клетки из кельвинатора и помещает пробирку в лёд. Затем к находящимся в log-фазе роста клеткам добавляют двухвалентные катионы и нужный нам плазмидный вектор. Пробирка при этом не должна покидать лёд. Типичным донором таких катионов выступает хлорид кальция (CaCl2), в данном случае нашим двухвалентным катионом является Ca2+. Однозначного объяснения того, как Ca2+ помогает ДНК проникать внутрь бактерии нет:
- Некоторые источники утверждают, что высокие концентрации Ca2+ служат причиной образования брешей в оболочке клетки и повреждений ДНК, а ранее мы установили, что повреждение ДНК это сигнал для клетки переходить в компетентное состояние;
- По другим источникам данные ионы служат «мостиком», который прикрепляет плазмидный вектор к клетке. Дело в том, что положительно заряженные ионы присоединяются одновременно и к отрицательно заряженным группам полисахаридов на внешней мембране бактерий, и к отрицательно заряженным группам плазмидной ДНК. Если бы в среде не было ионов, то ДНК бы отталкивалась от клетки, а исследователю это совершенно ни к чему.
Вполне возможно, что обе гипотезы верны.
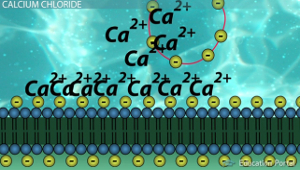
Предполагаемый механизм участия ионов Ca2+ при трансформации. Сначала ионы присоединяются к отрицательно заряженным группам ДНК (жёлтые круги) и заякоренных в мембране полисахаридов (жёлтые круги). Затем за счёт иона образуется своего рода мостик «полисахарид(-)» — «ион Ca(2+)» — «ДНК(-)», который закрепляет ДНК на поверхности клетки.
После инкубации бактерий при околонулевой температуре производится так называемый тепловой шок (heat shock) — кратковременное нагревание культуры до 42 градусов. Обычно продолжительности температурной обработки составляет 30-45 секунд, после чего пробирка с бактериями возвращается в ледяную баню (при более продолжительном тепловом шоке клетки могут погибнуть). Возможными причинами эффективности теплового шока являются те же механизмы: высокая температура может нанести повреждения ДНК и белкам (это индуцирует компетентность), а также может создать «пробоины» в оболочке клетки, через которые внутрь проникнут прикреплённые к мембране через ионы кальция плазмидные векторы.
Затем клетки высевают на чашки Петри с селективной средой и на них вырастают колонии.
3.2.2) Электропорация
Основой метода электропорации является тот факт, что электрическое поле может повредить клеточную оболочку. То есть дословно электропорация — это создание пор электрическим полем.
Сначала в специальную пробирку (кювету) помещают бактерии и плазмидный вектор. Затем кювету ставят в специальное устройство, которое на долю секунды создаёт разность потенциалов 0,1-10 кВ, что в свою очередь приводит к обратимому повреждению мембран и векторы могут свободно проникнуть в клетки. Через некоторое время бактериальную культуру высевают на чашки Петри с селективной средой.
Важным требованием к жидкой среде, в которой находятся клетки и вектор в момент электропорации является низкая концентрация ионов: в противном случае возможно короткое замыкание.
Послесловие
Каждая колония на чашке — это размножившиеся потомки одной единственной бактерии. После того, как на чашках появятся колонии исследователь выбирает одну из колоний и переносит клетки из колонии в новую селективную жидкую питательную среду. После того, как новая клеточная культура «подрастёт» её опять высаживают на новую чашку с той же самой селективной питательной средой. В итоге мы получаем чашку, на которой растут только потомки бактерий из одной единственной колонии (то есть по сути все они являются клонами одной единственной бактерии). И только эти клетки уже будут использоваться в дальнейшем для получения нужного нам белка в больших объёмах жидкой селективной питательной среды.
Ну что же, подведём промежуточные итоги:
- Мы синтезировали нужный нам ген;
- Вставили его в подходящий плазмидный вектор;
- Выбрали подходящий штамм-продуцент и произвели его трансформацию;
- Получили культуру клонов;
- Наконец, мы перенесли часть этих клонов в большой объём питательной среды с целью получить нужный нам белок в большом объёме.
Следующий шаг: выделить белок из полученной биомассы в настолько чистом виде, насколько это вообще возможно. Но это уже совсем другая история.
Источник


