
Именно строение кристаллов дало учёным возможность впервые заглянуть в мир атомов в 1910-х годах. Тогда Уильям и Лоуренс Брэгг, отец и сын, разработали рентгеновскую кристаллографию. Пропуская рентгеновский луч через кристалл (пользуясь тем, что длина волны рентгеновского излучения мала – сравнима с расстоянием между слоями атомов) Брэгги смогли увидеть внутреннюю структуру алмаза.
На фото: кристалл сульфата меди, снятый на макрообъектив.
Чтобы получить изображения для своей коллекции из 300 фотографий, изданных в виде книги The Beauty of Chemistry [«Красота химии»], Вэньтин Чжу и Янь Лян использовали инфракрасную фотографию, высокоскоростные фотоаппараты и технику микрофотографии. И всё это – с целью погрузить читателей в микроскопический мир молекул и потрясающих реакций, происходящих между ними. Автор научно-популярных текстов Филипп Болл комментирует происходящее на фотографиях, проводя тур по окружающей нас недооценённой красоте. Он описывает как принципы, создающие уникальную симметрию снежинок, так и механизмы, объединяющие очень похожие на живые усики силикатных солей с происхождением самой жизни.
 Вероятно, самой простой и удивительной из этих концепций служит водородная связь, скрепляющая элементы такой жизненно важной субстанции, как вода. Каждая молекула воды состоит из двух атомов водорода, соединённых с атомом кислорода, но у кислорода на внешней оболочке расположено шесть электронов. Для формирования химической связи с водородом требуется всего два электрона, поэтому четыре электрона с отрицательным зарядом, группирующиеся по два, висят там в своём микропространстве, надеясь как-то сбалансировать свой заряд. Эти пары оказывают слабое воздействие на атомы водорода, присутствующие в соседних молекулах воды, формируя длящиеся всего одну триллионную долю секунды кратковременные связи, а потом снова отрываются от них и связываются с другим атомом водорода. Этот непрекращающийся танец порождает химическое движения, делающее возможным жизнь, Болл называет «молекулярным диалогом» между порядком и хаосом.
Вероятно, самой простой и удивительной из этих концепций служит водородная связь, скрепляющая элементы такой жизненно важной субстанции, как вода. Каждая молекула воды состоит из двух атомов водорода, соединённых с атомом кислорода, но у кислорода на внешней оболочке расположено шесть электронов. Для формирования химической связи с водородом требуется всего два электрона, поэтому четыре электрона с отрицательным зарядом, группирующиеся по два, висят там в своём микропространстве, надеясь как-то сбалансировать свой заряд. Эти пары оказывают слабое воздействие на атомы водорода, присутствующие в соседних молекулах воды, формируя длящиеся всего одну триллионную долю секунды кратковременные связи, а потом снова отрываются от них и связываются с другим атомом водорода. Этот непрекращающийся танец порождает химическое движения, делающее возможным жизнь, Болл называет «молекулярным диалогом» между порядком и хаосом.
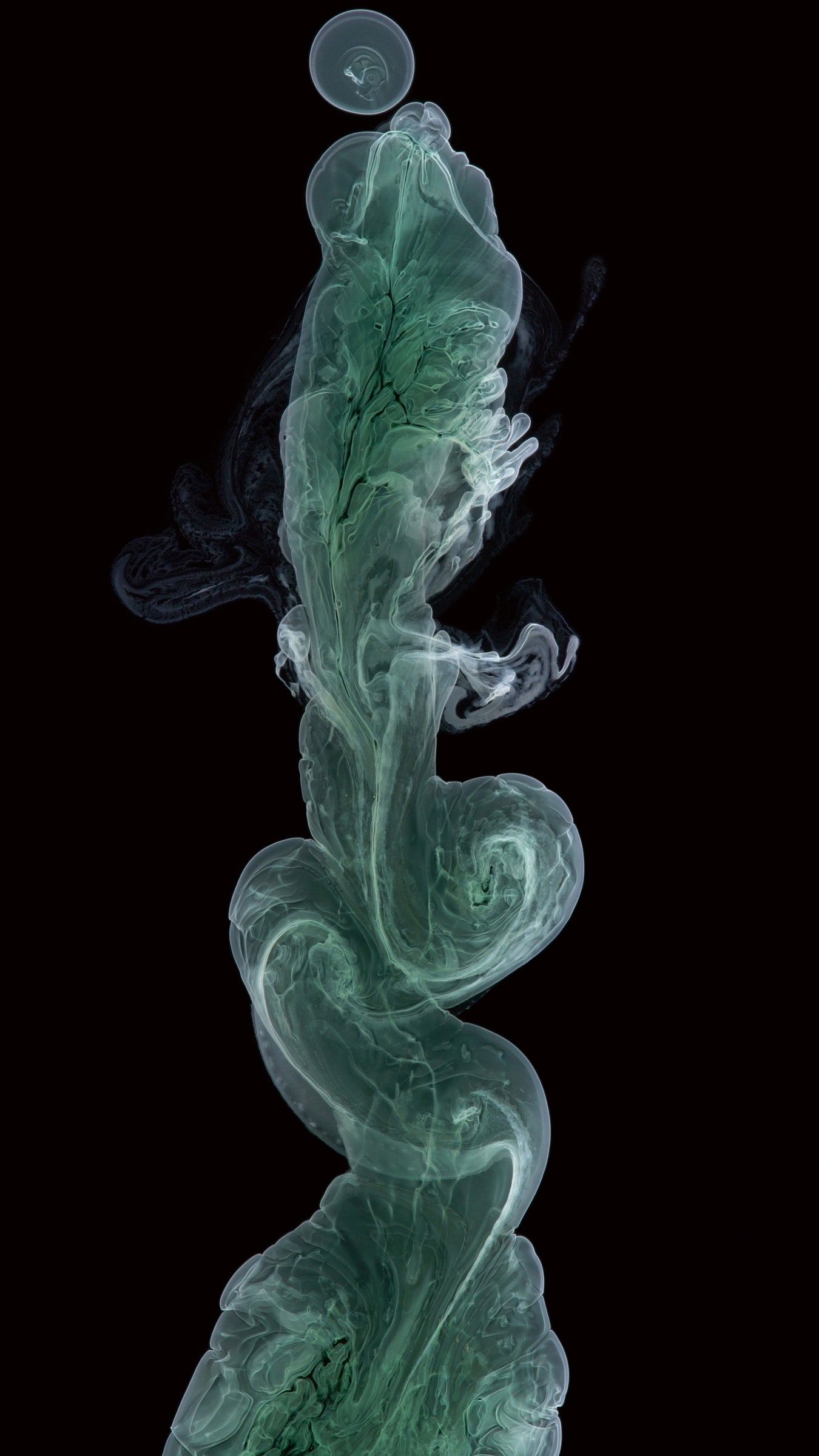
Гидроксид хрома (III)
Этот гидроксид хрома осаждается в процессе отверждения, одновременно завихряясь и растворяясь в своём контейнере. Такая реакция происходит при соединении двух жидких веществ, содержащих одновременно положительно и отрицательно заряженные ионы. Они начинают молекулярные завихрения, обмениваясь партнёрами. В данном случае ионами обмениваются хлорид хрома и гидроксид натрия. Положительно заряженные молекулы хрома и отрицательно заряженные молекулы гидроксида притягиваются друг к другу, поскольку так появляется энергетический баланс. Они формируют прочные связи, удерживающие молекулы на месте, и создающие твёрдый побочный продукт, в который все эти молекулы воды просто не умещаются. Также во время реакции появляется хлорид натрия, то есть столовая соль, прекрасно растворяющаяся в воде.

Кристалл сульфата меди
Кристаллы – величайшее достижение атомной эффективности. Их структура растёт из крохотной группки очень организованно расположенных атомов, когда окружающие их молекулы начинают регулярно повторять один и тот же узор, выстраиваясь друг за другом. Кристаллы сульфата меди, как на фото выше, легко получить даже дома – достаточно небольшого набора ингредиентов и немного терпения.

Фрактальные кристаллы никотиновой кислоты
Древовидно растущие кристаллы формируют ветвящиеся структуры вместо единого кристаллического блока. На фото выше — кристаллы никотиновой кислоты (они же – ниацин, витамин B3), формирующие похожие на одуванчики структуры, если перенасыщенный раствор этой кислоты быстро охладить. Физический процесс формирования этих древовидных структур по сути такой же, как и кристаллизация – просто он ускоряется резким изменением температуры или химического состава.
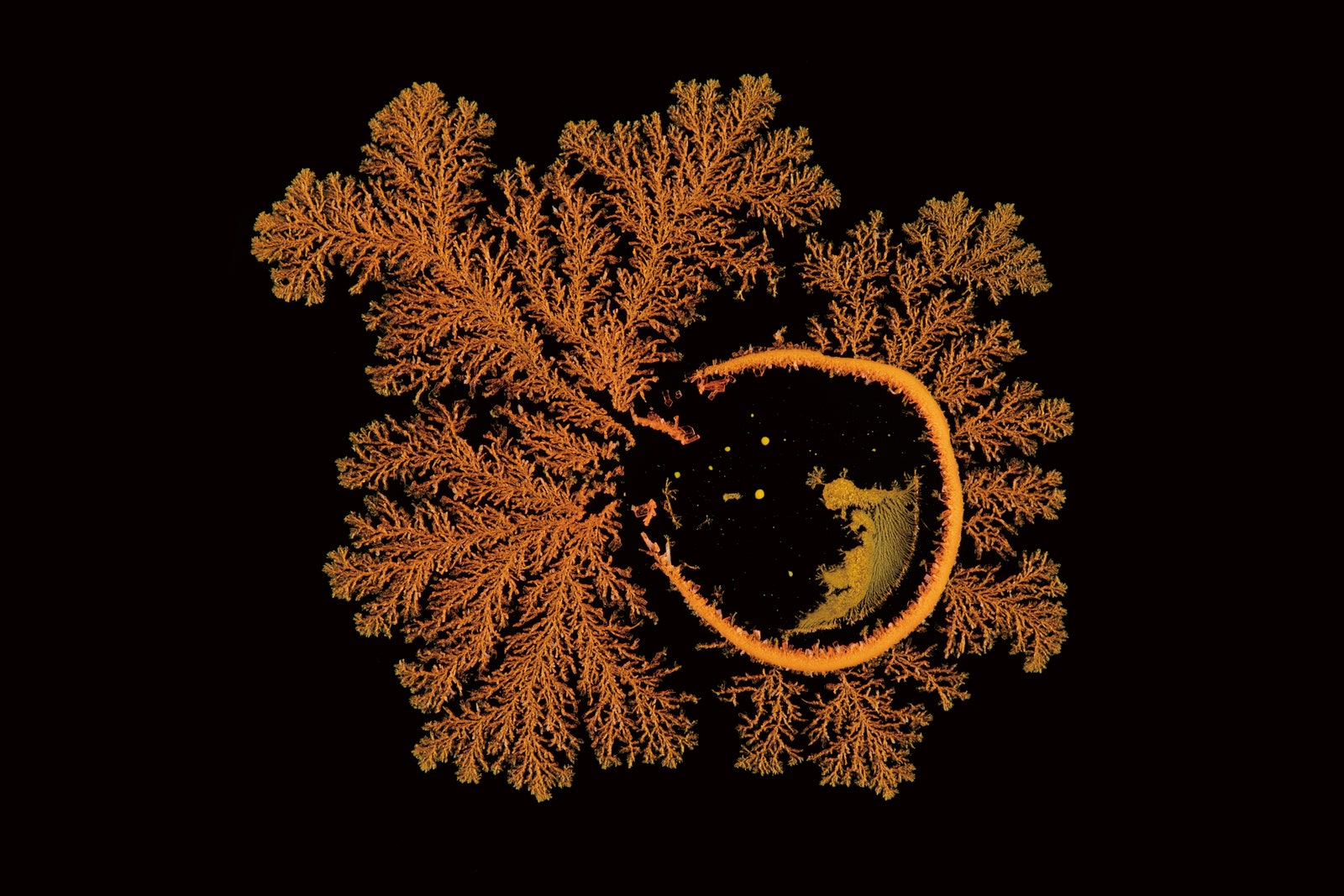
Дихромат калия
На фото – раствор дихромата калия, кристаллизирующийся во время быстрого испарения воды. Узоры получаются из-за неоднородности раствора. Это пример нестабильности роста – в некоторых местах частиц собирается больше, из-за чего они быстрее кристаллизуются, образуя сложные фрактальные узоры.

Кольца Лизеганга
Названные в честь первооткрывателя явления — немецкого химика и предпринимателя Рафаэля Лизеганга, нашедшего их в 1986 году, эти странные кольца – результат выпадения осадка в геле. В чашку Петри, содержащую дихромат калия, добавляется нитрат серебра. В тех местах, где эти вещества встречаются, они обмениваются ионами и образуют хромат серебра. Пока существует несколько конкурирующих теорий, объясняющих появление этих колец. Многие учёные считают, что изначальное отложение хромата серебра становится перенасыщенным и благодаря диффузии проникает через гель, создавая новую химическую зону накопления, в которой опять достигает насыщения, и формирует таким образом концентрические окружности.

Восстановление перманганата калия сахарозой
Перманганат калия, он же «минеральный хамелеон» — положительно заряженное вещество, окислитель. Сам кислород любит забирать электроны у окружающих атомов. В растворе сахара кислород в перманганате калия забирает электроны у молекул сахаров, что приводит к «восстановительной» реакции. Получая электроны и приближаясь к химическому равновесию, перманганат меняет цвет с фиолетового через зелёный, голубой и красновато-коричневый.
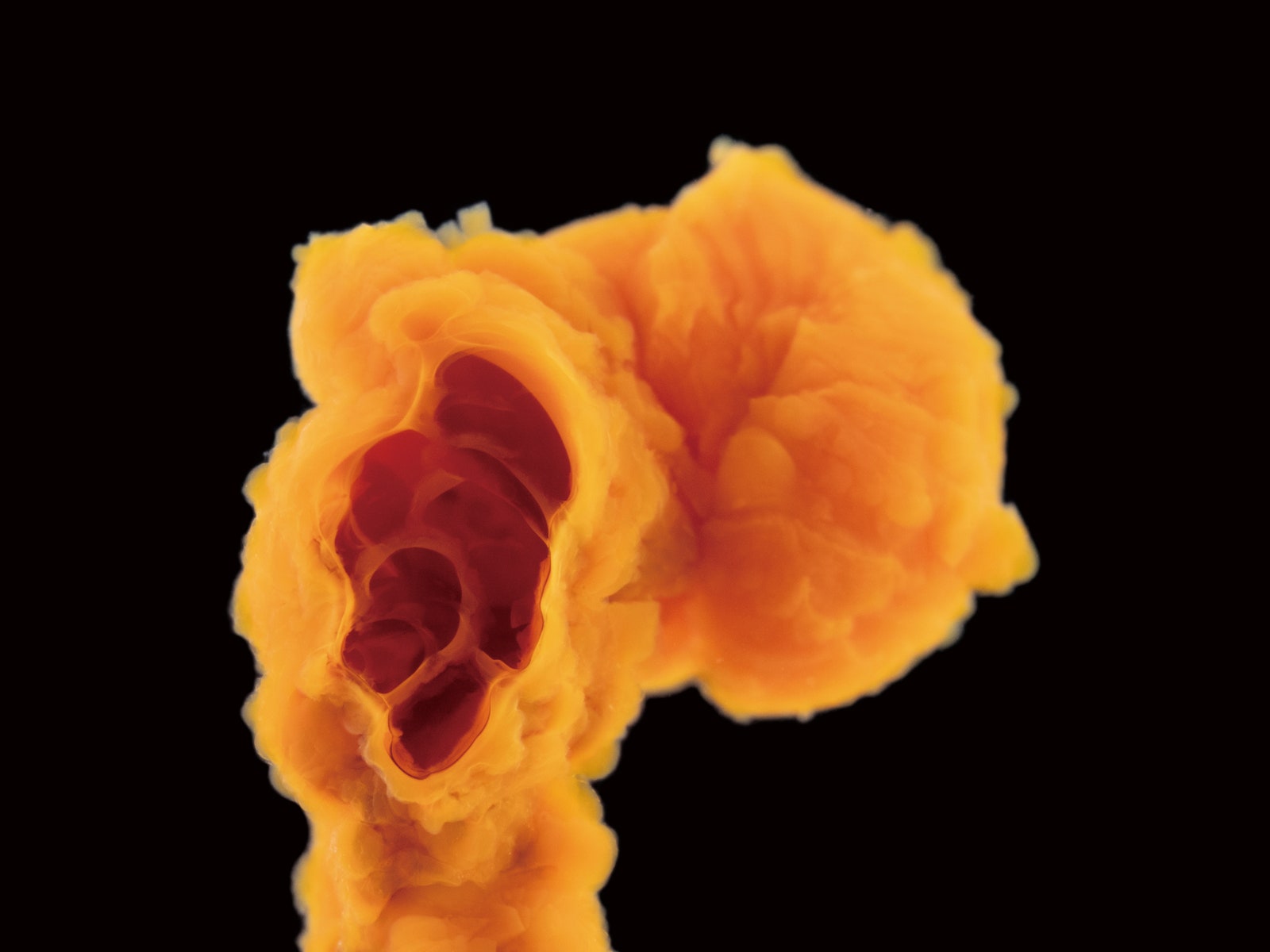
Сульфат аммония-железа (соль Мора)
Эта полая веточка сульфата аммония-железа подвешена в химическом саду – силикатном растворе, содержащем соли железа, выпадающие в осадок. Поскольку ионы силикатов склонны к формированию длинных цепочек и листов, они превращают обычное выпадение в осадок в процесс, порождающий неорганический сад со множеством угловатых «ветвей» и выразительных «цветков». Обмениваясь с окружающим раствором ионами, соли железа отверждаются и формируют тонкие полые мембраны, заполненные водой, плотность которых меньше окружающей их жидкости. С повышением внутри этих трубок давления они ветвятся и растут непредсказуемым образом.
