Древнеримский врач Гален был одним из первых, кто осознал, что именно мозг управляет моторными реакциями, когнитивными функциями и памятью. Но как именно мозг контролирует эти процессы? Со времен Галена этот вопрос был двигателем всей нейрофизиологии.
Начиная с работ Поля Брока, выполненных в 1800-х, функцию мозга описывали в терминах модульной сегментации: каждая зона мозга отвечает за уникальный набор поведений, действий и способностей. Такая позиция была сформулирована на материале наблюдений за пациентами, страдавшими от неврологических симптомов с последующим соотнесением этих симптомов с
локализованными травмами мозга. Например, выяснилось, что зона Брока (область мозга,
расположенная в задненижней части третьей лобной извилины левого полушария) отвечает за беглость речи. Открыли ее, изучая двух субъектов; оба они проявляли ограниченную речевую способность и страдали от поражений головного мозга со схожей локализацией. Притом, что записки Брока оказались критически важны для установления связи между речью и конкретной зоной мозга, данная нейроанатомическая ассоциация между структурными и функциональными признаками не объясняет всей сложности отношений между работой мозга и поведением.
Благодаря современным технологиям нейровизуализации, в частности, функциональной магнитно-резонансной томографии (фМРТ), сегодня можно в режиме реального времени наблюдать не только отклик конкретных зон мозга на стимулы, но и как на одни и те же стимулы реагируют зоны мозга, расположенные далеко друг от друга. Иными словами, фМРТ позволяет визуализировать функциональные, а не только анатомические нейронные связи. Для этого при фМРТ измеряется временная корреляция сигнала BOLD (метод контрастирования, зависящего от уровня оксигенации крови) между зонами мозга. Активация может давать положительную корреляцию: это означает, что, когда при решении задачи или во время отдыха активируется одна зона, тогда же активируется и другая. Также возможна и отрицательная корреляция: когда активируется одна зона, нервная деятельность в другой зоне снижается. Функциональная связность предвосхищает идею о сетевой природе мозга: зоны считаются элементами одной и той же сети, если их активация единообразно коррелирует. .
Исследование простых корреляций в активности разных зон мозга – только начало изучения функциональной связности. В течение последнего десятилетия нейронауки заимствуют продвинутые технологии из теории графов, применимые к исследованию визуализаций работы мозга. Расширяется научная дисциплина сложного сетевого анализа, в рамках которой предпринимается междисциплинарный подход к характеристике сетей мозга на основе небольшого количества неврологически значимых параметров. В данном случае важно, что анализ на основе графов позволяет смоделировать динамику всей мозговой сети одновременно, тем самым способствуя исследованию свойств в масштабах всего мозга. Сетевой анализ может выявлять даже мельчайшие изменения функции мозга и, соответственно, при помощи относительно простых параметров можно характеризовать изменения, затрагивающие всю сеть нейронов. В этой статье поясняется, что это за параметры, как они применяются, демонстрируется их использование на практике и свойственные им ограничения, конкретно в области лечения болезни Альцгеймера.
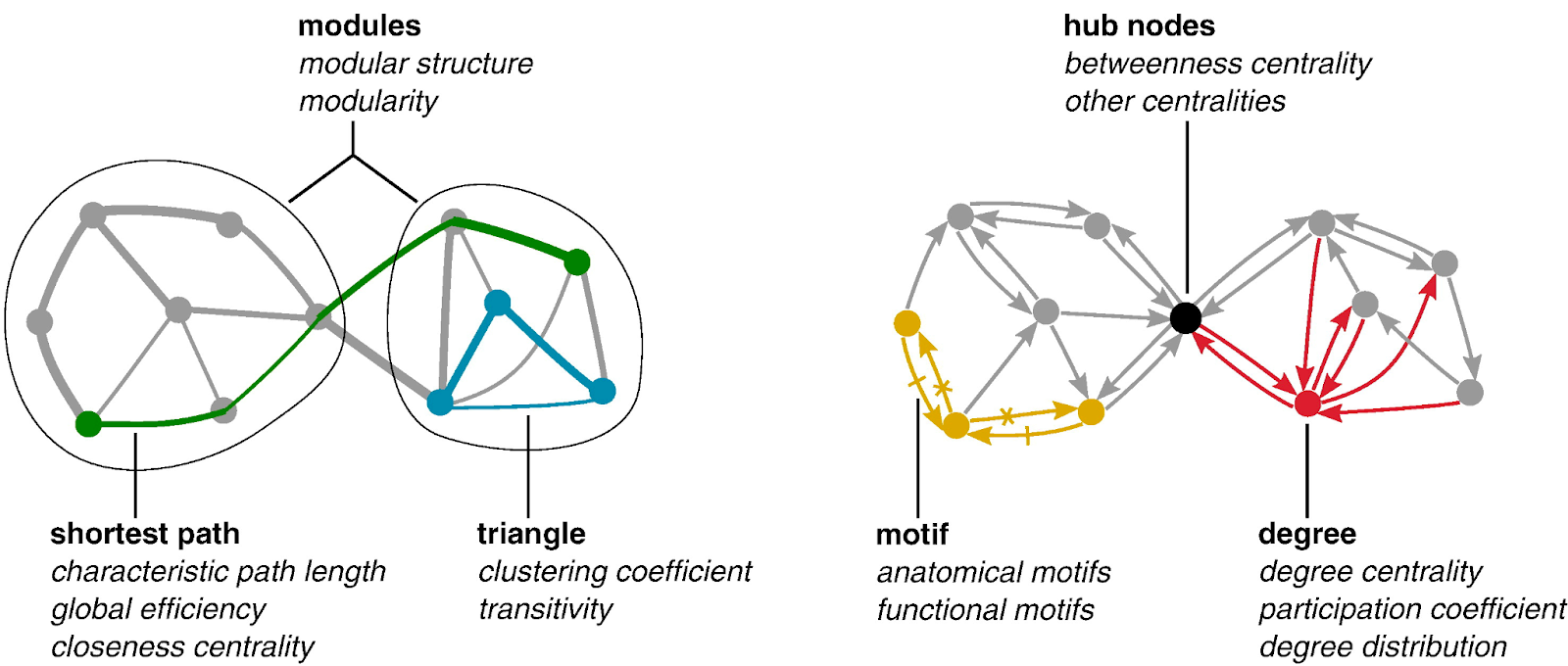
Любые сети можно описать через два их основных компонента – узлы и ребра, а также через взаимоотношения между узлами и ребрами. В контексте мозговых сетей узел – это заранее определенная интересующая нас зона, а ребро – степень связности между узлами. После вычисления сети можно измерить ряд стандартных параметров, чтобы понять, как глобальные, так и локальные свойства взаимодействий между различными зонами мозга. Так нейрофизиологи получают возможность исследовать сети в масштабах всего мозга. В широком смысле эти параметры характеризуют функциональную интеграцию, функциональную сегрегацию, центральность и степень компактности.

Показатели функциональной интеграции
Функциональная интеграция – это способность мозга комбинировать информацию, поступающую из разных зон. Показатели интеграции позволяют оценить, насколько легко устанавливается коммуникация между разными зонами мозга. Первый шаг при определении функциональной интеграции – это оценка длины пути. Длины путей в функциональных сетях — это последовательности ассоциаций, представляющие потенциальные направления, по которым может распространяться поток информации. Когда будут выведены длины путей между компонентами мозговой сети, можно определить характеристическую длину пути (среднюю кратчайшую длину пути для всех пар узлов). Характеристическая длина пути позволяет определить, насколько просто передавать информацию по данной сети. Следующая метрика функциональной интеграции – глобальная эффективность, она обратна кратчайшей длине пути. Глобальная эффективность дает примерно ту же информацию, что и длина пути, но в меньшей степени отражается на регионах, сравнительно изолированных от основной сети. .
Показатели сегрегации
Функциональная сегрегация характеризует способность мозга осуществлять специализированную обработку информации внутри сильно взаимосвязанных групп, образуемых зонами мозга. Показатели сегрегации позволяют количественно выразить наличие таких взаимосвязанных групп, также именуемых кластерами. В функциональных сетях наличие таких кластеров свидетельствует о том, что отдельные группы нейронов в сети работают обособленно. Эти показатели определяются по числу треугольников, вырисовывающихся в мозговой сети. Для определения функциональной сегрегации сначала нужно вычислить коэффициент кластеризации – пропорцию треугольников вокруг отдельно взятой зоны. Далее можно определить показатель модульности – степень, в которой сеть можно разбить на неперекрывающиеся группы. В таком случае каждый модуль будет соответствовать специализированной функциональной области (например, зрительной зоне). .
Показатели центральности
Центральность характеризует, насколько важна конкретная зона мозга для обеспечения обработки информации и управления потоком информации в сети. Показатели центральности позволяют оценить, насколько конкретная зона интегрирована с другими зонами сети. Ключевая мера центральности – это «степень», то есть, число связей, присущих конкретной зоне. Области с высокой степенью взаимодействуют со многими другими областями в сети. По показателю степени можно классифицировать зоны, относя их к функциональным группам.
Показатели компактности
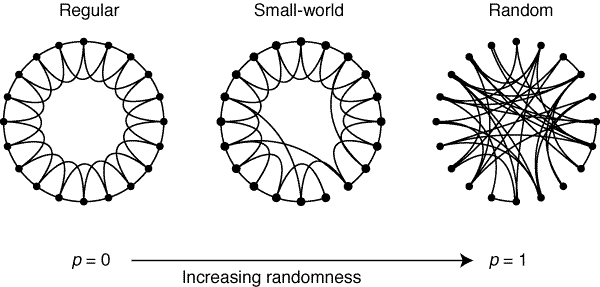
Сети типа «мир тесен» часто характеризуют биологические системы, в частности, мозг. Формальное определение сети «мир тесен» таково: кластеризация в ней выше, чем в случайно взятой сети, но длина пути примерно такая же, как в случайной сети. В биологии свойство компактности соответствует балансу между функциональной интеграцией и сегрегацией. Известно, что и структурные, и функциональные сети мозга обладают топологию, которую можно представить как граф «мир тесен». Компактность функциональных сетей можно вычислить как отношение коэффициентов кластеризации к длине пути. .
Чтобы проиллюстрировать, как оба эти показателя могут применяться для лучшего понимания и классификации болезни, разберем в качестве примера болезнь Альцгеймера. Болезнь Альцгеймера – наиболее распространенная форма деменции, клинически она определяется как когнитивное и поведенческое угасание, обычно начинающееся с ухудшения памяти. Наиболее распространенное объяснение этой патологии – аномальное накопление в мозге двух белков, амилоида и тау-белка, которые и провоцируют разрушительную нейродегенерацию, характерную для болезни Альцгеймера. Глобально как сама болезнь Альцгеймера, так и смертность из-за нее более распространены у женщин, чем у мужчин. По состоянию на 2020 год была шестой по распространенности причиной смерти в США, а количество смертей в результате этой болезни в период с 2000 по 2018 год выросло на 146%. Считается, что к 2050 году в Америке будет жить более 13,8 миллионов граждан в возрасте от 65 лет, страдающих болезнью Альцгеймера, а на 2020 год этот показатель составляет 5,8 миллионов. Только в 2020 году стоимость ухода за пациентами в возрасте от 65 лет и старше, страдающими болезнью Альцгеймера и другими формами деменции, оценивается в $305 миллиардов.
Современные методы купирования болезни Альцгеймера позволяют замедлить развитие симптомов, но в целом болезнь остается неизлечимой. Даже новейшие одобренные препараты лишь заметно сокращают визуально заметное количество амилоидных бляшек в мозге, но не оказывают существенного влияния на когнитивные функции. Иными словами, даже нацеливаясь на один из белков, между накоплением которого и развитием болезни Альцгеймера установлена причинно-следственная связь, не удается поправить здоровье пациента, а ведь это наиболее важно. Даже высказываются мнения, будто чрезмерная зацикленность на гипотезе о важности амилоидов и тау-белка на самом деле тормозит прогресс при поиске лекарства от болезни Альцгеймера, так как отвлекает внимание от других биологических механизмов, которые, возможно, подстегивают это дегенеративное заболевание. Если это так, то нам отчаянно нужны другие модели, которые помогли бы понять эту патологию. В последнее время растет интерес к определению «нейромаркеров» болезни Альцгеймера – иными словами, специфических нейронных паттернов, характерных именно для болезни Альцгеймера. Сетевой анализ может дать подсказки по эффективности различных подходов и позволить рассмотреть болезнь в ином ракурсе. Это позволило бы эффективнее выявлять случаи болезни Альцгеймера и, в конечном итоге, разработать эффективные приемы лечебного вмешательства. .
Одна из первых связей, выявленных между сетевым анализом и углубленным пониманием болезни Альцгеймера – это моделирование данной патологии как «синдрома разъединения». Эта концепция была впервые предложена для описания патологий, при которых из-за конкретного события (например, инсульта) различные зоны мозга теряли связь друг с другом. Гипотеза разъединения предполагает, что когнитивная дисфункция возникает именно из-за такого разобщения различных областей мозга. Сначала эта гипотеза развивалась на материале нейроанатомического препарирования, а после ее расширили, включив в нее функциональное разобщение. При этом удалось установить, что функциональное разобщение может развиваться независимо от анатомических повреждений и наоборот. .
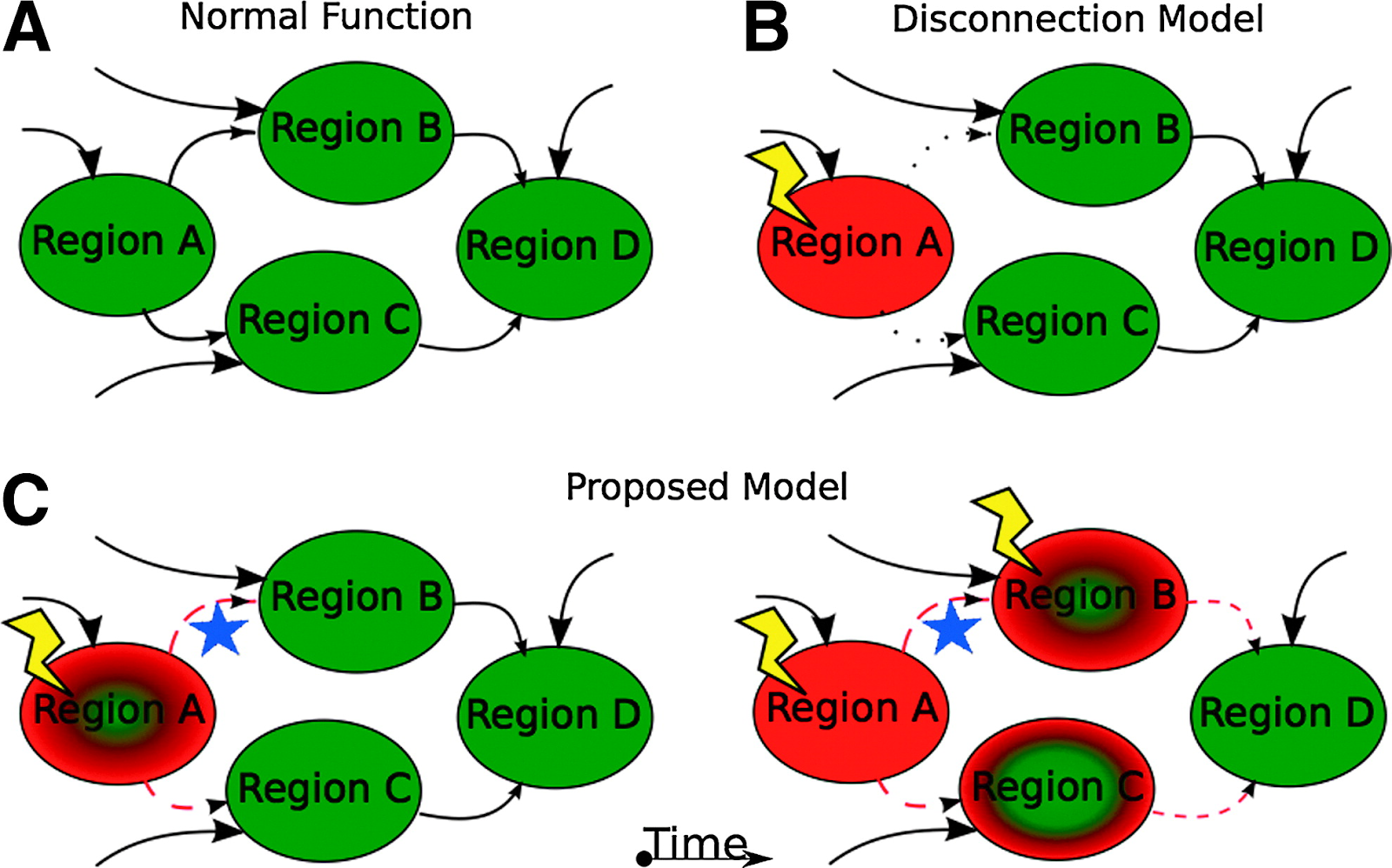
При болезни Альцгеймера сниженный уровень связности в нейронной сети пассивного режима подкрепляет гипотезу о том, что эта патология – вариант синдрома разъединения. Сеть пассивного режима включает высокоуровневые зоны коры больших полушарий и известна как «сеть бездействия». Те зоны мозга, которые активно работают в состоянии покоя, напротив, отключаются при решении задач с четко сформулированной целью. В сущности, корректно функционирующая сеть пассивного режима должна проявлять наибольшую активность в состоянии покоя и отдыхать в то время как решаются задачи, связанные с высокой когнитивной нагрузкой. Но при болезни Альцгеймера наблюдается неполная деактивация сети пассивного режима (в сравнении с показателями здоровых людей из контрольной группы) при решении задач на визуальную кодировку и с привлечением рабочей памяти. При прогрессировании болезни Альцгеймера разъединению подвергается не только сеть пассивного режима. По-видимому, разъединение распространяется и на сенсомоторные, и на исполнительные сети, даже когда болезнь находится на легкой и умеренной стадии. Разрушение этих сетей является неожиданным, поскольку их состояние не обязательно коррелирует с тяжестью гистопатологии при болезни Альцгеймера (отложением амилоидных бляшек и тау-белка в рассматриваемых зонах мозга) – но должно коррелировать, согласно «амилоидной гипотезе». Однако, оригинальные исследования, в которых были обнаружены изменения нейронных сетей при болезни Альцгеймера, учитывали только изменения в структуре корреляций, но не исследовали этих изменений в контексте глобальной нейронной сети мозга. При помощи обычных стратегий, например, при оценке множества индивидуальных попарных корреляций или при усреднении по множествам попарных корреляций затуманивается динамика работы сети как единого целого. С другой стороны, опираясь на показатели теории графов, исследователи могут избежать таких проблем. .
Теоретически, что могут сказать нам теоретические измерения в рамках теории графов о болезни Альцгеймера как о синдроме разъединения? Что отличает сети, разрушившиеся под действием болезни Альцгеймера, от сетей, обеспечивающих нормальную когнитивную деятельность или характеризующихся лишь мягкими когнитивными расстройствами? Во-первых, при генетически обусловленной болезни Альцгеймера изменения в графовых метриках становятся заметны примерно за десять лет до начала болезни. Конкретно, в предклинье полушарий головного мозга длина пути начинает уменьшаться за 13 лет до начала болезни, а в рамках всего мозга – за 12 лет до проявления первых симптомов. Интересно, что само предклинье является настоящим хабом связей, ведущих в другие зоны мозга, и относится к сети пассивного режима. У таких пациентов также утрачиваются локальные связи в кластерах (и, соответственно, топология, описываемая графом «мир тесен»). Таким образом, у тех пациентов, у которых начинается болезнь Альцгеймера, в нейронных сетях мозга прогрессирует разупорядоченность, теряется баланс между локальной и глобальной связностью. Эти данные вполне убедительно свидетельствуют, что изменения в сетевой структуре мозга позволяют предположить, что у человека начнется болезнь Альцгеймера. Более того, изменения в коэффициентах кластеризации развиваются параллельно с прогрессированием болезни. Опираясь на эти исследования, удалось установить, что в сети исчезают малые ребра, и в результате пути в мозге меняются так, что уменьшается количество связей в пределах каждой из зон. Также удалось воспроизвести утрату свойств компактности, это исследование дополнительно показало нарушение локальной связности. В целом, наработанные к настоящему времени результаты указывают на снижение локальной связности (что является движущим фактором формирования клинической картины), а глобальная связность в пределах всего мозга остается относительно стабильной. Уже ведутся исследования, в рамках которых при помощи теории графов разграничиваются болезнь Альцгеймера, другие когнитивные нарушения и здоровое состояние мозга.
Сообщается, что точность классификации при разграничении болезни Альцгеймера, легких когнитивных нарушений и нормальной когнитивной функции варьируется в диапазоне от 77 % до 100 % в зависимости от исследуемой популяции и применяемой методологии. Современные стандарты диагностики болезни Альцгеймера основаны на клинической оценке и степени запущенности амилоидной/тау-патологии. Но чувствительность такой диагностики варьируется в диапазоне от 70 % до 87 %, а специфичность – от 44 % до 70 %. Поскольку в течение более чем десяти последних лет для подтверждения диагностики деменции широко используется нейровизуализация, возможно, что вполне целесообразно инкорпорировать в диагностику болезни Альцгеймера метрики из теории графов, учитывая, что пациенты наверняка регулярно проходят процедуры нейровизуализации. .
До сих пор источники по теории графов в контексте болезни Альцгеймера остаются немногочисленными по причине малого размера выборок, что осложняет обобщение выводов по крупным и разнообразным популяциям. Кроме того, в исследованиях могут применяться разные методы оценки функциональной связности, от линейных до сложных нелинейных. Схемы парцелляции мозга также отличаются от исследования к исследованию, такие же отличия характерны и для предобработки сырых данных по перемещению, пространственному сглаживанию и регрессии сторонних сигналов. Однако, по мере развития данной дисциплине и, в частности, все более частого проведения крупных когортных исследований со стандартизированными конвейерами обработки и выкладыванием данных в общий доступ (как например, в проекте «Коннектом человека»), результаты становятся все репрезентативнее и лучше воспроизводятся.
В заключение отметим, что теория графов может дать мощный инструментарий для понимания работы мозга, как на глобальном, так и на зональном уровне. Такие измерения могут быть особенно полезны, когда требуется понять патологически обусловленные изменения в сетевой структуре мозга. Рассмотренный здесь кейс с болезнью Альцгеймера показывает, что теория графов позволяет вывести параметры, при помощи которых успешно диагностируется болезнь Альцгеймера, анализируется ее невропатология, а также обеспечивается высокоточная классификация этой болезни. Притом, что клиническая применимость и обобщающая способность этих методов пока остается ограниченной, развивается сетевой анализ нейровизуальных данных. Эта дисциплина растет, и в ней предстоит совершить еще множество открытий. .


