
Что мы вспоминаем при словосочетании «научная фантастика»? Конечно же роботов, летающие машины, исследование ранее неизведанных уголков Вселенной, инопланетян и еще целую вереницу сюжетов. Среди них особое место всегда занимала тема заселения другой планеты, то ли от уверенности в неизбежности гибели собственной, то ли от желания радикально сменить обстановку. Первой претенденткой на звание Земля 2.0 всегда был Марс, холодный и безжизненный. На данный момент собрать чемоданы и улететь на Марс в отпуск недельки на две пока не представляется возможным, но это абсолютно реально и выполнимо, вопрос только как скоро. Самым же бросающимся в глаза минусом Марса (за исключением отсутствия нормального интернета) является отсутствие приемлемой для жизни атмосферы. Прилететь в место назначения, выйти из летательного аппарата и вдохнуть полной грудью, ощутив всю свежесть местного воздуха — это не про Марс. Но так будет не всегда.
Сегодня мы с вами познакомимся с исследованием, в котором описывается новый метод выработки кислорода посредством необычной химической реакции. Как ученые вырабатывали молекулярный кислород из СО2, насколько эффективен этот метод и где его можно применять кроме межпланетных путешествий? Ответы на эти вопросы мы будем искать в докладе ученых. Поехали.
Основа исследования
Человеку для жизни нужно всего три вещи: еда, вода и воздух, в котором будет достаточно кислорода. Это наши с вами первичные нужды (да, интернета нет в этом списке). Но кислород просто так на дороге не валяется, особенно за пределами нашей любимой планеты. Следовательно, если мы хотим отправиться куда-то, нам необходимо брать его с собой и использовать различные устройства для очистки воздуха и повторного его использования. Вся эта радость занимает уйму места, и рано или поздно кислород исчерпается. А пополнить запасы в космосе или на Марсе будет, мягко говоря, проблематично.
Однако относительно недавно ученые обнаружили достаточно большое количество кислорода в комете 67P/CG6, что побудило их задать вполне очевидный вопрос — откуда он там взялся? Кислород в таких телах как кометы является результатом возникающей в экстремальных условиях абиотической реакции, в процессе которой из H2O, CO2, CO и т.д. выделяется O2 (кислород). Ученые утверждают, что такими реакциями можно объяснить наличие кислорода в кометах, верхних слоях атмосферы Марса и в ранней атмосфере Земли. Человек же может применить такую химическую реакцию для выработки О2 из СО2, что позволит сделать Марс пригодным для жизни.
Если очень утрировано и кратко, то упомянутая выше реакция это разложение СО2 на компоненты: C + O2. Другими словами, диссоциация.
Диссоциация CO2 может проходить по нескольким сценариям в зависимости от доступной для реакции энергии. Меньше всего энергии требует частичная диссоциация CO2 → CO + O (5,43 или 7,56 эВ). Также есть полная диссоциация CO2 → C + O + O, требующая 16,46 эВ. И, самая любопытная, экзотическая диссоциация, когда CO2 распадается на C и O2. Расчеты показывают, что подобная реакция протекает на поверхности потенциальной энергии основного состояния, сначала образуя циклическое промежуточное CO2 соединение [c-CO2(1A1)], которое затем перестраивается в коллинеарное промежуточное соединение COO (1Σ+) на пути к диссоциации в С + О2.
Такая реакция возможна, если «согнуть» молекулу таким образом, чтобы два атома О стали максимально близки друг к другу. На это требуется 6 эВ внутренней энергии. И, согласитесь, сколько бы силачи не гнули металлические прутья, согнуть молекулу будет куда сложнее.
Согнуть молекулу могут помочь переходы в электронно-возбужденные и анионные состояния СО2. Ученые напоминают, что недавние опыты их коллег показали, что применение VUV (вакуумный ультрафиолет) фотовозбуждения и присоединения электронов позволяет достичь диссоциации CO2 на C(3P) + O2(X3Σg-). Однако никто ранее не изучал этот экзотический процесс на достаточно детальном уровне. А все потому, что в результате таких опытов не было обнаружено ионизированных продуктов O2. Но, как мы знаем, не найти что-то еще не значит, что его нет вовсе.
Посему в рассматриваемом нами сегодня исследовании ученые применили методы рассеяния ионного пучка на ряду с математическим моделированием, чтобы продемонстрировать новый способ активации прямого восстановления CO2 до O2 с обнаружением ионизированных продуктов O2. Данный процесс содержит ранее неизвестный внутримолекулярный путь реакции, который протекает при активных столкновениях ионов и поверхности CO2. Самое удивительное это отсутствие зависимости данной реакции от природы и температуры поверхности.
Результаты исследования
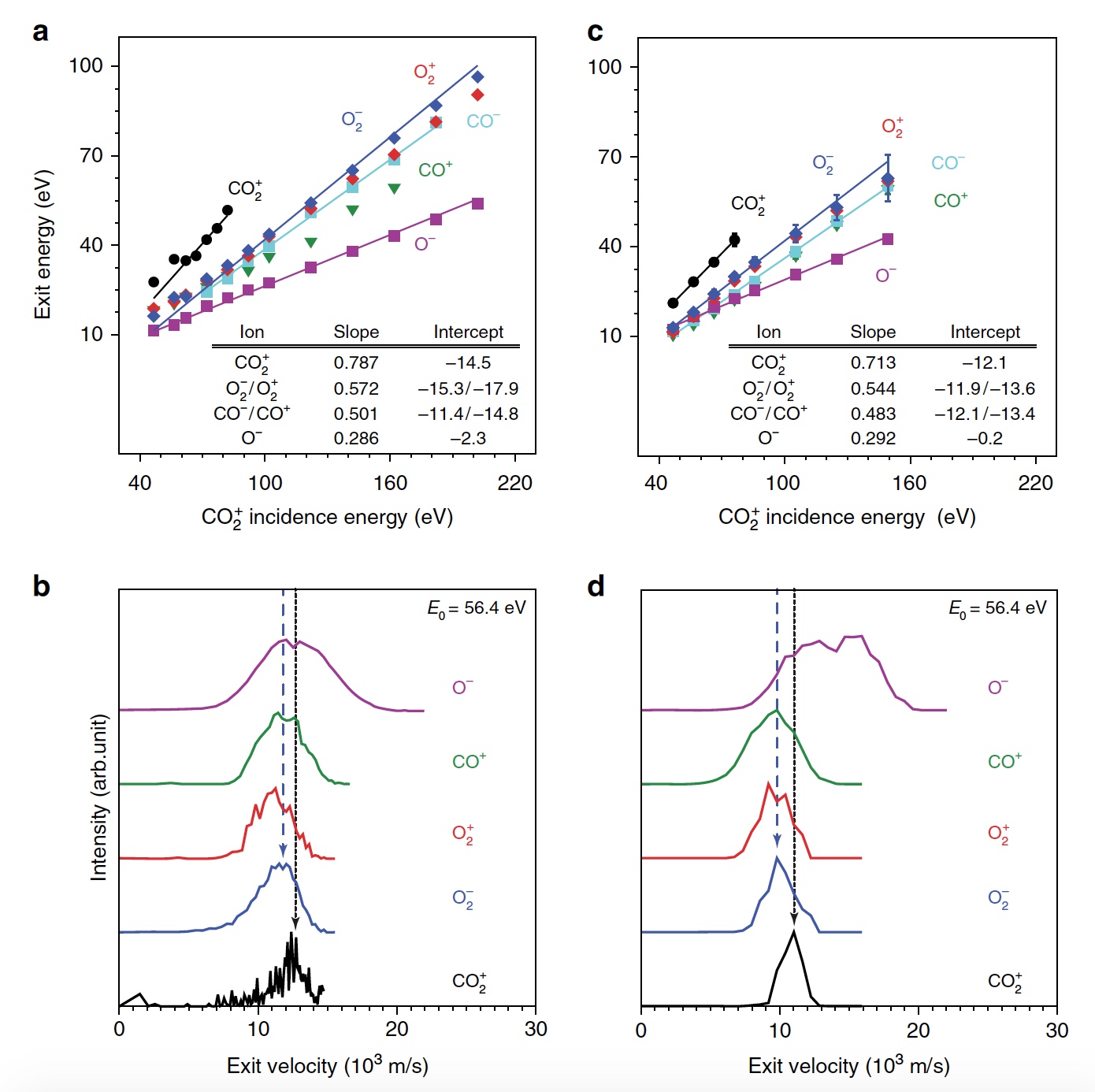
Первым делом ученые демонстрируют образование О2 в гипертермических столкновениях CO2+/Au путем построения графиков распределения кинетической энергии трех рассеянный молекулярных ионных продуктов (CO2+, O2+ и O2−) для различных энергий падающего CO2+ (E0). При E0 <80 эВ был обнаружен очень слабый сигнал рассеянного CO2+ (1а, график слева).

Изображение №1
Пик энергии выходящего CO2+ пропорционален E0, то есть имеет место баллистический или импульсный отскок от поверхности, что исключает физическое распыление. Ученые считают, что наблюдение за «динамическим» сигналом CO2+ крайне важно, ибо является доказательством того, что некоторое количество CO2 выживает при поверхностном столкновении. Кроме этого можно определить последовательность столкновения составляющих атомов. Кроме CO2+ также наблюдались сигналы рассеянных ионов O2 (1b, 1c / график в центре и справа). При этом энергии выходящих O2+ и O2− представляют большую долю энергии падающих частиц (57%) и равномерно возрастают параллельно E0 в более широком диапазоне, чем рассеянный CO2+. Максимальный сигнал ионов O2 наблюдался при E0 ~ 100 эВ.
Исследователи называют обнаружение ионных продуктов О2 удивительным, так как ни распыление поверхностных O2, ни реакции абстракции атома O не могут объяснить образование этих ионов. А все потому, что оба эти механизма производили бы O2 при гораздо более низких энергиях на выходе, чем наблюдалось. Логично предположить, что здесь замешана та самая диссоциация CO2.
И частичная, и полная диссоциация СО2 хорошо согласуется с другими обнаруженными ионными продуктами (СО+, СО−, О+, О− и С+). А энергия выходящего CO+, CO− и O− изменяется параллельно с энергией падающих частиц, что согласуется с динамическим образованием при поверхностном столкновении.
Но пики O+ и C+ показывают крайне малую зависимость от E0, что указывает на различное происхождение, то есть на распыление. Подтверждением полной диссоциации являются рассеянные продукты C+, проявляющиеся при E0> 80 эВ.
Далее ученые применили кинематику для описания механизма рассеяния.
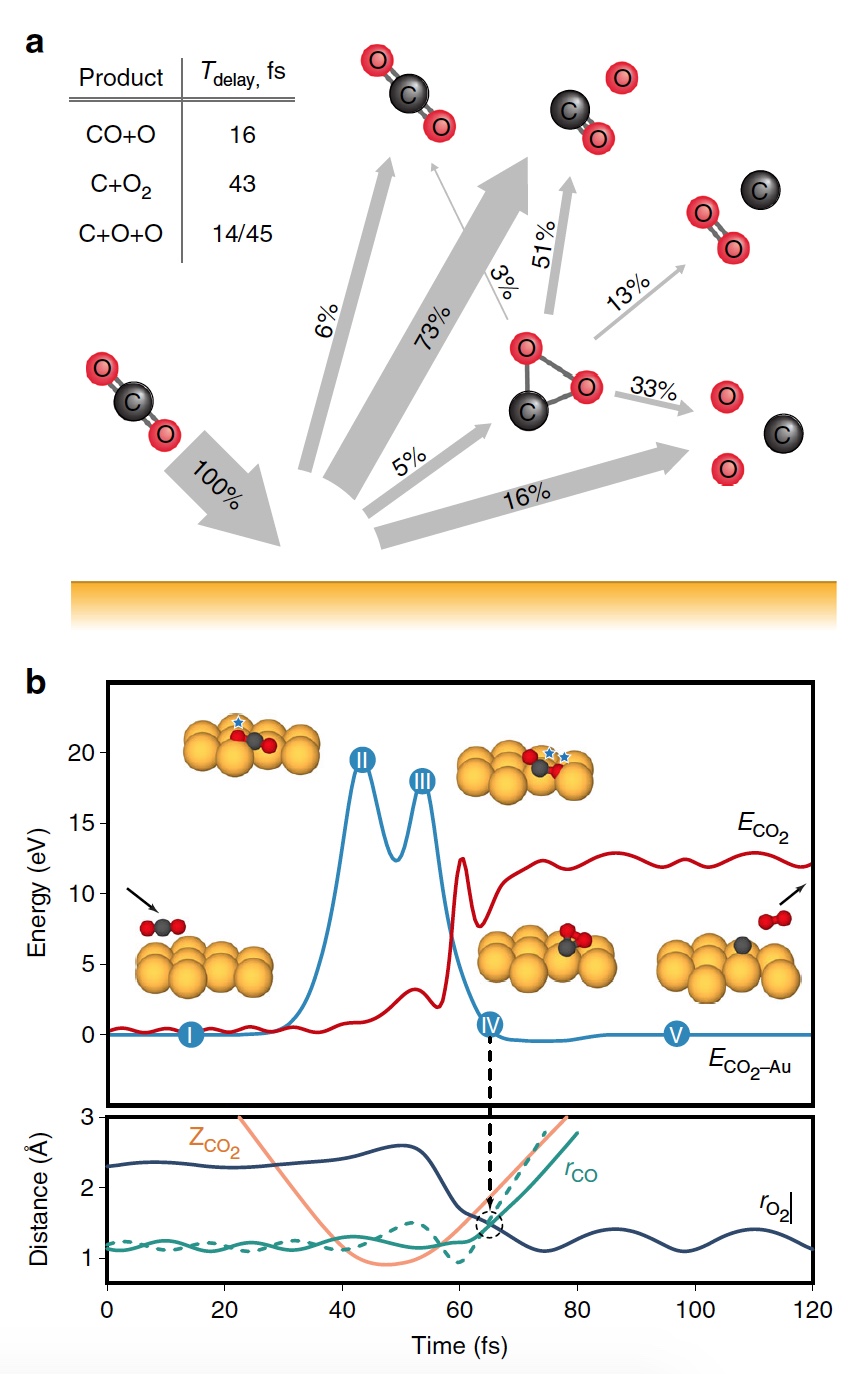
Бинарная теория соударений (БТС) позволяет рассчитать кинематический фактор, определяемый как доля энергии падающих частиц, удерживаемая рассеянным продуктом, выходящим из поверхности. В случае простейшей модели CO2+ рассеивается как целая молекула, т.е. как твердая сфера с атомной массой 44 Да. В таком случае БТС предсказывает кинематический коэффициент 0,6349, что довольно слабо соотносится с данными (2а).
Изображение №2
Следом ученые применили модель, в которой атом О сначала сталкивается с поверхностным атомом Au, а затем происходит второе столкновение фрагмента CO без быстрой диссоциации молекулы CO2. Применение БТС к данной модели последовательных столкновений дает кинематический коэффициент 0,7870, который отлично согласуется с данными по энергии выходящего CO2+ (черная линия на 2a). На графике 2а также показаны энергии других выходящих рассеянных ионных продуктов.
Основным потенциальным источником таких продуктов можно назвать частичную или полную диссоциацию CO2 и поверхностное распыление адсорбированных фрагментов CO2. Несмотря на то, что некоторое распыление действительно наблюдается при высоких значениях E0 (> 140 эВ), кинематический анализ данных по энергии выходящих частиц дает убедительные доказательства наличия именно импульсной диссоциации молекулы CO2.
Далее ученые провели анализ скорости наблюдаемых рассеянных частиц.
На изображении 2b показано сравнение пиков распределения ионов при E0 = 56,4 эВ. Как мы видим, скорости выхода рассеянного CO+, O2+, O2− и более медленной части распределения O− перекрывают друг друга, что указывает на общее происхождение. Однако распределение O− заметно шире, распространяясь на более высокие скорости на выходе, что может говорить об альтернативном происхождении. Ионные продукты O2 выходят со скоростями ниже, чем CO2+ ввиду неупругости, возникающей из-за разрыва химических связей и нерезонансной поверхностной ионизации.
Вышеописанный кинематический анализ, как говорят ученые, дал исчерпывающие доказательства того, что некоторые молекулы CO2 рассеиваются не поврежденными после двухступенчатого последовательного столкновения фрагментов O и CO. Однако все равно остаются вопросы, касающиеся различных аспектов механизма образования O2.
После проведения экспериментов остается ряд вопросов. Во-первых, осталось неясно образуется ли O2 с помощью электронного адиабатического или неадиабатического механизма. Во-вторых, неизвестны пути столкновений, которые лежат в основе распределения скоростей на выходе ионных фрагментов. В-третьих, неизвестно сколько образуется нейтрального O2.
Прояснить ситуацию в таком случае может моделирование, а именно метод классической молекулярной динамики (метод МД).
В моделировании траектории рассеяния CO2 на Au(111) была применена геометрия рассеяния, наблюдаемая в эксперименте. При этом предполагается, что CO2 выделяется на поверхности потенциальной энергии синглетного электрона в случае нейтрализации поступающих ионов CO2+ перед жестким столкновением.
Быстрая нейтрализация происходит посредством резонансного туннелирования электронов от поверхности металла к молекулярному катиону, поскольку молекулярный уровень CO2 (-13,8 эВ) находится в пределах занятой зоны Au (от -5,3 до -15,3 эВ). В моделировании также учитывались и переносы электронов с/на поверхность, чтобы учесть ионизацию нейтральных продуктов соударений.
На изображении 2с показаны рассчитанные значения энергии выходящих частиц.
Было обнаружено, что незначительное число СО2 сохраняет целостность при E0 > 80 эВ, что согласуется с отсутствием сигнала при этих энергиях во время практических опытов. Данные, полученные посредством моделирования, отлично согласуются с экспериментальными, что легко увидеть сравнив графики 2а (эксперимент) и 2с (моделирование).
Помимо этого согласования экспериментов и моделирования проявляется и в сравнении скорости выходных ионов при E0 = 56,4 эВ (2d). И модель, и эксперимент показывают расширение распределения скоростей CO+ и O–. Также было подтверждено, что распределения O2+ и O2– аналогичны катиону, выходящему медленнее, чем анион. Кроме того в обоих случаях было установлено, что CO2+ выходит с большей скоростью, чем ионизированные продукты O2.
Следовательно, использование данной методики моделирования может дать достаточно точные данные касательно механизма реакции прямого преобразования CO2 в O2.
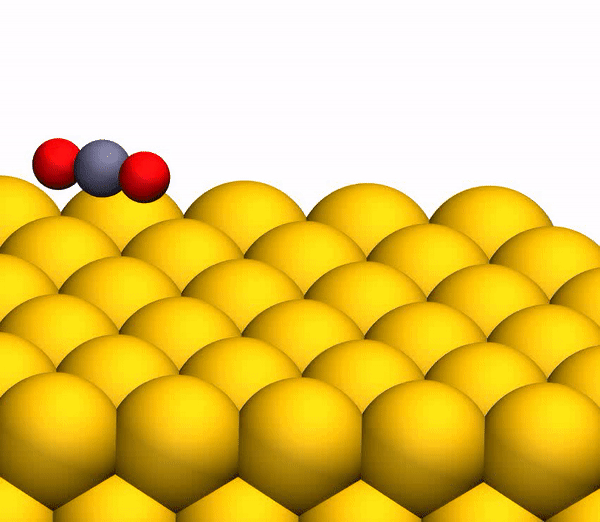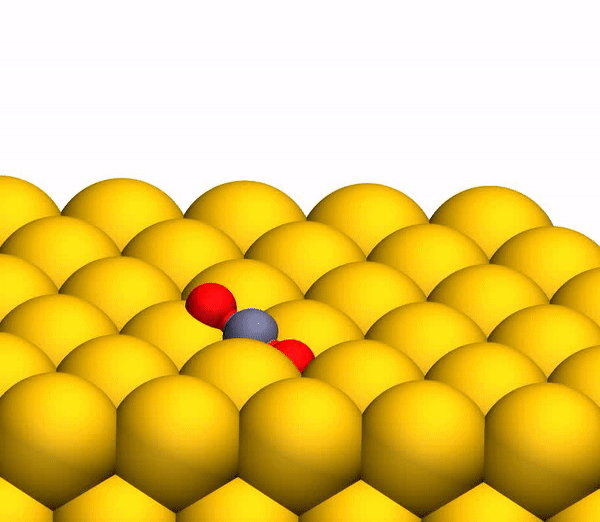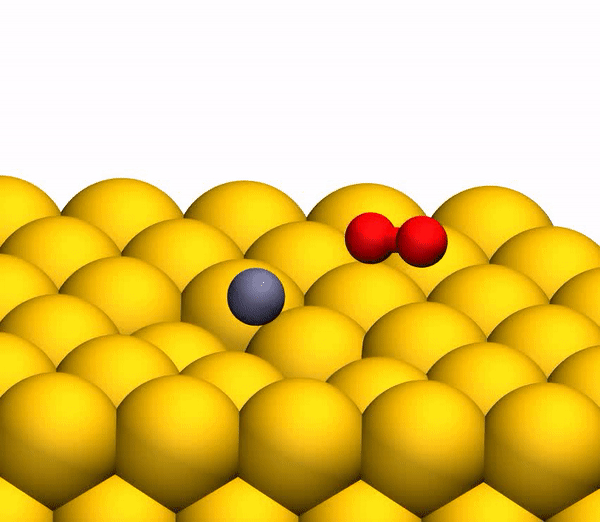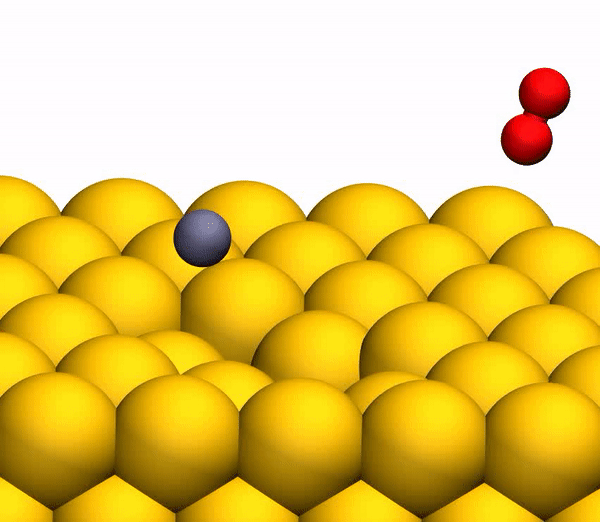
Во время основного этапа моделирования было воссоздано по 20000 траектории столкновения CO2-на-Au при разных значениях энергии выходящих частиц. В результате было получено несколько вариантов продуктов диссоциации, в том числе и O2 (3а).
Изображение №3
На изображении 3b показана репрезентативная траектория, результатом которой является образование O2. В результате импульсной передачи энергии во время столкновения внутри отскакивающего СО2 происходит существенная внутримолекулярная перегруппировка. Расстояние O – O уменьшается, а расстояние C – O увеличивается, достигая пика, когда CO2 приобретает треугольную конфигурацию с почти равными длинами связей. Такой сильно изогнутый промежуточный CO2 продукт обладает значительным количеством внутренней энергии и быстро диссоциирует, в результате чего образуется свободный атом C и колебательно горячая молекула O2.
Процесс разделения CO2 на свободный атом C и колебательно горячую молекулу O2.
Стоит отметить, что описанный выше механизм разделения полностью согласуется с выводами кинематической модели, использованной ранее.
Расчеты показали, что примерно 5% от всех траекторий приводят к сильно изогнутому промежуточному состоянию СО2, что является одной из стадий выделения О2. Данное состояние фрагментируется в основном посредством частичной диссоциации (51%), после чего снова следует полная диссоциация, но уже с более высоким результатом (33%).
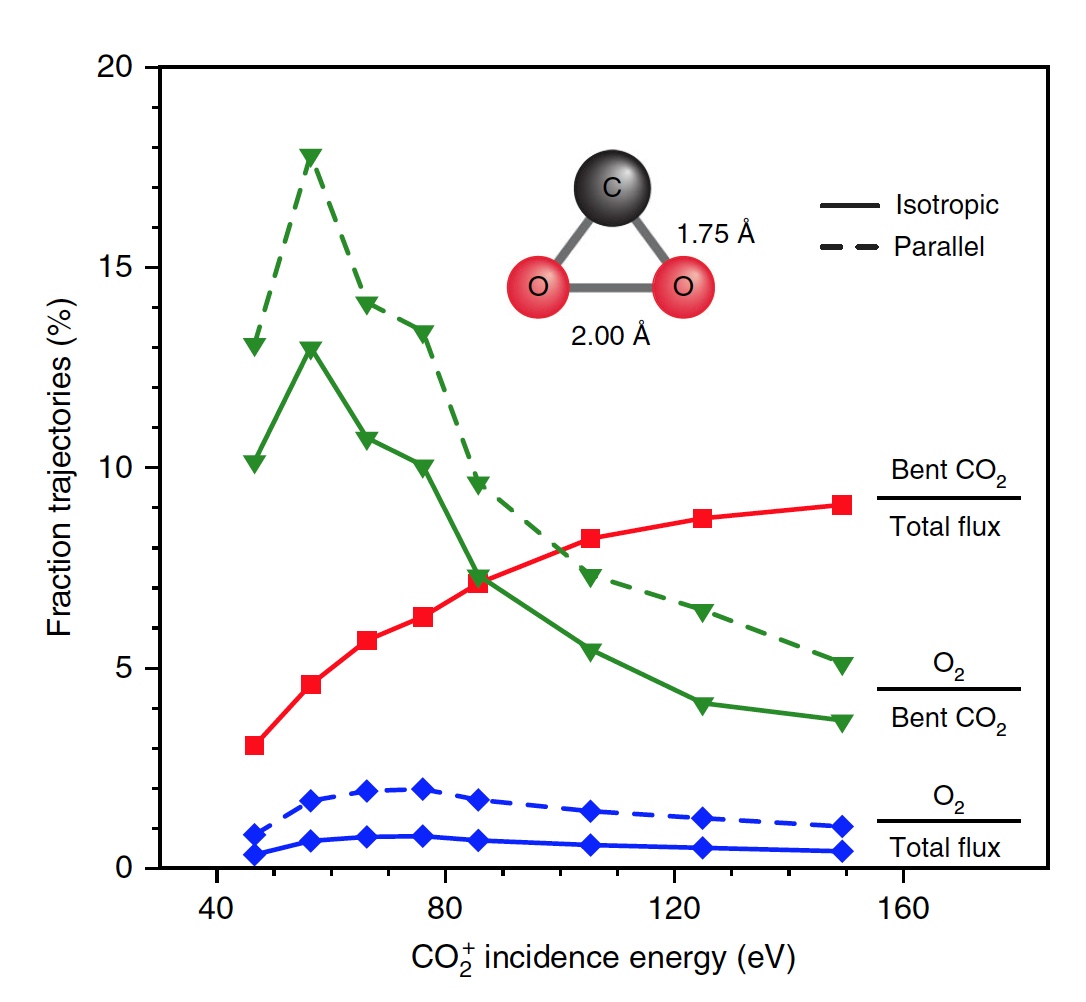
Изображение №4
Ученые отмечают, что из всех изогнутых молекул СО2 лишь 13 процентов производят кислород. То есть общий результат диссоциации CO2 → C + O2 составляет 0,6% при E0 = 56,4 эВ. Если же увеличить энергию падающих частиц, то можно получить О2 до 0,8 ± 0,2% при E0 ~ 70 ± 15 эВ (синяя линия на изображении №4).
Кроме того, доля O2-образующих траекторий существенно возрастает, когда достигается сильно изогнутое промежуточное состояние CO2 (зеленая линия), достигая максимума в 13% при E0 ~ 55 ± 10 эВ. Меньший суммарный выход нейтрального O2 обусловлен тем, что лишь небольшая доля линейных молекул CO2 достигает сильно изогнутого состояния (красная линия). Если же специально изменить ориентацию поступающих молекул СО2 (ось, параллельная поверхности), то в результате можно получить на 2% больше О2 (пунктирная зеленая линия).
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых.
Эпилог
Данный труд продемонстрировал, что посредством нестандартных химических реакций можно получить кислород из углекислого газа. Никто не будет спорить, что подобная методика требует дальнейших доработок и усовершенствований. Однако нельзя отрицать и факт того, что сей труд действительно открывает новые возможности для межпланетных путешествий, колонизации Марса и не только. На нашей родной планете также есть проблема с кислородом и углекислым газом. Скорее с последним, ибо его объем значительно возрос с момента индустриализации. А учитывая то, что СО2 является одним из основных виновников глобального потепления, уменьшение его количества и получение из него кислорода звучит как очень заманчивая идея. Раз уж мы никак пока что не можем обойтись без заводов, фабрик, машин с двигателями внутреннего сгорания и прочего, то новые методы очистки нашей атмосферы не просто нужны, а крайне необходимы. Ибо путешествия на далекие планеты это конечно круто, но до массового переезда на Марс еще очень и очень далеко, посему стоит больше думать о Земле, на которой мы живем, чем о Марсе, о котором мечтаем.
Благодарю за внимание, оставайтесь любопытствующими и хорошей всем рабочей недели, ребята! 🙂
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас оформив заказ или порекомендовав знакомым, 30% скидка для пользователей Хабра на уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5-2650 v4 (6 Cores) 10GB DDR4 240GB SSD 1Gbps от $20 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?
Источник


