
Совсем недавно коллективу исследователей удалось получить первое соединение гелия – вещества, атомы которого, как долго полагали химики, никогда не смогут образовывать
связи с другими.
Немного истории.
Спектральный анализ позволил в конце 19 века открыть группу элементов, простые вещества которых являются газами при обычных условиях. Вначале места для этих элементов в Периодической системе не находилось, однако вскоре для них всё же выделили нулевую группу, впоследствии ставшую восьмой, а потом – восемнадцатой.
Долгое время, более полувека, химия этих элементов оставалась пустым множеством, так как образованные ими простые вещества ни с чем не реагировали. По этой причине элементы, помещённые в нулевую группу, называли инертными, или благородными, газами.

Причин крайне низкой реакционной способности атомов этих элементов несколько. Разберёмся в них чуть детальнее.
При образовании связи атом может как отдавать электрон(ы), так и присоединять.
Атомы благородных газов очень неохотно присоединяют электрон, так как их электронные оболочки полностью заполнены и имею конфигурацию ns2np6 при n≥2, где n – номер периода (электронная конфигурация гелия – 1s2). Таким образом, энергия орбитали, куда мог бы попасть электрон, т.е. орбитали (n +1)s1, насколько высока, что энергетический выигрыш от его присоединения не просто ничтожен, но даже и отрицателен. Иными словами, чтобы присоединить электрон к атомам благородных газов, надо затратить энергию, поэтому отрицательна их энергия сродства к электрону.
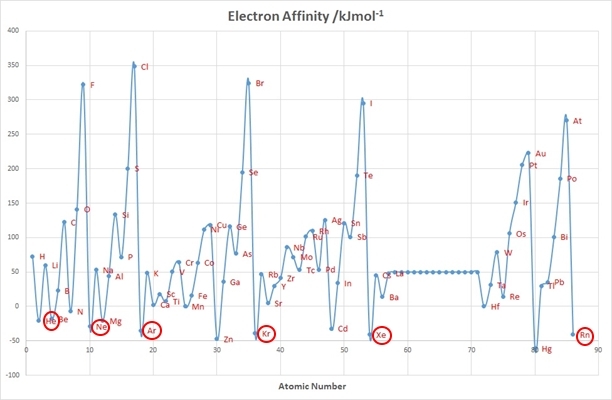
Зависимость энергии сродства к электрону от атомного номера.
В то же самое время атомы благородных газов очень неохотно отдают свои электроны, то есть имеют крайне высокие значения энергии ионизации. Это связано с тем, что малы радиусы их атомов, из-за чего электроны сильно притягиваются к ядрам.

Зависимость первой энергии ионизации от атомного номера.
Прорыв в химии благородных газов случился в 1962 г, когда канадский исследователь британского происхождения Нил Бартлетт получил первое соединение благородного газа ксенона с формулой Xe[PtF6] (на самом деле его формулу правильно записывать в виде [XeF][PtF5]). С тех пор химия благородных газов интенсивно развивалась: получены соединения радона, ксенона и криптона.
Ещё около десятка лет тому назад на вопрос о перспективности получения соединений так называемых лёгких благородных газов, аргона, неона и гелия, наш профессор, преподававший общую и неорганическую химию, давал такой ответ: «Наиболее вероятно, что скоро будут получены соединения аргона, крайне маловероятно такое для неона, а гелий, по всей видимости, навсегда останется благородным».
Уже в 2014 году получено первое соединение аргона, гидрофторид H-Ar-F, которое, правда, устойчиво лишь при крайне низких температурах (десятки кельвинов) в отличие от
соединений тяжёлых благородных газов, которые вполне стабильны, и их, как говорят мои коллеги, «можно держать в руках». Конечно, в прямом смысле держать их в руках я не советую, так как они обладают высокой окислительной способностью, и некоторые из них могут вызывать ожоги и отравления, а некоторые разлагаются со взрывом.
В 2017 году беда пришла, откуда не ждали: химической связи, как предполагается, поддался самый лёгкий благородный газ – гелий. Что интересно, получено его соединение отнюдь не с более электроотрицательным элементом, например, со фтором, а, кто бы мог подумать, с натрием!
Получение соединения гелия, Na2He, осуществлено при использовании сверхвысокого давления, около 160 ГПа, в матрице алмаза. Несмотря на то, что существование соединения подтверждено рентгенограммой, работа была принята в печать только спустя 3 года после первой подачи статьи. Учитывая, что химией сверхвысоких давлений занимается очень небольшое число исследовательских групп, и синтез такого соединения, неустойчивого при обычных условиях, представляет (пока, во всяком случае) исключительно теоретический интерес, повторён этот эксперимент ещё не был.
Итак, что же представляет собой полученное соединение в структурном плане?
Если описывать его в кристаллохимических терминах, то говорят, что Na2He кристаллизуется в решётке флюорита. Атомы гелия образуют плотнейшую упаковку и расположены в узлах гранецентрированной кубической примитивной ячейки. Атомы натрия находятся в тетраэдрических пустотах.
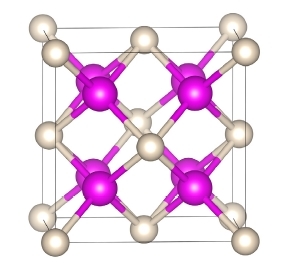
Структура Na2He. Розовым цветом обозначены атомы натрия, а серым – атомы гелия.
Однако известно, что структура флюорита нестабильна при высоких давлениях, так как не является плотнейшей в виду наличия октаэдрических пустот. Каким же образом Na2He может существовать в решётке флюорита при столь высоких давлениях, не претерпевая фазового перехода из-за сжатия?
Оказывается, Na2He представляет собой электрид, т.е. соединение, в узлах кристаллической решётки которого находятся электроны. Именно они и занимают октаэдрические пустоты флюоритовой решётки, тем самым, судя по всему, придавая ей несжимаемость при сверхвысоких давлениях. Но в отличие от классических электридов, в октаэдрических пустотах Na2He обитают не единичные, а спаренные электроны.
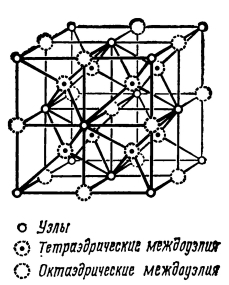
Описание химической связи вообще, а в таких «сложных» соединениях, как Na2He, и подавно, представляет серьёзную проблему даже для специалистов, но я попытаюсь упрощённо описать то, что происходит при образовании такого экзотического соединения. Надеюсь, Малликен в гробу не перевернётся.
Весьма и весьма условно структуру Na2He можно представить себе включающей положительно заряженный остов из ионов натрия, как в металлическом натрии, но с той разницей, что валентные электроны не шарятся по всему кристаллу, а локализованы, как было сказано, в октаэдрических пустотах, уравновешивая положительный заряд остова. Препятствуют объединению электронов в электронный газ атомы гелия, которые «вбиты» в данную структуру под огромным давлением и заставляют электроны сидеть по своим местам, не рыпаясь.
К сожалению, при понижении давления соединение распадается, что затрудняет его более подробное изучение. Здравый химический смысл заставляет думать, что стабилизировать электронную пару в решётке Na2He могут атомы, легко принимающие электроны, например атомы кислорода. Расчёт подтверждает возможность существование соединения Na2HeO в диапазоне давлений 10-100 ГПа, поэтому будем продолжать следить за развитием событий в области химии лёгких благородных газов.
Оставайтесь на связи.
Ссылка на исследование:
http://www.nature.com/nchem/journal/vaop/ncurrent/full/nchem.2716.html
Источник


