У научного сообщества современности очень много работы: от поисков разумной жизни за пределами Земли и ловли темной материи до исследования глубин океанов и поисков новых видов существ. Но человеку не нужно отправляться в безграничный космос или погружаться во мрак океанических глубин, чтобы столкнуться с еще одной загадкой, которую многие годы пытаются разгадать ученые. Речь, конечно же, о мозге. Эта сложная система, отвечающая буквально за все, что происходит в нашем теле, до сих пор остается не полностью описана. Многие методы изучения, к сожалению, нельзя применить к мозгу человека из-за практических или этических ограничений. И тут на помощь приходят мозговые органоиды — модельные системы, которые имитируют работу мозга человека. Группа ученых из университета Джонса Хопкинса (Балтимор, США) создали миниатюрную версию электроэнцефалографа для проведения ЭЭГ мини-мозга. Из чего состоит устройство, как оно работает, и какие результаты показывает? Ответы на эти вопросы мы найдем в докладе ученых. Поехали.
Основа исследования
Как было сказано в прологе, изучение мозга напрямую сопряжено с рядом ограничений, к числу которых относятся и этические. Использовать вместо мозга человека мозг другого существа также не решает проблему, так как всегда будут межвидовые отличия.
Именно потому создание моделей мозга человека in vitro («в пробирке») из реальных клеток стало крайне многообещающим вариантом решения проблемы. Такие модели называют органоидами мозга.
Но создать мини версию мозга мало, необходимо создать устройства, которые могут быть использованы для регистрации электрической активности для оценки их функциональности и физиологической значимости.
В связи с этим были разработаны MEA (multielectrode arrays) — многоэлектродные решетки для неинвазивной и высокоскоростной регистрации и картирования сети потенциала внеклеточного электрического поля. Проблема в том, что такие MEA можно использовать с монослойными структурами, так как в них задействованы плоские электроды. А это значительно ограничивает площадь поверхности контакта, если использовать трехмерные органоиды.
Авторы рассматриваемого нами сегодня труда нашли решение этой проблемы и создали интегрированную в кремниевую пластину самоскладывающуюся полимерную MEA-оболочку для органоидов мозга. Проще говоря, они создали MEA, напоминающий шлем, который отлично подойдет для изучения объемных органоидов.
Результаты исследования
Создание MEA-оболочки
Как говорят сами ученые, на создание трехмерных электродов-оболочек их вдохновили макроскопические электроэнцефалографические (ЭЭГ) шапочки, которые используются для изучения электрической активности человеческого мозга. Эти шапочки обычно состоят из гибких материалов с несколькими металлическими электродами, покрывающими всю кожу головы, что позволяет производить выборку электрических сигналов со всей ее трехмерной формы.

Изображение №1
Разработанный MEA действовал по такому же принципу, состоя из листов, которые могут оборачиваться вокруг поверхности органоидов мозга.
Процесс изготовления MEA состоял из нескольких этапов (1A):
- нанесение жертвенного слоя;
- формирование схемы первого слоя SU8;
- формирование схемы золотой проводки;
- формирование схемы второго слоя SU8;
- формирование схемы электродов PEDOT:PSS;
- растворение жертвенного слоя и предварительная обработка;
- стерилизация и размещение в клеточной среде;
- размещение органоидов и самосборка.
Было изготовлено восемь оболочек с тремя электродами в каждой на 3-дюймовой кремниевой (непрозрачной, покрытой SiO2) или кварцевой (прозрачной) пластине (1B).
SU8 был использован в данной разработке, так как является популярным негативным фоторезистом*, который широко используется в микрофлюидике и микроэлектромеханических системах. На 1C и 1D показаны SU8 лепестки до и после самосборки.
Фоторезист* — полимерный светочувствительный материал. В негативных фоторезистах, проэкспонированные области полимеризуются и становятся нерастворимыми, так что после проявления растворяются только не проэкспонированные области.
Золото для проводки было выбрано из-за его высокой электропроводности и хорошей биосовместимости. Также на электрод было добавлено проводящее полимерное покрытие PEDOT:PSS, что уменьшает импеданс и сводит к минимуму несоответствие модуля для контакта MEA/органоид (1E).
Характеристика органоидов мозга
Органоиды мозга, использованные в данном исследовании, были созданы из плюрипотентных стволовых клеток (iPSC, линия NIBSC8).

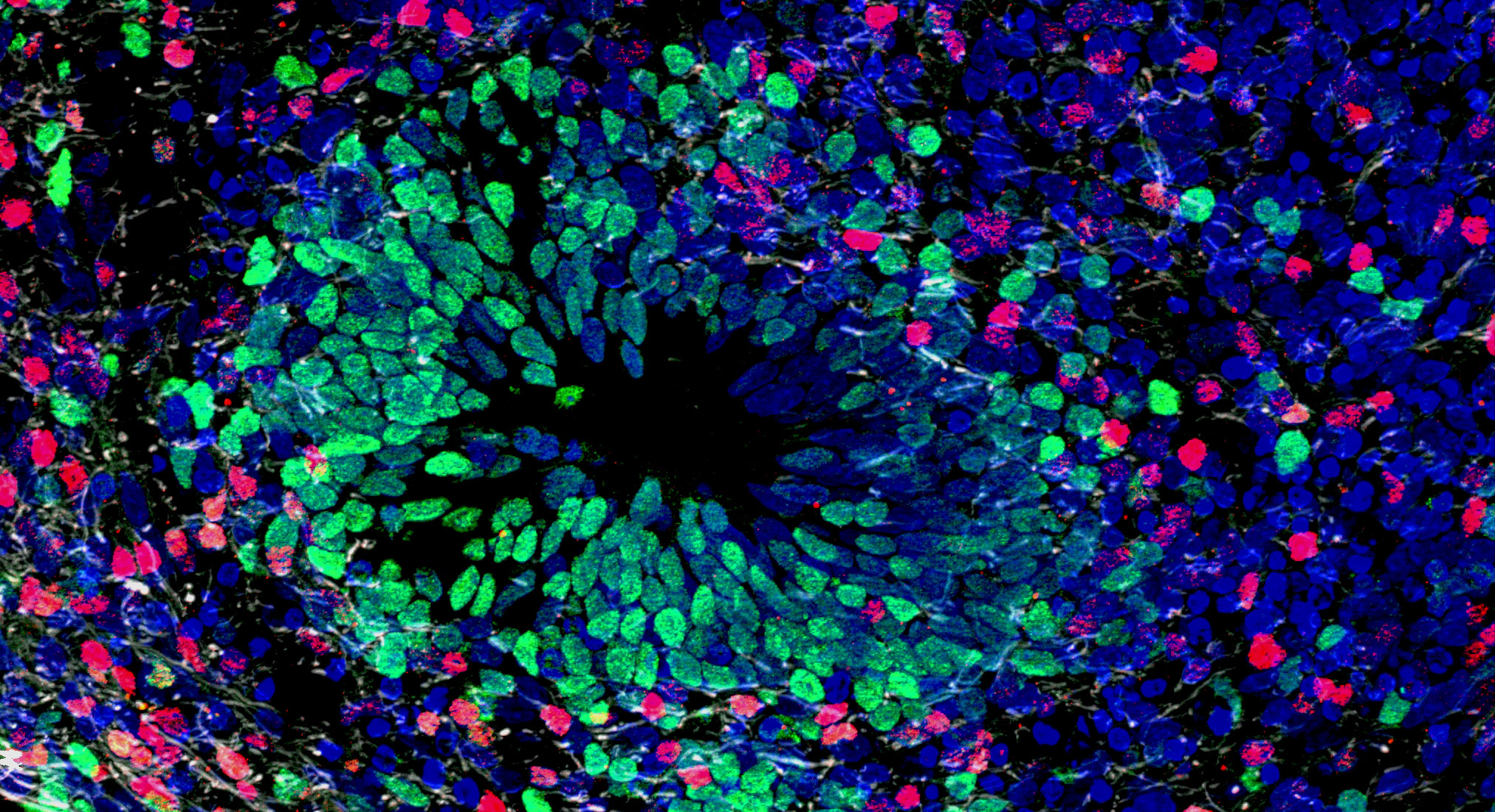
Изображение №2
Первым делом были дифференцироны нейропрогениторные клетки (NPC от neuroprogenitor cell), затем клеточную суспензию NPC использовали для формирования трехмерных органоидов мозга при постоянном вращательном встряхивании в течение 8–10 недель, как описано ранее. Зрелые органоиды гомогенны, размером от 400 до 600 мкм и состоят из нейронов, астроцитов и олигодендроцитов (изображение №2).
На 2A и 2B показаны 8-недельный органоид мозга, окрашенный нейронными маркерами белка, ассоциированного с микротрубочками 2 (MAP2) и β-III-тубулином (зеленый), маркером Nestin (красный) и маркером глиального фибриллярного кислого белка (GFAP) (красный).
На 2C показана экспрессия генов нейральных маркеров дифференцировки с течением времени, охватывающая стадии NPC до 10 недель дифференцировки. Созревание с течением времени привело к увеличению маркеров зрелых нейронов [нейрональных ядер (NeuN)], астроцитов (GFAP) и олигодендроцитов [основного белка миелина (MBP)] и снижению маркеров нейропредшественников (Nestin).
Наличие зрелых нейронов, астроцитов и зрелых олигодендроцитов является ключом к функциональности органоидов головного мозга, которая измеряется электрической активностью системы. Созревание нейронов обеспечивает усиление образования синапсов, а астроциты поддерживают этот процесс. Олигодендроциты обеспечивают миелиновые оболочки вокруг аксонов, которые уменьшают утечку ионов и нужную электрическую емкость клеточной мембраны для эффективной передачи электрического сигнала.
Настройка электродов
Дабы создать эффективную конструкцию для самосборки были использованы численное моделирование и данные практических опытов. Оптимальный вариант MEA оболочки должен соответствовать внешнему контуру изучаемых органоидов мозга, как шапочка, используемая в ЭЭГ. Критические параметры, которые контролируют угол сгиба, включают толщину двойного слоя SU8 и воздействие ультрафиолета (УФ).

Изображение №3
В ходе моделирования ученые могли менять параметры конструкции независимо друг от друга (общий размер, геометрия электрода, толщина слоев и восприятие УФ).
Для типичных MEA оболочек (1C) было проведено моделирование, чтобы сравнить и экспериментальными результатами, а также изучить влияние толщины двойного слоя SU8 и разницы в энергии воздействия между ними на окончательную форму сложенной оболочки (3A). Данные показали, что складчатость увеличивается (т.е. меньший радиус кривизны) по мере уменьшения толщины.
Кроме того, разница в энергии воздействия между бислоями SU8 также сыграла важную роль в конечной трехмерной форме электрода. По мере увеличения энергии воздействия верхнего слоя общая складчатость уменьшается. Разница в энергии воздействия между бислоями SU8 создает общий градиент полимеризации по бислою. Градиент полимеризации вызывает несоответствие деформации по толщине двойного слоя и обеспечивает изгибающий момент для спонтанного складывания двойного слоя SU8. Из этого следует, что в будущем можно будет создавать подобные трехмерные электроды-оболочки в масштабе от 100 до 10 см.
Далее было проведено сравнение результатов моделирования и экспериментов трех вариантов бислоя SU8 с разной толщиной и УФ-облучением верхнего слоя: 4.6 мкм, 180 мДж/см2; 6.0 мкм, 180 мДж/см2 и 8.0 мкм, 120 мДж/см2. При этом нижний слой всегда был одинаков (240 мДж/см2). Ввиду разных условий бислой складывался также по-разному (3C).
Затем ученые проверили, как электроды-оболочки удерживают органоиды разных размеров (диаметр: 400 мкм, 500 мкм и 600 мкм; 3B). Во всех вариантах и моделирование, и практические опыты показали, что органоиды отлично инкапсулировались внутри электродов-оболочек (3D, 3E).
Также был проведен тест на цитотоксичность, который показал полную биосовместимость самосборных электродов-оболочек.
Практические опыты

Изображение №4
На этом этапе исследования ученые провели запись трехмерной пространственной электрофизиологической активности органоида мозга через электроды на каждом лепестке оболочки. Органоид возрастом 9 недель помещали в центр электродов-оболочек во время самосборки, что позволяло окутывать органоид лепестками с электродами PEDOT:PSS (4B). Вокруг устройства помещали стеклянный цилиндр для удержания клеточной среды. Выходы электродов были изготовлены для сбора сигнала (4A).
Три электрода PEDOT:PSS на лепестках смогли успешно зарегистрировать потенциал поля органоида (4C). На графике 4D показана запись спонтанной активности органоида мозга внутри оболочки. Форма волны указывает на среднюю продолжительность пика в 2 мс с различной амплитудой во время записи (4E). Как отмечают ученые, качество записи можно улучшить, если добавить в лепестки больше электродов.
Подтвердить, что записанный сигнал исходил именно от органоида, удалось с помощью добавления в культурную среду нейротрансмиттера глутамата. Пики SNR до и после применения глутамата показали статистически значимое усиление (медиана увеличилась на 57.6%) амплитуды сигнала (4F).
Чтобы доказать преимущества 3D-конфигурации электродов против классических двумерных, ученые создали массив из 4 электродов на нижней поверхности в дополнение к трехмерным MEA электродам-оболочкам.
В предыдущих исследованиях исследователи сравнивали 3D-записи с обычными 2D-записями, но делалось это на разных органоидах. В данном же труде ученые провели записи, используя одинаковые органоиды. Для этого опыта использовались и обычные двумерные системы MEA, и MEA оболочка в развернутом виде (до самосборки). Оба варианта показали одинаковую продолжительность всплесков активности примерно в 2 мс. Из этого следует, что разработанная система электродов-оболочек может работать в двух режимах записи — в двумерной и в трехмерной.
Кроме того, трехмерная система электродов обеспечивает большую площадь контакта и более широкое распределение по органоиду, чем двумерные системы.
Авторы разработки отмечают, что с помощью их методики можно складывать дистальные электроды в проксимальные электроды с трехмерным пространственным распределением. Из-за различий в образцах органоидов мозга систематическое исследование различий между записью с 2D (предварительно сложенных) электродов и 3D (сложенных) оболочечных электродов является сложной задачей, которую ранее никто особо не пытался решить.

Изображение №5
Поэтому было решено разработать систему электродов и провести эксперименты, в которых есть как 2D-электроды (№ 4, 5, 6 и 7 на 5A), так и трехмерные оболочечные электроды (№ 1, 2 и 3 на 5A), способные одновременно регистрировать сигналы от одного и того же органоида. Это также позволило исследовать влияние расстояния между электродом и органоидом мозга.
Перед процессом складывания все электроды находились на равном расстоянии от центра плоской оболочки (5A). Как только MEA оболочка складывалась, лепестки инкапсулировали органоид, так что определенные электроды были проксимальны к нему (5B), а другие — нет.
В случае использования классических двумерных систем достичь такого нельзя, так как расположение органоидов нельзя точно контролировать, а единственное проксимальное расположение электрода находится только в нижней части сферического органоида.
Еще одним важным отличием 2D и 3D систем заключается в том, что в первом случае для закрепления органоидов на плоской поверхности электрода применяется адгезивный белок или Matrigel покрытие. В случае 3D систем в этом просто нет надобности.
Оболочка трехмерной системы удерживает органоид и сохраняет его относительно стабильным по сравнению с 2D MEA во время движения с электродами, проксимальными к органоиду. Кроме того, отсутствие поверхностного покрытия в 3D MEA предотвращает миграцию отдельных клеток из органоидов и рост нейритов, что неизбежно в 2D MEA. Таким образом, в 2D MEA даже отдаленные электроды будут соприкасаться с неизвестным количеством клеток и нейритов, что приведет к значительной неточности записей.
В проведенных опытах (5A) отдаленные двумерные электроды не соприкасались с клетками или нейритами. Были записаны потенциалы поля от четырех 2D-электродов и трех 3D-электродов (5C).
С помощью пяти этапов спонтанной записи трех различных органоидов мозга было обнаружено 7785 пиков от трехмерных оболочечных электродов и 2025 пиков от двумерных плоских электродов. Из этого следует, что трехмерные электроды во время самосборки для приближения к трехмерному органоиду могут обнаруживать куда больше сигналов, чем удаленные от поверхности органоида плоские электроды (5D).
Дополнительные тесты с применением стимуляции органоидов глутаматом также подтвердили, что 3D-электроды обнаружили значительно более сильное увеличение электрофизиологической активности, чем 2D-электроды (5F).
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых и дополнительные материалы к нему.
Эпилог
В рассмотренном нами сегодня труде ученые, вдохновленные электроэнцефалографом, применяемым в ЭЭГ, разработали его миниатюрную версию. Данное устройство является комбинацией электродов, встроенных в систему лепестков, которые могут складываться, образуя оболочку. Внутри этой оболочки может быть размещен органоид мозга.
Изучение органоидов и записи сигналов их активности уже проводятся не первый год. Однако ранее для этого использовались двумерные системы электродов, что вносит ряд трудностей, учитывая трехмерность самих органоидов. Представим себе мячик, лежащий на доске. Площадь контакта мяча и доски крайне мала. С органоидами происходило то же самое. А чем меньше площадь контакта, тем меньше сигналов удастся уловить.
В случае с разработанной трехмерной системой электродов площадь контакта намного больше, так как оболочка из нескольких лепестков с электродами буквально обволакивает органоид. При этом для его фиксации даже не нужно использовать какие-либо адгезивы.
Созданная система позволяет получать больше данных от исследуемого объекта, при этом точность этих данных также будет значительно выше, чем в случае применения двумерных электродов. Следовательно, многие исследования, проводимые в наши дни, не только ускорятся, но и станут значительно дешевле. Если же говорить о мозге человека, то данная разработка позволит нам больше узнать о его работе, пусть даже на примере органоидов.
Немного рекламы
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99, уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5-2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Maincubes Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?

