Эта статья продолжает серию статей о глубокой модификации ДНК в недалёком будущем для решения серьёзных проблем человечества. Первая статья — тут.

TL-DR: Все программисты знают, что есть масса способов решить одну и ту же задачу. То же самое скоро будет и в биоинформатике: есть тысячи способов изменить геном так, чтобы получился новый «сложный признак». ДНК-код так же пластичен и универсален как и компьютерный код. Одним из первых применений “перепрограммирования на уровне ДНК” может стать способность нейронов восстанавливать свою функцию после повреждения (разрыва аксона), что позволит десяткам тысяч парализованных инвалидов-колясочников в буквальном смысле встать на ноги. При этом, как и в случае с привычным нам компьютерным кодом, добиться решения задачи можно несколькими способами — некоторые из которых — такие, как многоядерные нейроны, сращение синапсов на дендритных деревьях, активизация макрофагов для сращения — будут рассмотрены ниже, в данной статье.
Обсудим перспективы того, как применение генно-инженерных технологий в практической медицине недалекого будущего сможет оградить людей от порезов и параличей. Вначале — неутешительный взгляд на то, что мы имеем сегодня.
Только в США, где имеется подробная статистика и достаточно современная система оказания медицинской помощи, насчитываются десятки тысяч “инвалидов-колясочников”.
Многие из них имеют “отключенные ноги” — из-за механического поперечного перерыва спинного мозга. Современная нейрохирургия добилась успехов за счет того, что на одно полное повреждение — механический полный перерыв спинного мозга — приходилось десять, а то и больше сдавлений спинного мозга, которые приводили к последующей гибели фрагмента мозга за счет нарушения кровоснабжения. Поэтому при быстром оказании помощи, пока еще не все нейроны погибли от недостатка кровоснабжения, сдавления спинного мозга можно лечить.
Представим, что спинной мозг — это жгут из проводов, содержимое бетонной кабельной шахты, в центре которой ещё и серверные стойки. И при травме обломки этого короба деформируют, натягивают часть кабелей и плотно забивают промежутки, затрудняя теплоотвод, а где-то перебивают токоподающие провода (сосуды).
Строители — ремонтники (нейрохирурги) научились в случае аварии восстанавливать функции опоры — эти бетонные (костные) стенки — удалять осколки позвонков, соединять их, восстанавливать медные провода электроснабжения. А вот соединение прерванного оптоволокна (нервов) — это до сих пор нерешённая задача.
Другое дело, что починка “стенок шахты” в первые часы или даже сутки после травмы оказывалась эффективна в девяти случаях травм из десяти. Но в оставшихся случаях механического перерыва спинного мозга или периферического нерва прогноз, несмотря на повышение уровня хирургической техники, остаётся неутешительным.
Добиться сколько-нибудь функционально удовлетворительного сращения спинного мозга после механического перерыва у людей не удалось пока никому, хотя получить модель для проверки на опытных животных просто, а задача эта столь актуальна и очевидна, что постоянно идет информационный шум о том, что вот-вот произойдет прорыв. Однако достоверно воспроизводимых “вау-результатов” как не было, так и нет.
Современное состояние проблемы в области сращивания спинного мозга
Предлагается также подход по сращению повреждённого спинного мозга и нервов при помощи так называемых фьюзогенов (от fusion — слияние). Это — составы, обычно гелеобразные (на основе хитозана или полиэтиленгликоля), которые заполняют место повреждения, как бы «склеивая» концы раны. Предположительно, действие фьюзогенов обусловлено 3 механизмами: предотвращение роста соединительной ткани (рубца, который делает невозможным дальнейший рост нервов), подавление воспаления и апоптоза здоровых нейронов, соседних с повреждёнными, и повышение частоты прямого слияния перерезанных аксонов.
В работе [Yang Z, Zhang A, Duan H, Zhang S, Hao P, Ye K, et al. NT3-
chitosan elicits robust endogenous neurogenesis to enable functional recovery after spinal cord injury. Proc Natl Acad Sci U S A 2015;112:13354-9.] показана возможность восстановления спинного мозга крыс после его перерезания и вырезания участка длиной 5 мм, если этот участок заполнить хитозановым гелем с нейротропином (фактором роста нервной ткани). Функциональность восстанавливалась на 12-13 баллов по шкале BBB [https://www.liebertpub.com/doi/10.1089/08977150260338038] за полгода (против 2-3 балла у контрольной группы, здоровому спинному мозгу соответствует результат 21 балл).
Показана эффективность полиэтиленгликоля в предотвращении повреждения спинного мозга после сдавления [Behavioral recovery from spinal cord injury following delayed application of polyethylene glycol/ Richard B. Borgens*, Riyi Shi and Debra Bohnert The Journal of Experimental Biology 205, 1–12 (2002)].
Группа Сергио Канаверо провела ряд исследований, показавших возможность частичного восстановления после перерезания спинного мозга [Ye, Yijie; Kim, C-Yoon; Miao, Qing; Ren, Xiaoping (2016). Fusogen-assisted rapid reconstitution of anatomophysiologic continuity of the transected spinal cord. Surgery, (), S0039606016300241–.doi:10.1016/j.surg.2016.03.023]. Степень восстановления достигала 13 баллов за 3 недели, против 3 баллов в контроле.
Итак, у нас проблема: в организме есть уродские клетки – нейроны. Вообще все виды клеток по-своему уродские, оптом и в розницу. А какими им еще быть, если они продукт дикой, слепой эволюции? Но даже среди других клеток нейроны, особенно нейроны человека, это что-то с чем-то…
Клетки, у которых есть отросток длиной в метр, микроскопически тонкий и нежный, неспособный к регенерации. Никакого дублирования: перебили спинной мозг — каюк всей периферии. Перебили нерв на уровне плеча — не чувствуют пальцы, не двигаются мышцы всей конечности. Причём на периферии или в месте повреждения остается с одной стороны тело нейрона со всем потенциалом жизнеобеспечения и регенерации и практически безжизненный обрубок длинного отростка, называемого аксоном, с другой стороны.
Каковы потенциальные методы решения?
Посмотрим на поперечно-полосатые мышцы: если перерезать мышцу, то будет рубец, но с обоих сторон рубца в миоците (мышечной клетке) останется по сотне ядер.
Миоциты — это особенные клетки с множеством ядер. Каждое ядро обеспечивает каждому из получившихся после травмы фрагментов клетки всю необходимую информацию для синтеза всех необходимых белков, в том числе и ремонтных.
Исходя из этого — первое решение: давайте сделаем в нейроне два или несколько ядер. Вообще клетки размножаются делением – вначале удваивается ДНК, потом удваивается центриоль, потом в каждой клетке формируется новое ядро и цитоплазма разделяется клеточной стенкой.
А в миоцитах этап деления цитоплазмы выключен.Так давайте выключим этот механизм и в нейронах, как он выключен в миоцитах, и получим двух- или многоядерный нейрон. Разрубив его пополам, мы получим два полноценных живых нейрона.
А дальше – нейроны в норме отлично отращивают синапсы на дендритах для общения друг с другом. После повреждения эти два “новорожденных нейрона” должны для начала удвоить свои ядра и протолкнуть их к месту повреждения — каждый со своей стороны. Следом на месте повреждения отрастить кучу коротких отростков дендритов — и вместо рубца получится молодой нервный узелок.
Многоядерность клеток, как много в этом слове…
Такие клетки бывают и у многих живых организмов.
Обзорная статья о клеточном слиянии в нервной системе.
Более частная статья о клеточном слиянии в мозге.
Позволим себе отвлечься на рассказ доктора будущего.
Ко мне привезли «спинальника» — человека с полным перерывом спинного мозга, который обречен пожизненно находиться в каталке, а иногда ещё и без иннервации рук. У меня перед глазами почти двухметровый 20 летний красавец — единственный сын благополучных родителей – то ли прыжок в воду, то ли вообще какая-то “автоавария”, чуть не в общественном транспорте, то есть и вечная лживая психологическая отмазка — сам виноват — не катит. В полном сознании, но не может пошевелить ни рукой, ни ногой — и никогда не сможет. Не может даже говорить. Лежит и виновато по-детски по-мальчишески улыбается — мимическая-то мускулатура иннервирована лицевым нервом — этот нерв не пострадал… И все со слезами на глазах улыбаются ему в ответ, стараясь отвернуться при обходе в реанимации, бегут дальше.. На КТ — перелом на уровне шейных позвонков — полный перерыв спинного мозга.
Да… а тут — ты такой:
— А сделали ему анализ ДНК? О, да у него же нейроны-то многоядерные, вот же — в третьей и седьмой хромосоме вставки. Так.. проверим микробиопсией из ягодичной мышцы! Ему еще и не больно же — уже.. Ну что, есть ядра на периферии — прям около мышечного синапса?
— Есть!
— На моторных нервах, и на чувствительных есть?
— Да — прямо в подкожно-жировой клетчатке, где чувствительные восходящие нервы. Отлично! Процент охвата? Ух ты, 99 процентов, не так, как в первой редакции, когда было 50 процентов на моторных и 10 процентов нейронов на чувствительных.
— … Уход, ничего больше. Поить-кормить, стул, моча. В течение недели начнет чувствовать, через месяц начнем интенсивные занятия в электронном комплексе лечебной физкультуры. Будем тренировать его вновь отросшие нервные узлы на месте перерыва серого и белого вещества спинного мозга… Через три месяца будет ходить, через полгода — крутить сальто и играть на скрипке.
— Что? До травмы не играл на скрипке, ничего, в тренажере заодно научится. А мы будем периодически на МРТ любоваться, как на месте перерыва формируется микро-неочервь мозжечка (в головном мозге, в мозжечке есть структура под названием “червь”).
— Почему назвали так? Сначала пытались назвать по аналогии с “костной мозолью” — “ нервная мозоль”, но не прижилось. А потом обратили внимание, что по сути формируется структура нервного узла, напоминающая под микроскопом и на МРТ кору наиболее филогенетически старой части коры мозжечка, называемой “червь”.
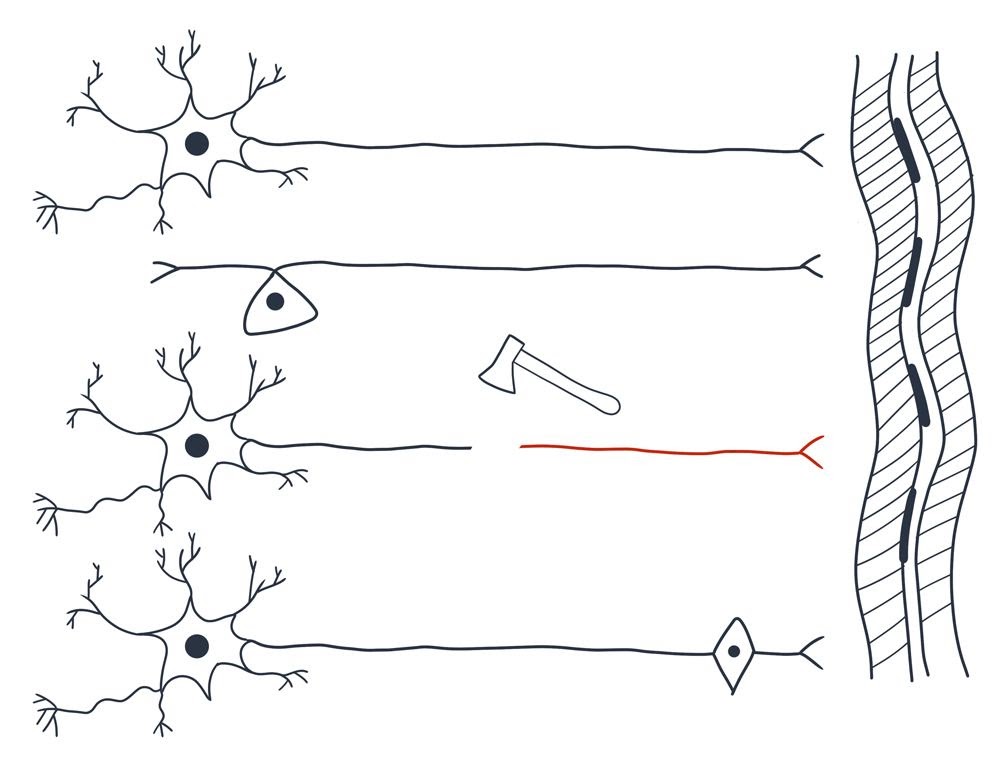
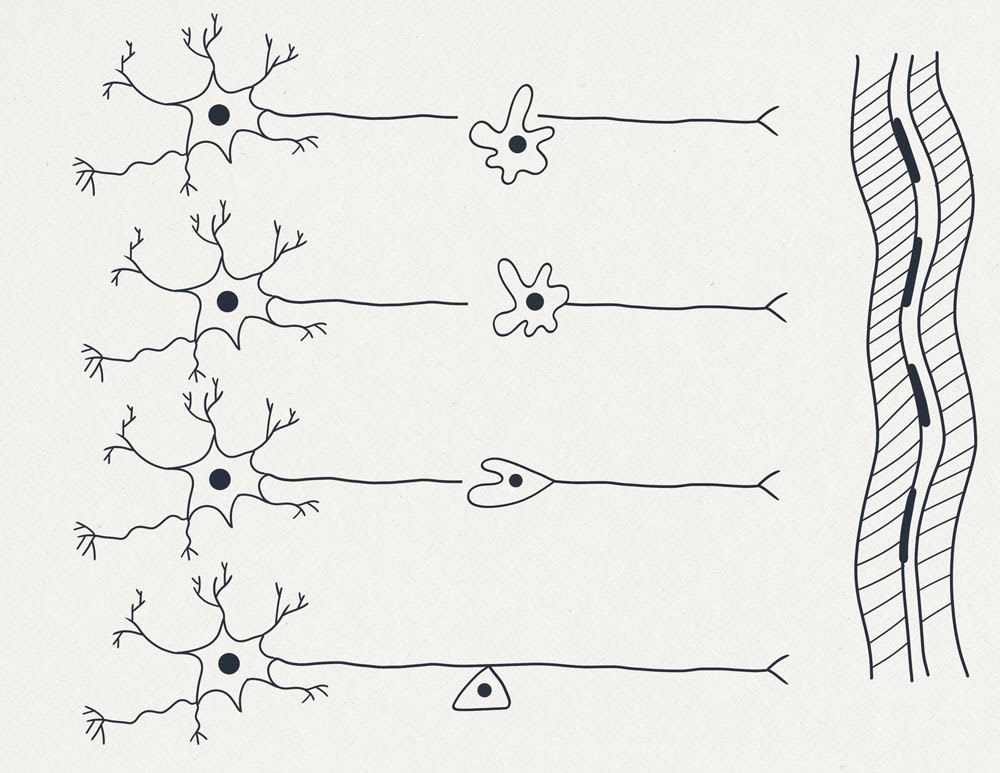
На рисунке 1 (см. выше) схематично представлены:
-
Справа — вертикально многоядерный фрагмент поперечнополосатой мышцы.
-
Вверху — две схемы “типичных нейронов”: можно обратить внимание на то что форма отростков второго нейрона — называется “Т-образной”.
-
Далее схематично изображен “топор”, перерубающий нерв или спинной мозг и отсекающий от одного из пострадавших нейронов фрагмент длинного отростка аксона. Фрагмент клетки, лишённый ядра, и многих других жизненно важных частей стойко теряет свои функции и способность к регенерации.
-
В нижней части рисунка изображен “нейрон будущего”, имеющий на периферии второе запасное ядро.
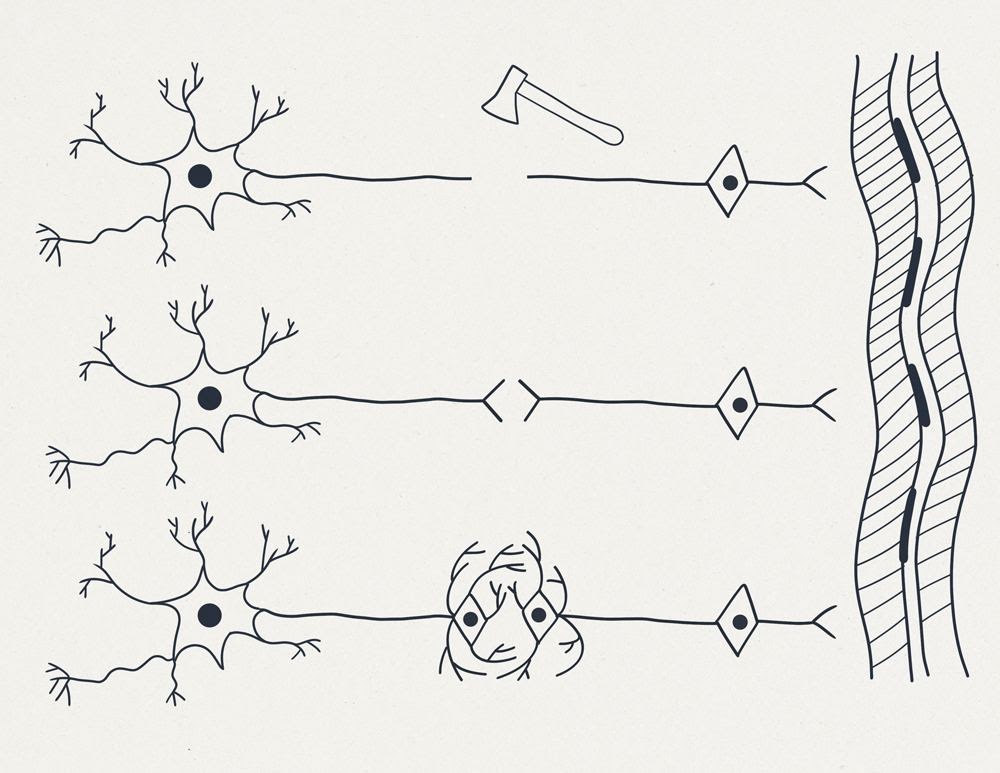
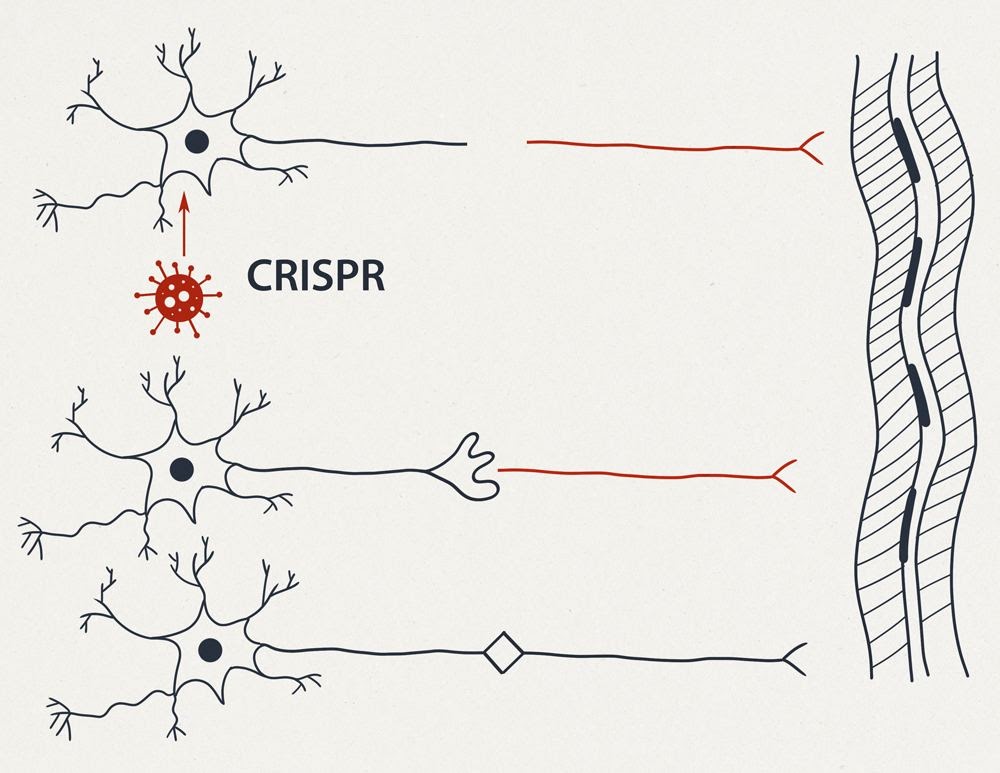
На рисунке 2 (см. выше) изображены:
-
травма наносимая генномодифицированному нейрону.
-
Ниже представлены два варианта сращения двух образовавшихся нейронов. В центре — “простое сращение” несколькими синапсами.
-
В нижней части: каждый из получившихся в результате травмы одноядерных нейронов происходит “незавершенный” митоз — без телофазы, в результате чего с каждой стороны образуются по два ядра. По одному из этих новых ядер направляются в зону повреждения, где образуется дендритная сеть синаптических контактов. Данная сеть в дальнейшем перестраивается под действием тренировок с возможностью формирования дополнительного усилителя или фильтра-преобразователя сигналов.
Собственно, на этом месте можно поблагодарить читателя за долготерпение — и считать изложение первоначального материала статьи выполненным. Но мы же утверждаем что решений может быть довольно большое множество. Поэтому позвольте продолжить наш мысленный эксперимент и прогулку по клинике будущего.
Каковы недостатки предложенного выше “идеального варианта”? Во-первых, нельзя помочь тем, кого заранее не апгрейдили, а в ближайшие 10-20 лет, на минуточку, все “спинальники” без апгрейда. Пригодится такая модификация одному на десять тысяч — тому, у кого будет несчастный случай. А делать профилактическую модификацию нужно всем, как прививку. Конечно, такой апгрейд многим полезен: больше медиаторов — дольше без утомления работают синапсы. Но давайте поищем другое решение.Главное – отказаться от выученной беспомощности, ощутить тот потенциальный океан возможностей, который дает генная инженерия. Для этого вслед за многоядерностью взглянем на “самый древний механизм отточенный эволюцией” – фагоцитоз. Это когда клетка — например амеба — высовывает отростки и “заглатывает” кусочек чего-то вкусного.
А вот уже под жуткую музыку “амебы” в нашей крови — макрофаги — поедают бактерий. Вообще они выполняют множество функций – и миллион раковых клеток каждый день пожирают, и много чего еще… А если погиб в неравном бою, или просто взял в плен какую гадость, а переварить не может, то выделит в виде гноя из миндалин. То есть уйдет и унесет врага с собой из организма. Рекомендован просмотр с четвертой минуты, но и целиком посмотреть можно.
А теперь представьте, что этот макрофаг начал жрать отрезанный обрубок нейрона “с хвоста” – с места разреза . Заглотить целиком не получится, да и обучен наш макрофаг, знает что прицепился к аксону. Точно это понял по составу липопротеидов и белков оболочки аксона и по сигналам соседних глиальных клеток.
Итак, макрофаг сливается с периферическим обрубком аксона, давая ему ядро и все инструкции по отращиванию гривы дендритов, второй такой же макрофаг может укусить центральный обрубок аксона и поселиться внутри аксона на правах второго ядра. А далее отрощенные гривы аксонов из двух макрофагов, ставших частями нейронов, соединяются. Смотрим рисунок 3:
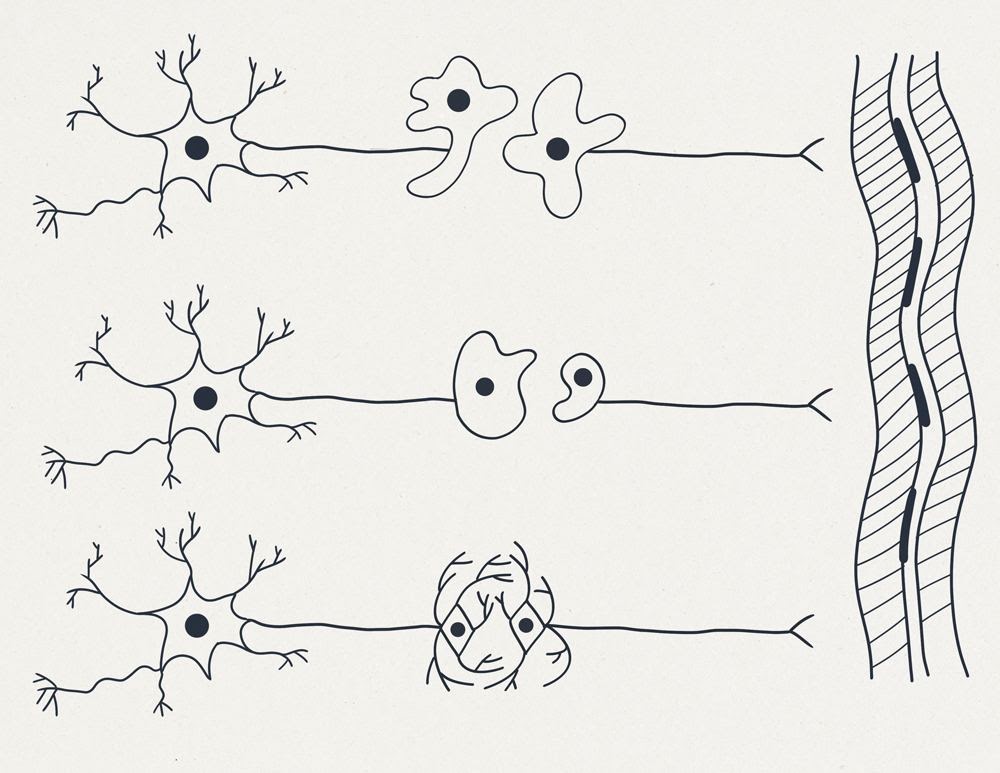
Собственно на рисунке 3 показано, как два макрофага подкрадываются к месту повреждения и выступают донорами ядер и всей другой необходимой для регенерации клеточной “машинерии”. Они превращают обрубок-аксон в полноценную клетку и, запустив программу клеточной дифференцировки, превращаются в запасные ядра нейрона”, после чего дают сеть дендритов-отростков, образуя сращение нервным узелком.
Разумеется, пытливый читатель спросит: ”а могло ли ядро в дистальном (периферическом) отростке пройти дополнительный неполный митоз, чтобы и дистальный отросток превратился в двуядерный нейрон?”
Разумеется, да! Пишем подпрограмму или дополнительную функцию в геном и ву-а-ля.
Тогда наш доктор — что велит?
— А возьмите у этого красавца немного крови, да модифицируйте макрофаги CRISPR-кассетами и ему «перекапайте». Это так в древности называли дозатор лекарств для внутривенного вливания.
— Ну да, что-то типа механических ходиков часов с гирями — тоже вес жидкости использовали, чтобы “капать”. Пока ему на смену не пришли дозаторы с электродвигателями, которые уже применялись в первой четверти 21 века. Но завораживающее действие вида капающих капель еще какое-то время позволяло “капельницам” оставаться на плаву.
Но мы отвлеклись. Можно и не брать кровь из вены и не модифицировать собственные макрофаги пациента. Долго это, для каждого пациента своя отдельная морока. Появится огромная коллекция линий генномодифицированных животных, выступающих в виде универсальных доноров. Так что в роли чинителей-спасителей, в роли доноров ядер для отрубленных частей нейронов, могут выступить и заранее подготовленные и натасканные на обрубки отростков-нейронов макрофаги генномодифицированной свиньи.
Могут быть и другие варианты донации ядер макрофагами. Возможны варианты, когда макрофаг сливается только с отрубленной частью нейрона. См. рисунок 4 ниже
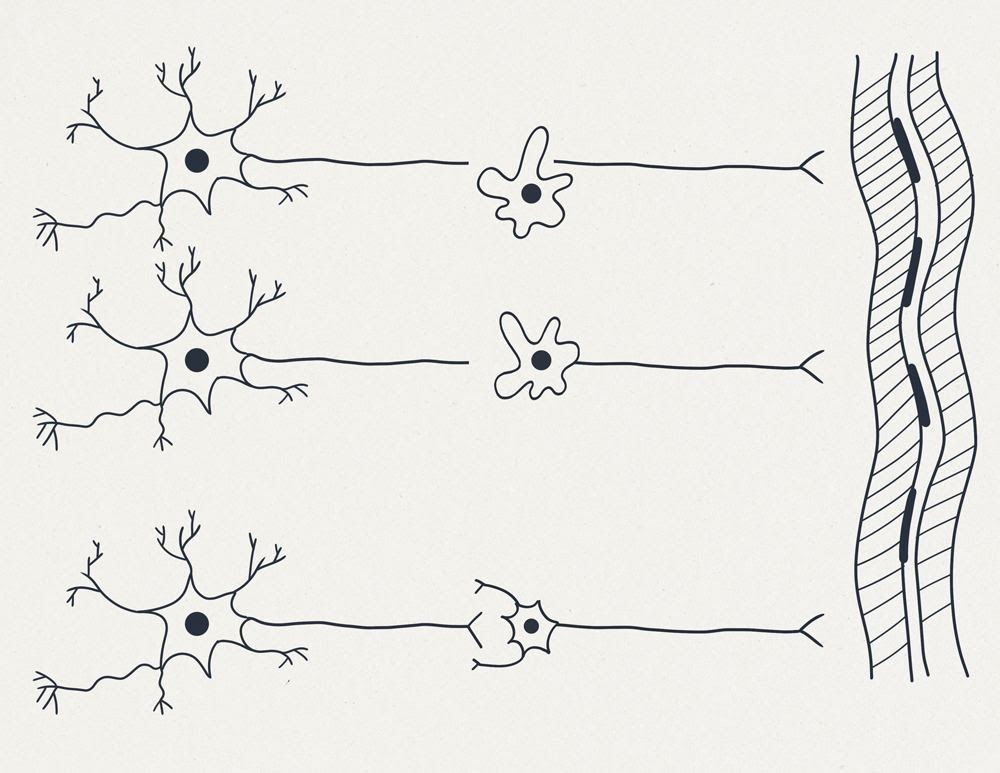
И в заключение предположим, что наш макрофаг ещё чуть-чуть поумнел. Смотрим рисунок 5. В начале он заглотил дистальный обрубок нейрона, а затем почуял центральный обрубок и “вторым ртом” захватил второй центральный обрубок. Так мы получили “первичное” безсинаптическое слияние и один двухъядерный нейрон в результате.
А может можно обойтись без второго ядра? Вот тебе и здрасьте. Вся статья затевалась, собственно, чтобы рассказать про возможность многоядерных нейронов. Но биопрограммисты – такой народ, какую прогу не дай, обязательно улучшат. Конечно, можно. Просто дадим нашему бедному нейрону (у которого обрубили аксон) стать на минуточку чуть-чуть макрофагом с помощью CRISPR-кассеты или нескольких последовательных CRISPR-кассет, и увидим замечательную картинку 6.
Ну что же — мы с вами совершили довольно красивый диалектический кульбит, предложив способ решения проблемы путем сращивания нейронов (многоядерность), затем от многоядерности перешли к теории активизации макрофагальной активности. И пришли к выводу что пути решения могут быть не только через сращение с помощью синапсов и создания многоядерных клеток, но и через генную модификацию. Кассету с генномодификационной машинерией можно поместить в нейротропный вирус — например в модифицированный вирус бешенства.
Главное – почувствовать всю глубину выученной беспомощности современной медицины и биологии и захватывающие открывающиеся возможности.
Может быть, в роли макрофагов-доноров ядер будут выступать клетки глии или клетки миелиновой оболочки, может быть нейрон будет проходить неполный митоз и посылать второе “макрофагальное ядро” к месту повреждения, и оно будет управлять захватом отрезанного аксона.
Может быть еще куча вариантов. Какой из них выберет наш доктор будущего для лечения пациента? Всё в его руках. Чтобы подчеркнуть, что данные рассуждения – уже не совсем что-то из области “дальней и сверхдальней фантастики”, а вполне себе завтрашний день, приведем пример.
С помощью генной модификации лечат, и очень успешно, серповидноклеточную анемию. Казалось бы: однобуквенная мутация в одном белке — гемоглобине. Поменяй в клетках костного мозга одну буковку и пусть человек наслаждается нормальным гемоглобином, но люди решили по-другому, и стимулируют в ростковых клетках крови ген, отвечающий за выработку фетального (детского) гемоглобина. И человек живет потом с детским гемоглобином — и счастлив.
Посмотрите на это видео: с какой жадностью одинокий нейрон “ищет друзей” и хочет объединиться синапсами в дендритную сеть.
И сколь безрадостны при этом почему-то попытки в области регенерации участков мозга и нервов. Данный парадокс может иметь фантастически красивое решение.Напоследок ещё пара идей по апгрейду нейронов.
Давайте представим, что синапсы между нейронами могут быть двух- и полимедиаторными. Синапсы сейчас выполняют роль диодов, пропуская сигнал только в одном направлении.
А хорошо бы сделать их “транзисторами” с возможностью усиления, и на двух разных медиаторах собрать возможность проведения импульса в обе стороны в синаптической щели. Чтобы афферентный нейрон (проводит сигнал от ЦНС к мышце) мог быть и эфферентным (от рецептора к ЦНС). А в аксонах двунаправленность можно гипотетически реализовать на зависимости от формы импульса потенциала действия.
А вот ещё идея. У человека нервные пути сконцентрированы в спинном мозге. Давайте посмотрим на то, как универсально устроена нервная система гидры, кишечнополостного организма. У неё нервная система распределена по всему организму и ограниченное повреждение не повреждает её функционал, так как нервные сигналы переконфигурируются (прямо как TCP-IP сеть) и всё равно приходят куда нужно. Может быть, и в человеке имеет смысл пробросить дополнительную распределенную, пусть и медленную, нервную сеточку из коротких нейронов в подкожной жировой клетчатке, но давайте вначале спасем спинальников! А изменение архитектуры биологических нейронных сетей – уже следующая история, даже оглавление следующих историй.
Заключение
На вопрос: «Может ли компьютер посчитать что-то?»
Есть один правильный ответ: «Может.»
На вопрос: «Может ли генетическая инженерия изменить клетку/организм так-то?»
Правильный ответ: “Может”.

Юрий Новиков
к.м.н, врач, сторонник генетической биоинженерии
(c) 2021 Юрий Новиков
Благодарю за помощь в оформлении идеи: Сергей Каменев, Владимир Бархатов, Валентин Перкин, Андрей Андрианов. За ссылки про слияние нервных клеток — Душана.
За изображение спасибо TripletConcept.


