
Одним из самых важных движущих факторов многих процессов в окружающем нас мире является энергия. Фактически, энергия присутствует во всем. И нет, это не эзотерическое высказывание, а чистая физика. Благодаря научным изысканиям и технологическому прогрессу мы научились преобразовать один тип энергии в другую, к примеру, кинетическую в электрическую или электрическую в механическую. Некоторые преобразования куда проще реализовать, чем другие. К более сложным относится преобразование химической энергии в механическую, так оно часто требует определенных катализаторов, занимает много времени и дает не очень ощутимый результат. Ученые из Корнеллского университета (Нью-Йорк, США) разработали новую методику преобразования химической энергии в механическую, который позволил создать самоскладывающиеся киригами-системы. Как именно было реализовано преобразование, что умеют полученные оригами, и где данная разработка может быть использована на практике? Ответы на эти вопросы мы найдем в докладе ученых.
Основа исследования
Электрохимические системы обеспечивают прямое и эффективное преобразование химической энергии в электрическую (например, топливные элементы). Однако использование химической потенциальной энергии для выполнения механической работы в инженерных устройствах обычно включает непрямые пути преобразования в жидкостях. Например, использование локализованных эффектов тепла или химических продуктов для управления фазовыми переходами или создания осмотического перепада давления. Поскольку градиенты концентрации тепла и химических веществ быстро рассеиваются (<1 с) в масштабе микрометра, такие подходы крайне плохо масштабируются.
Изображение №1
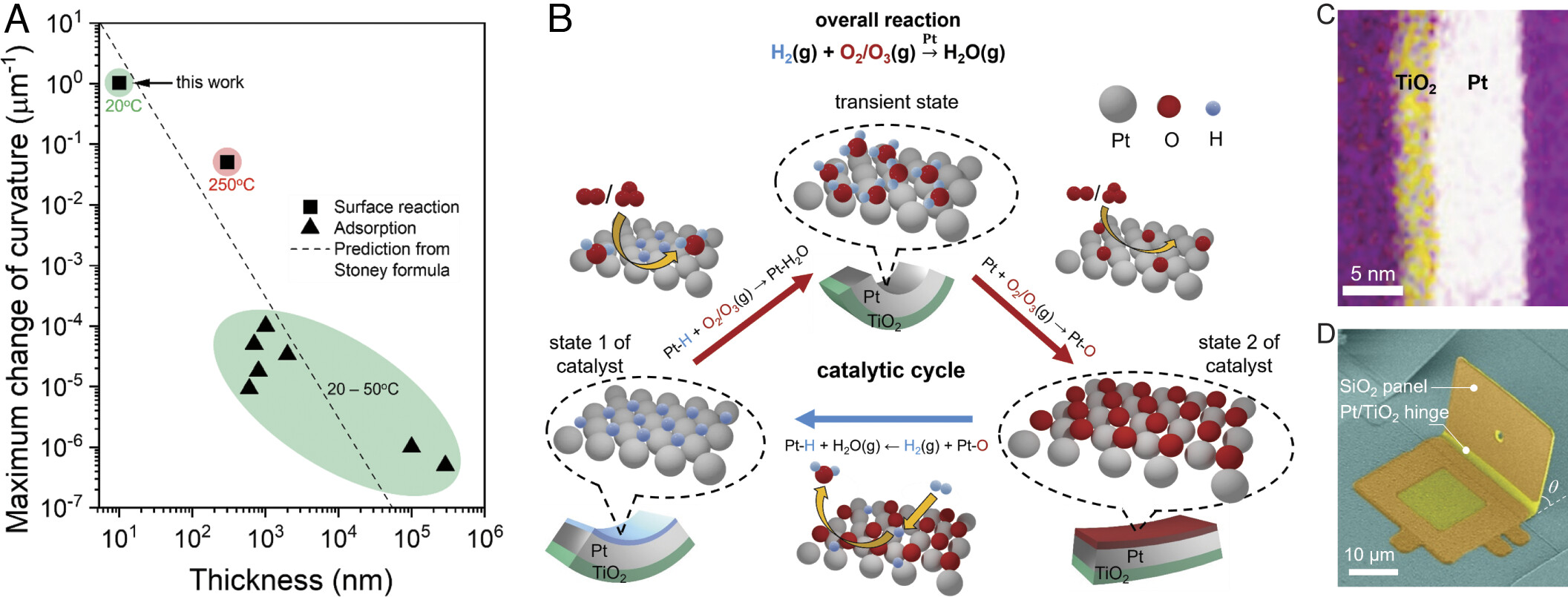
Природа преодолевает это ограничение, выполняя прямое преобразование химической энергии в механическую с помощью каталитических моторных белков: конформационные состояния белков изменяются во время кинетически контролируемых каталитических циклов для выполнения работы. Ранее уже реализовывались попытки воспроизвести этот принцип с помощью поверхностных напряжений, вызванных адсорбатом на металлических поверхностях (1A), но реакция актуатора медленная (> 10 минут), мала по величине (кривизна < 10-4/мкм) или требуют работы при высоких температурах (250 °C).
Авторы рассматриваемого нами сегодня труда утверждают, что нашли способ преодолеть эти ограничения. В своем исследовании они показали, как материалы, разработанные в микро- и наномасштабе, позволяют создавать микромашины для преобразования энергии. Данный метод также применим и к газофазной (сухой) микроактуации.
Результаты исследования
Химические актуаторы с поверхностным катализом (SCA от surface-catalyzed chemical actuator) были разработаны для использования свободной энергии каталитических реакций между H2 и либо O2, либо O3 на платине (Pt).
Первоначально (1B) ученые циклически меняли Pt-поверхности SCA между H2 и O2/O3 для создания поверхностных состояний и кривизны актуатора, которые характеризуются адсорбированным водородом (H*) или адсорбированным кислородом (O*) / оксидом платины (PtOx) (состояние 1 и состояние 2).
Было сделано важное наблюдение — кинетически контролируемые состояния актуатора (переходное состояние на 1B), которые задаются относительными скоростями элементарных поверхностных реакций на поверхности Pt, могут быть использованы для достижения более быстрых и больших по величине откликов актуатора, чем те, которые достигаются с использованием уравновешенных конечных состояний (т.е. H* и O*/PtOx; состояния 1 и 2 на 1B).
SCA были изготовлены из пленок платины толщиной 7.5 нм, покрытых 0.25 монослоем O*. Пленки также были закрыты с одной стороны пассивирующими слоями TiO2 толщиной 2 нм (1C). SCA были изготовлены в виде шарниров между неподвижными и вращающимися панелями SiO2 (длина 20 мкм, ширина 30 мкм, толщина 500 нм), что позволяло измерить изгиб SCA (1D). Первоначально SCA были изогнуты к поверхности Pt из-за напряжений, возникающих во время изготовления. Во время химического воздействия проводилась количественная оценка изменения кривизны изгиба каждого шарнира SCA посредством оценки изменения проектной длины панелей SiO2 (вид сверху на 2A и 2B).
Были проведены первоначальные эксперименты для определения величины срабатывания SCA после последовательного воздействия H2, а затем O2 (T = 20 °C; Ptotal = 1 атм). Воздействие на SCA 2 об.% H2, а затем 50 об.% O2 приводило к последовательному закрытию и открытию шарнира. Общее изменение кривизны шарнира составило 0.2/мкм (от t = 0 с до t = 20 с на 2C). Ученые отмечают, что это на четыре порядка больше, чем сообщалось ранее для химико-механических устройств, работающих при температуре окружающей среды (1A), и является первым ключевым результатом этого исследования.
Кроме того, при изучении динамики реакции на O2 (t = 20 с и t = 160 с на 2C) было обнаружено, что SCA демонстрируют сильно ускоренное срабатывание (< 1 с) до переходной кривизны 0.35/мкм (вставка на 2C) — значение, лежащее за пределами двух кривизн конечного состояния, достигаемых при уравновешивании SCA относительно H2 или O2.

Изображение №2
Чтобы понять динамическую реакцию SCA на O2, ученые использовали теорию функционала плотности (DFT от density functional theory) для расчета диаграмм потенциальной энергии для реакции O2 с 1 ML H* на Pt(111). Было обнаружено, что путь с самым низким энергетическим барьером активации (Eb) начинается с диссоциации O2 с участием H* и заканчивается образованием H2O* (через поверхностные интермедиаты OOH*, HOOH* и OH*; черная линия на 2E).
Поскольку максимальная Eb на пути (0.37 эВ для разложения HOOH*) меньше, чем энергия десорбции (Edes) H2O* (0.47 эВ на 2E), эти расчеты предсказывают, что поверхность Pt примет переходное состояние, которое характеризуется адсорбированным Н2О*, но минимальным охватом Н* и О* (схема на 1B).
Поскольку расчеты также показывают, что H2O* не деформирует поверхность Pt(111) так сильно, как O* и H* (хемосорбированные O* или H* связываются с поверхностными атомами Pt и вызывают увеличение расстояния Pt–Pt), высокую переходную кривизну SCA, наблюдаемую в экспериментах после воздействия O2 (при t = 24 с на вставке на 2C), можно интерпретировать как кинетически контролируемое состояние SCA, в котором доминирует адсорбированная H2O* (2D). Этот вывод подтверждается контрольными экспериментами, показывающими, что H2O не оказывает заметного влияния на актуацию.
Постепенное уменьшение кривизны, которое следует за переходным состоянием SCA, возникает из-за медленного накопления O* на поверхности Pt посредством прямой диссоциации O2, что подтверждается измерениями рентгеновской фотоэлектронной спектроскопии (XPS от X-ray photoelectron spectroscopy).
Затем, чтобы понять монотонную динамическую реакцию SCA на H2 (отмечено синим на 2C), ученые рассчитали диаграммы потенциальной энергии для диссоциации H2 на поверхности Pt(111), покрытой 0.25 ML O*.
Хотя диссоциация H2 на атомах Pt, непосредственно взаимодействующих с O* (обозначены красными звездочками на 2F), связана со значительным энергетическим барьером активации (Eb = 0.46-0.58 эВ), было рассчитано, что атомы Pt не взаимодействуют напрямую с O* (помечены черными звездочками на 2F), а диссоциируют H2 без барьера (2F).
Это позволяет предсказать накопление H* на поверхности SCA до удаления всего O*. Данное предсказание согласуется с наблюдением монотонного изменения кривизны SCA после воздействия H2 (2C).
Изображение №3
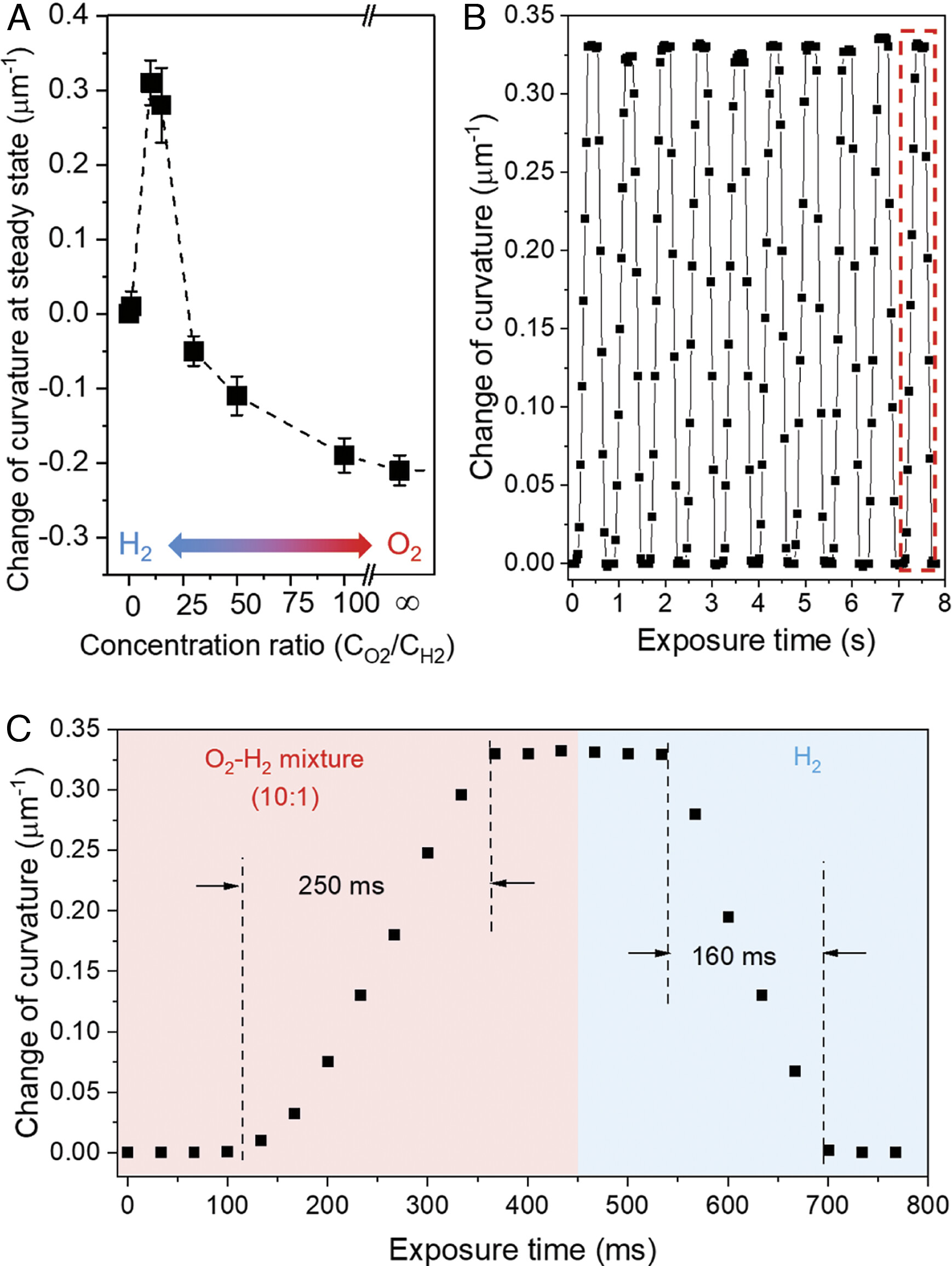
Используя установленные выше принципы, ученые продемонстрировали, что к описанным выше кинетически контролируемым поверхностным состояниям SCA также можно получить доступ в устойчивом состоянии путем совместной подачи смесей газообразных H2 и O2 (3A). В частности, когда CO2/CH2 = от 10 до 15, кривизна SCA сравнима с переходным состоянием при t = 24 с на 2C, что согласуется с состоянием Pt поверхности SCA, в которой преобладает H2O*.
Руководствуясь этим открытием и наблюдениями о том, что кинетика удаления Н* с помощью О2 (2C) и диссоциация Н2 являются быстрыми на SCA, ученые предсказали, что быстрое срабатывание SCA должно быть возможным при циклическом переключении между H2 и 10:1 смеси O2–H2.
Эксперименты подтвердили это предсказание, показав, что SCA может пройти полный цикл срабатывания в течение 600 мс при средней скорости срабатывания 0.8/мкм в секунду (3B, 3C и видео №1).
Видео №1
Как отмечают ученые, это второй ключевой результат исследования: кинетика отдельных элементарных реакций, происходящих на поверхности ультратонких листов катализатора, может быть использована для разработки быстрых обратимых химических приводов, даже если общая реакция медленно достигает равновесия.
Дополнительно было исследовано использование других химических веществ для приведения в действие SCA. O3 быстро образует O* на Pt(111), который затем образует PtOx при комнатной температуре. Учитывая это, SCA, предварительно обработанные 2 об.% H2, были подвергнуты воздействию 1290 ± 40 ppm OO3. Наблюдения показали наличие быстрой реакции, соответствующей кинетически контролируемому состоянию поверхности, которое релаксирует, что приводит к общему изменению кривизны на 0.7/мкм (видео №2).
Видео №2
В течение 20 циклов последовательного воздействия O3 и H2 на SCA не было обнаружено каких-либо потерь актуации. На 4A видно, что кривизна SCA изменяется линейно с толщиной PtOx (измеренной с помощью электропроводности) в соответствии с формулой Стони:

где Δκ — изменение кривизны в результате воздействия H2 или O3;
hox — толщина PtOx;
νs — общий коэффициент Пуассона;
Es — общий модуль Юнга;
hs — толщина двойного слоя Pt/TiO2;
Eox — модуль Юнга;
εox — деформация в слое оксида платины.

Изображение №4
Измеренная кривизна SCA соответствует формуле Стони с оптимальным значением деформации PtOx, равным 1.2%, и эффективностью SCA, равной 0.6%. После воздействия O3 и переноса в He было обнаружено, что SCA демонстрируют постоянную кривизну в течение более 13 часов. Это согласуется с предыдущими исследованиями, демонстрирующими, что термическое разложение PtOx на Pt(111) фактически не происходит ниже 680 K.
Это третий ключевой результат исследования: SCA могут функционировать как микроактуаторы с памятью формы, используя химическое топливо, такое как O3, которое создает поверхностные состояния (например, PtOx), долгоживущие при температуре окружающей среды.
SCA были изготовлены с использованием стандартных полупроводниковых процессов, что обеспечивает их масштабируемую интеграцию в микроустройства со сложными структурами, содержащими несколько SCA (4B—4D). Вращающиеся киригамиподобные микроступени были изготовлены с использованием конструкции, показанной на 4B, и перед актуацией переносились на воздух.
Складки впадины, изготовленные с использованием активных шарниров Pt/TiO2 (области, заштрихованные зеленым на 4B), приводились в действие посредством 2 об.% H2. Это приводило к поступательному ходу от 10 до 20 мкм перпендикулярно подложке и вращению по часовой стрелке на 4 радиана (4C, 4D и видео №3).
Видео №3
Химическое воздействие использовалось для складывания плоских поверхностей в запрограммированные формы (4E—4G). Под воздействием H2 активировались верхние слои PtOx шарниров, что приводило к складчатым структурам. В целом, эти результаты демонстрируют, как SCA могут использовать газовую среду для активизации изменений формы в сложных трехмерных микроструктурах.
Ученые отмечают, что использование химических каталитических путей открывает дополнительные способы активации. Например, SCA можно стимулировать ультрафиолетом с использованием O3, полученным фотохимически из O2.
Чтобы продемонстрировать этот подход, ученые подвергли SCA воздействию УФ-излучения (длина волны — 185 нм; интенсивность — 3.5 мВт/см2) в потоке газа, содержащего O2 (4H и 4I). На 4J показано, что кривизна SCA, освещенных УФ в газе с 20 об.% O2 изменилась на -0.14 ± 0.02 мкм; 50 об.% O2 — на -0.18 ± 0.02; 99.8 об.% O2 — на -0.27 ± 0.04. Это показывает, что SCA могут приводиться в действие топливом, которое генерируется в результате фотохимических процессов из окружающей атмосферы, открывая подходы к микромашинам с фотохимической актуацией. Например, как и в случае с подсолнухом, активация SCA с использованием фотохимически генерируемого O3 может быть использована для создания реконфигурируемых оптических метаматериалов, которые ориентируют солнечные отражатели или панели на свет, чтобы максимизировать сбор солнечной энергии.
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых и дополнительные материалы к нему.
Эпилог
В рассмотренном нами сегодня труде ученые продемонстрировали методику преобразования химической энергии в механическую на примере актуаторов микронного масштаба, которые складываются в стиле киригами в ответ на химическое воздействие.
Стоит отметить, что подобного рода устройства ранее уже были, но их работа была сопряжена с определенными (часто экстремальными) условиями среды (например, при крайне высокой температуре). А вот продемонстрированная учеными разработка способна функционировать даже при комнатной температуре.
Ученые обнаружили, что определенный участок реакционного пути содержит как быстрые, так и медленные этапы. Следовательно, получив контроль над химической реакцией и ее составляющими, этими этапами можно манипулировать, вызывая актуацию устройства на определенных из них, игнорируя все остальные.
Материальной базой для актуатора стали невероятно тонкие листы платины. А основным химическим процессом стало быстрое отделение водорода кислородом, что заставляет атомарно тонкий материал деформироваться и изгибаться как шарнир. Скорость актуации полученной системы составила 600 миллисекунд. Когда происходила необходимая химическая реакция, конструкция складывалась, как киригами.
Ученые считают, что их разработка может быть крайне полезной для создания автономных материальных систем, в которых управляющая схема и вычисления управляются реакцией материала. Например, автономная химическая система, которая регулирует потоки на основе химического состава.
Немного рекламы
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99, уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5-2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Maincubes Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?


