![[Перевод] Экзотические состояния вешества, ЖК-дисплеи и будущее воды [Перевод] Экзотические состояния вешества, ЖК-дисплеи и будущее воды](https://habrastorage.org/getpro/geektimes/post_images/658/08d/cd9/65808dcd966f4a6c29dfe9def17530a5.jpg)
Жидкие кристаллы в нематической фазе
В школе вы, наверное, проходили, что вещество может находиться в трёх термодинамических фазах: твёрдой, жидкой и газообразной. (Термин «фаза» используется совместно с термином «состояние», и ни у одного из них нет чёткого общепринятого определения). Для молодых учеников это полезное упрощение, но на самом деле фаз гораздо больше. В последние сто лет мы открыли существование сотен различных твёрдых фаз – некоторые из них используются для создания кремниевых чипов в вашем компьютере. Кроме того, существуют десятки фаз жидких кристаллов – некоторые из них создают изображения на вашем экране. И мы ещё даже не коснулись по-настоящему экзотических штучек: квантовые фазы, сверхтекучие жидкости, кварк-глюонная плазма, конденсаты Бозе-Эйнштейна и т.н. «топологические фазы».
Но сперва вернёмся к началу и обсудим, что же такое «фаза». Как многие фундаментальные концепции, её лучше объяснить на примере. Рассмотрим стакан с водой, в которой плавает немного кубиков льда. В стакане есть только одно вещество: вода. Очень много молекул H2O.
И хотя молекулы льда идентичны молекулам в окружающей его воде, между ними, очевидно, есть большая разница. Самое очевидное – один из них твёрдый, сохраняющий форму, а другая свободно течёт и принимает форму сосуда. Также есть разница в плотности, электропроводимости и кучке других свойств. Поэтому мы и говорим, что жидкая вода и лёд – это разные фазы одного вещества. (Вода – единственно вещество, с тремя разными фазами которого человек сталкивается постоянно. Это одна из причин того, почему вода – особенное вещество).
Как же так получается, что лёд и вода демонстрируют совершенно разное поведение? У вас может возникнуть искушение сказать, что всё зависит от температуры: вода тёплая, лёд холодный, и из-за этого молекулы воды ведут себя по-разному. Но при 0° C и нормальном атмосферном давлении лёд и жидкая вода стабильны – то есть, они могут существовать бесконечно и не меняться.
Но если ключевое отличие – это не температура, тогда что же?
Большие и малые масштабы
Учёные давно рассуждают о связи между макроскопическими свойствами различных материалов, и микроскопическим расположением частичек, из которых они сделаны. Одна из ранних попыток была сделана в 1611 году Иоганном Кеплером в работе с прекрасным названием: «Шестиугольная снежинка: дар Нового года». Кеплер утверждал, что шестикратную симметрию снежинок можно объяснить, если предположить, что лёд создаётся из крохотных сфер, упакованных в шестиугольные наборы.
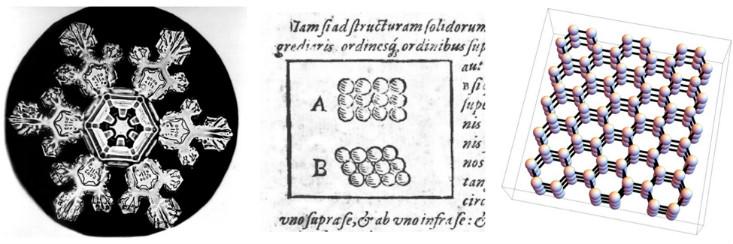
Теперь мы знаем, что предположение Кеплера об особенном расположении атомов было слегка неверным – его схема не отражает трёхмерной формы и сложного взаимодействия молекул воды. (В его пользу скажем, что химию тогда ещё не изобрели, и существование атомов было окончательно доказано почти 300 лет спустя). Тем не менее, он был на правильном пути. Шестикратная симметрия снежинок происходит из того факта, что молекулы воды выстраиваются в трёхмерную структуру с шестикратной симметрией (а ещё бывают треугольные снежные кристаллы, и никто точно не знает, почему).
Говоря языком современной физики, Кеплер предположил, что снег – это кристаллическое твёрдое вещество, фаза материи, получающая свои свойства из-за того, что её атомы или молекулы выстраиваются в периодические ряды, или кристаллические решётки. Физики используют слово «кристалл» для описания микроскопической структуры, неважно, выглядит ли материал как бриллиант, песчинка или снежинка. Поэтому для физика многие металлы и керамика являются кристаллами, поскольку их атомы или молекулы выстроены в периодическую решётку – в некую трёхмерную версию рисунков Кеплера 1611 года.
Это объясняет лёд в стакане воды. А что насчёт жидкой воды? В любом веществе при температуре выше абсолютного нуля (-273° C) молекулы постоянно двигаются и отскакивают друг от друга слово бильярдные шары после сильной разбивки. Температура вещества – это мера скорости движения молекул.
В жидкости это хаотичное тепловое движение достаточно сильное для того, чтобы преодолеть силы, держащие молекулы в решётке. А без этой решётки молекулы могут двигаться гораздо свободнее. Это объясняет, почему жидкость поддаётся, когда вы давите на неё пальцем, а лёд – нет. Что интересно, существуют вещества, в частности, оконное стекло, с полностью беспорядочной микроструктурой, но на макроскопическом уровне ведущие себя, тем не менее, как твёрдые. Понимание такого их поведения – самый важный из открытых вопросов физики материалов.
Фантастические фазы
В трёхмерных материалах – таких, как настоящий лёд, а не как на набросках Кеплера – всё усложняется, поскольку в трёх измерениях существует множество способов расположить молекулы в периодические структуры. Например, существует примерно 17 фаз льда (примерно, потому что это число зависит от того, как их классифицировать), самая новая из которых была впервые создана и изучена итальянскими учёными в прошлом году. Разные фазы возникают при разных температурах и давлениях, и хотя все они твёрдые, у каждой из них своя плотность, прочность, реакция на электрические и магнитные поля, теплопроводность и т.п. Из-за существования этих различий в макроскопическом поведении мы и называем их разными фазами. При «нормальных» условиях – температуре и давлении на поверхности Земли – лёд обычно находится в форме «лёд Ih». Эта стабильная шестиугольная кристаллическая форма как раз и отвечает за шестикратную симметрию снежинок.
Согласно меткам различных фаз льда, лёд IX существует на самом деле. К счастью, при температуре и давлении на поверхности Земли он гораздо более хрупок, чем другой «лёд девять» – стабильная фаза, из-за которой >катастрофически отвердели океаны в романе Курта Воннегута «Колыбелька для кошки».
И это ещё не всё, даже с такой привычной субстанцией. Другие, ещё не открытые фазы льда могут существовать при ультравысоких давлениях в центрах газовых гигантов вроде Урана и Нептуна. В таких экстремальных условиях, при давлении в 10 млн атм. и более, вода должна формировать очень странные кристаллические твёрдые фазы. Среди них есть металлическая токопроводящая фаза, которая должна выглядеть блестящей, если вы придумаете, как её отполировать.
Промежуточные варианты
Связь между микроструктурой и макросвойствами – основная идея науки и инженерного дела, она используется при разработке множества материалов. К примеру, жидкие кристаллы – ключевой компонент ноутбуков, телевизоров и экранов смартфонов. У молекул жидких кристаллов необычно длинная структура, напоминающая палочку. Из-за этого они могут находиться в нескольких разных фазах, со свойствами, не встречающимися у обычных материалов.
К примеру, при высоких температурах молекулы находятся в беспорядке. Каждая «палочка» находится в случайном месте, как молекулы в жидкой воде, и ориентирована в произвольном направлении. Это изотропная фаза. При более низких температурах молекулы могут переходить в нематическую фазу, в которой они расположены случайно, как в жидкой воде, но направлены в одну сторону. Поскольку никакой решётки не формируется, нематическая фаза течёт, словно жидкость, но, поскольку палочки направлены в одну сторону, у неё есть микроскопический порядок. Поэтому их называют «жидкими кристаллами».
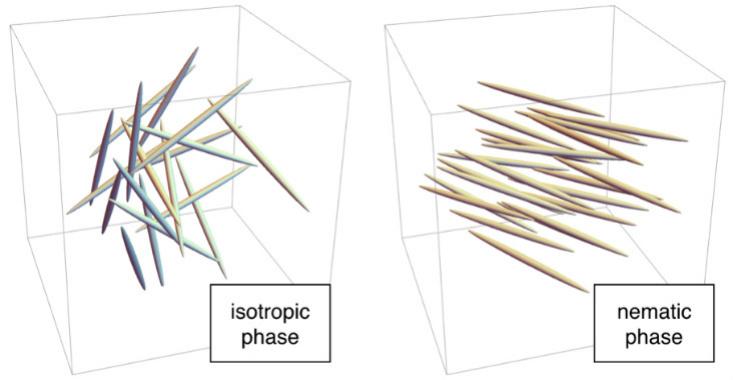
К счастью для современных людей у нематической фазы есть необычные свойства, связанные с направлением. При попадании в электрическое поле молекулы выстраиваются вдоль него. В ЖК-экранах молекулы в нематической фазе ведут себя, как поляризационный фильтр: устройство, пропускающее свет, когда молекулы ориентированы особым образом (например, сверху вниз), и задерживающее его, когда они ориентированы перпендикулярно. Поскольку для такой работы нужен поляризационный фильтр, в телефонах и дисплеях фильтр помещается между источником света и экраном. В ЖК крохотные электроды рядом с каждым пикселем создают электрическое поле, управляющее положением молекул внутри него, и, следовательно, испусканием света. Эта схема работы применяется в IPS-дисплеях («in-plane switching»). Бывают и другие варианты, например, TN-дисплеи, использующие ещё более экзотическую, скрученную нематическую, фазу.
Моделируем миниатюрное
Ясно, что микроструктура помогает объяснять свойства материалов, которые мы встречаем и создаём. Но можем ли мы увидеть микроскопический порядок в реальной жизни? Для обычных веществ, типа льда, соли или металла, это сложно, поскольку атомы и молекулы очень малы. Молекула воды меньше одной миллиардной метра – её нельзя увидеть в обычный световой микроскоп, и очень сложно увидеть даже с использованием современных техник микроскопирования.
К счастью, не только атомы и молекулы умеют самостоятельно организовываться в фазы. В лаборатории Чайкина в центре исследования мягких материалов Нью-Йоркского университета, мы используем небольшие твёрдые сферы для изучения фаз материи. Они называются коллоидами, и их можно делать из различных материалов, например, стекла, пластика или металла. Коллоиды в лаборатории в 3000 раз больше, чем молекулы воды – они сравнимы по размеру с бактериями или ядрами клеток животных. Для специалистов по материалам коллоиды представляют собой нечто вроде «идеальных частиц» – достаточно крупных, чтобы их было видно в микроскоп, и достаточно мелких, чтобы формировать фазы, во многом аналогичные обычным материалам.

На этом фото видно пластиковые коллоиды, покрытые химическим составом, благодаря которому они отталкиваются друг от друга, находясь на поверхности воды
В нашей лаборатории мы делаем коллоиды со специальным покрытием, позволяющим им прилипать к водной поверхности. Когда они прилипают к каплям, мы можем делать красивые микрофотографии – такие, как эта. На них можно увидеть микроскопическую структуру различных фаз, и то, как их ориентация приводит к появлению таких макроскопических свойств, как твердость. К примеру, сейчас мы изучаем, как меняется поведение наших частиц в зависимости от использования сферических капель или плоских поверхностей воды. Помогает или мешает формированию кристаллов и появлению систем, подобных твёрдому телу, нахождение частиц на сфере? Это может помочь нам понять свойства важных структур, имеющих сферическую или более сложную форму. Если бы, к примеру, нам было бы известно больше о белковых оболочках, защищающих гены ВИЧ, мы могли бы научиться разбивать их и побеждать вирус.
Когда кристаллы портятся
Одна из самых важных стадий изучения микроскопического порядка – изучение условий, при которых порядок нарушается. К примеру, если посмотреть на изображение коллоидов в кристаллической решётке, можно заметить, что их порядок неоднороден. Можно увидеть несовершенства и неровности, дефекты.

Изображение сделано конфокальным микроскопом – в образец добавляется флуоресцентная краска, которая затем подсвечивается лазером
Сходные дефекты происходят и в кристаллах из атомов или молекул, и они играют важную роль. К примеру, они определяют хрупкость материала – то, какую нагрузку он может выдержать перед тем, как сломается. Кроме того, поскольку дефекты могут влиять на электрическую проводимость материала, производители полупроводников тратят миллиарды долларов на производство монокристаллов кремния – гигантских блоков кремния почти без дефектов. С другой стороны, иногда эти микроскопические недостатки весьма кстати. Недавние исследования сконцентрировались на управлении и контроле дефектами графена для оптимизации его в качестве фильтра для опреснения воды.
Мы используем коллоидные кристаллы, чтобы наблюдать, как дефекты появляются, двигаются и взаимодействуют друг с другом. Как и изучение фаз, изучение коллоидных кристаллов может помочь нам понять дефекты в других материалах. Как и во многих областях жизни, иногда несовершенства – это самая интересная часть.
Источник



