Вступление.
Старение определяется как физиологическое снижение биологических функций в организме с прогрессирующим снижением или потерей адаптации к внутренним и внешним повреждениям. У людей фенотип старения чрезвычайно неоднороден и может быть описан как сложная мозаика, возникающая в результате взаимодействия нескольких случайных и экологических событий, генетических и эпигенетических изменений, накопленных в течение всей жизни. Несмотря на свою огромную сложность, молекулярная основа старения ограничена немногими высоко эволюционно консервативными биологическими механизмами, ответственными за поддержание и восстановление организма ( 1 ).
В течение последних 3 десятилетий одной из наиболее обсуждаемых тем в геронтологии является роль системы гормон роста (GH) / инсулиноподобный фактор роста-1 (IGF-1) / инсулин в регуляции долголетия. Накопленные данные свидетельствуют о том, что этот путь играет важную роль в патогенезе ряда возрастных заболеваний, включая рак, деменцию, сердечно-сосудистые и метаболические заболевания ( 2 — 4 ).
На животных моделях было показано, что подавление системы GH / IGF-1 / инсулин значительно увеличивает продолжительность жизни. Однако у людей данные противоречивы ( 5, 6 ).
В этом обзоре описываются последние достижения в исследовании системы IGF-1 и модуляции долголетия, выдвигается гипотеза о том, что эндокринная и метаболическая адаптация, наблюдаемая у долгожителей и у млекопитающих во время ограничения калорий, может быть физиологической стратегией для увеличения продолжительности жизни за счет более медленного роста клеток / метаболизма, лучшего контроля в передаче сигнала и физиологических резервных мощностей и уменьшения накопления стареющих клеток.
Система IGF-1 и долговечность в животных моделях .
![[Перевод] РОЛЬ системы IGF-1 в модуляции долголетия: противоречия и новое понимание с точки зрения столетних долгожителей [Перевод] РОЛЬ системы IGF-1 в модуляции долголетия: противоречия и новое понимание с точки зрения столетних долгожителей](https://habrastorage.org/webt/sl/kj/al/slkjaljnybavm_mgvqfs3zxlsdw.jpeg)
Рис.1 Плейотропное действие IGF-1 на организм. На одной чаше весов, которая перевешивает: тканевый гомеостаз, кардиопротекторное и нейропротекторное действие, инсулино-подобные эффекты, участие в формировании скелета и регенерации мышц. На второй чаше весов: риск канцерогенеза.
Система IGF-1 оказывает несколько плейотропных эффектов на биологическое старение (см.рис.1). IGF-1 играет важную роль в развитии плода, его росте в детском и подростковом возрасте и гомеостазе тканей взрослых. Кроме того, IGF-1, по-видимому, обладает атеропротекторным действием, нейронным защитным и инсулиноподобным действием (в высоких концентрациях), регулирует костный метаболизм и регенерацию мышц. Тем не менее, IGF-1 является основным фактором риска в развитии нескольких видов опухолей из — за его сильной пролиферативной активности, главным образом за счет модуляции клеточного цикла, апоптоза и выживания клеток ( 7 — 9 ). Большинство из этих эффектов опосредованы взаимодействием с субстратом инсулинового рецептора (IRS) -1 и-2 и модуляцией пути PI3K / AKT / мишени рапамицина у млекопитающих (mTOR) (см. рис.2)
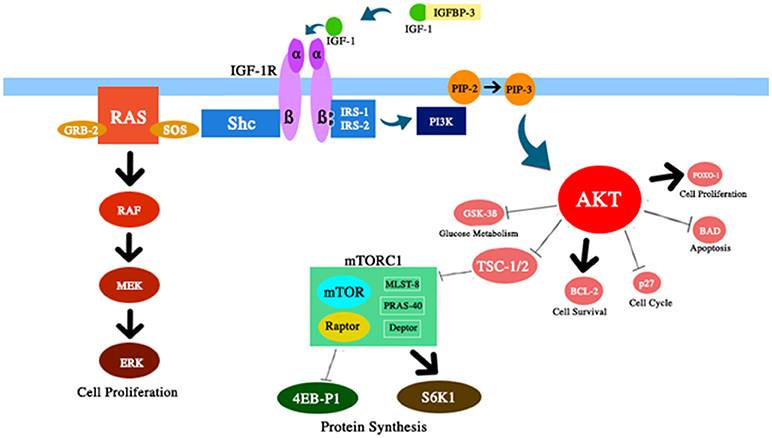
Рис.2 Схематическое представление нескольких компонентов пути IGF-1 / PI3K / AKT / mTOR, обсуждаемых в этом обзоре. IGF-1 повышает активность AKT с соответствующими эффектами на выживание и пролиферацию клеток, метаболизм глюкозы и синтез белка.
В нескольких доклинических исследованиях сообщалось, что мутация в генах, контролирующих сигнальный путь GH / IGF-1 / инсулин, могут значительно увеличить продолжительность жизни как на моделях животных беспозвоночных, так и позвоночных животных ( 5, 6 ).
Модели беспозвоночных.
У беспозвоночных инсулин / IGF-подобный каскад регулируется несколькими пептидами, способными взаимодействовать с одним общим инсулин / IGF-1-подобным рецептором.
У нематоды Caenorhabditis elegans инсулин / IGF-подобный путь состоит из нескольких белков, кодируемых генами daf-2, age-1 (кодирующий каталитическую субъединицу PI3K), akt-1, akt-2, pdk-1, sgk-1 (серин-треонинкиназы), daf-16, skn-1 и daf-18 (PTEN, фосфатаза, участвующая в ингибировании сигнального пути AKT). Было показано, что сниженная активность генов daf-2, age-1, akt-1, akt-2, pdk-1, sgk-1 подавляет этот путь, и животные с этими мутациями, как сообщалось, стареют медленнее и имеют увеличенный срок жизни до 300%. Напротив, стимуляция инсулин / IGF-подобного пути уменьшает продолжительность жизни нематод (10, 11 ).
У плодовой мушки Drosophila melanogaster передача сигналов, подобных инсулину / IGF, состоит из dINR (белка, подобного рецептору инсулина / IGF-1), субстрата рецептора инсулина CHICO, PI3K Dp110 / p60 и PI3K-мишени PKB. Сообщалось, что мухи с мутацией в этих генах значительно увеличивали продолжительность жизни ( 12, 13 ).
Удивительно, но одни и те же молекулярные механизмы в разных тканях не влияют одинаково на старение. Несколько исследований нематод и плодовых мух показали, что снижение инсулин / IGF-подобной передачи сигналов в нервной и жировой тканях играет основную роль в регуляции долголетия ( 14, 15 ). Хотя в моделях беспозвоночных было показано, что этот каскад имеет значение для модуляции продолжительности жизни, влияние передачи сигналов, подобных инсулину / IGF, на продолжительность жизни намного сложнее у позвоночных, поскольку они имеют функционально специфичные молекулы инсулина и IGF, белки, связывающие IGF ( IGFBPs), протеазы IGFBP, GH, множественные рецепторы и несколько механизмов внутриклеточной передачи сигналов с различной тканеспецифической экспрессией ( 16 ).
Модели позвоночных.
Несколько мутантных мышей GH / IGF-1 были разработаны с разными мишенями. Наиболее актуальные модели описаны ниже.
Мыши Snell и Ames.
Мыши Snell и Ames — это два мышиных штамма с мутациями в генах PIT-1 и PROP-1 соответственно ( 17, 18 ). Поскольку оба белка PIT-1 и PROP-1 необходимы для дифференцировки клеток гипофиза, которые продуцируют GH, пролактин и тиреотропный гормон, у обоих типов гомозиготных мутантных мышей отсутствуют все три гормона ( 18 ). Эти модели показали значительное увеличение продолжительности жизни (на 42–70% больше, чем у мышей дикого типа), повышенную чувствительность к инсулину и более низкую частоту опухолей ( 19, 20 ). Когда мыши линии Ames подвергались ограничению калорий, их продолжительность жизни увеличивалась еще больше ( 21). Хотя этим животным не хватает трех гормонов, было продемонстрировано, что увеличение продолжительности жизни в основном зависит от дефицита GH ( 22 ).
Lit/lit мыши
У Lit/lit мышей дефицит GH и мутация в гене, который кодирует рецептор GH-рилизинг-гормона (GHRHR). Эти животные были карликами, имели увеличенную жировую ткань, меньшую частоту опухолей и продолжительность жизни увеличились на 23-25% ( 19 ).
GH-Releasing Hormone-Knockout (GHRH-KO) мыши.
Мыши с нокаутом GH-рилизинг-гормон (GHRH-KO), живут на 43% (у самок) и на 51% (у самцов) дольше, чем животные дикого типа, и имеют много фенотипических характеристик мишей Ames, таких как повышенная чувствительность к инсулину, снижение уровней триглицеридов и холестерина в плазме, увеличение жировой ткани, повышенные уровни лептина и адипонектина в плазме ( 23 ).
Мыши GH-Receptor-Knockout (GHR-KO)
Мыши, нокаутированные по рецептору GH (GHR-KO), имеют повышенные уровни GH в сыворотке и очень низкие уровни IGF-1. Также сообщалось, что этот штамм мышей прожил на 38–55% дольше, чем дикий тип ( 24 ), и продемонстрировал снижение окислительного стресса, а также более низкое и отсроченное начало смертельных опухолей ( 25 ). Подобные результаты наблюдались у мышей df / KO, скрещенных двух линий мишей, GHR-KO и карликов Ames, у которых отсутствовали GH и рецептор GH и сохранялось увеличение продолжительности жизни ( 26 ). В отличие от диких братьев и сестер и карликовых мышей Ames ограничение калорийности не увеличивало продолжительность жизни мышей GHR-KO, что позволяет предположить, что ось GH / IGF-1 и ограничение калорий могут иметь сходные или частично перекрывающиеся механизмы для продления продолжительности жизни ( 27 ).
Антагонизм рецепторов GH (GHA)
Не все модели животных с подавлением системы GH / IGF-1 демонстрируют увеличение продолжительности жизни. Штамм GHA мышей является одним из таких примеров. GHA, генерируемый путем замены одной аминокислоты, способен связывать рецептор GH с той же аффинностью, что и GH, но не вызывает внутриклеточную передачу сигналов. Продолжительность жизни мышей GHA значительно не увеличилась ( 28).
IGF-1R +/– Мыши
В то время как большинство мышей с недействующим IGF-1-рецептором (IGF-1R — / — ) умирают при рождении, животные, гетерозиготные по мутантному аллелю рецептора IGF-1 (IGF-1R ± ), показали очень низкий уровень сывороточного IGF-1, примерно на 10% меньший размер и на 33% увеличенную продолжительность жизни у самок и 16% у самцов. Однако в этом исследовании контроли дикого типа дожили до 19 месяцев, что поставило под угрозу интерпретацию результатов ( 29 ). Более поздние исследования, оценивающие продолжительность жизни в другой линии IGF-1R ±, показали незначительное увеличение продолжительности жизни на 5–10%, но только у самок ( 30, 31 ). Кроме того, основной фоновый штамм, по-видимому, влияет на степень продления жизни в нескольких мышиных моделях ( 32 ).
A Brain-Specific IGF1-R+/−
A Brain-Specific IGF1-R+/− мутантные мыши жили на 9% дольше, чем дикий тип, что подчеркивает соответствующую роль нервной системы в модуляции долголетия ( 33 ).
Liver-specific IGF-1-disrupted мыши (LI-IGF-1−/− ).
Мыши с нарушенной продукцией IGF-1 (LI-IGF-1 — / — ) имеют очень низкие сывороточные уровни IGF-1 и высокие сывороточные уровни GH из-за инактивации гена IGF-1. У мышей LI-IGF-1 — / — было заметно сниженное ожирение и, как результат, вес был на 25% ниже, чем у мышей дикого типа. Только самки мышей LI-IGF-1 — / -продемонстрировали увеличение продолжительности жизни на 16% по сравнению с контрольными мышами ( 34 ).
Pappa−/− мыши.
Pappa−/− мыши имеют нокаут гена ассоциированного с беременностью протеина-А плазмы (Pregnancy-associated plasma protein A, PAPP-A, PAPPA), специфической протеазы для белков, связывающих IGF. Средняя продолжительность жизни этого мышиного штамма была на 38% больше по сравнению с контролями дикого типа. Мыши Pappa−/− были карликами, но их уровни глюкозы, инсулина, IGF-1 и GH в сыворотке не отличались от таковых у контролей дикого типа, что свидетельствует о том, что PAPPA действует в основном на аутокринном или паракринном уровне. В дополнение к увеличению продолжительности жизни у мышей Pappa−/− наблюдалась меньшая частота развития опухолей, а также возрастных дегенеративных поражений ( 35, 36 ).
IRS Disrupted (IRS1 — / — ) мыши.
IRS-1 и -2 являются важными медиаторами для инсулина, а также для передачи сигналов IGF-1. IRS1 — / — мыши были инсулинорезистентны, с дефектом передачи сигналов инсулина в основном в мышечной ткани, примерно на 30% меньше по размеру, чем дикого типа, и только у самок продолжительность жизни была на 18% больше по сравнению с животными дикого типа ( 37). ). Мыши IRS2 — / — также были резистентны к инсулину, но в отличие от мышей IRS1 — / — они обнаруживали дефекты передачи сигналов инсулина в большем количестве тканей, включая печень, жировую ткань и скелетные мышцы. У этих мышей развился диабет, и их продолжительность жизни была намного короче, чем у мышей дикого типа и мышей IRS2 ±. IRS2 +/−мыши имели улучшенную чувствительность к инсулину и увеличенную продолжительность жизни (+ 18%) по сравнению с мышами дикого типа. Кроме того, сообщалось, что мозгоспецифичные мыши IRS2 ± и IRS2 — / — были резистентны к инсулину и жили на 18 и 14% дольше, чем контроли дикого типа, соответственно ( 38 ).
KLOTHO Модифицированные Мыши.
Белок KLOTHO ингибирует передачу сигналов инсулина и IGF-1, возможно, путем нарушения взаимодействия рецептор / лиганд. Сообщалось, что мыши со сверхэкспрессией KLOTHO имели нормальный размер, и у самцов развивалась резистентность к инсулину, а продолжительность жизни как у самцов, так и у самок была значительно увеличена (+18 и + 30% соответственно) ( 39, 40 ).
P66shc Disrupted мыши (P66shc−/− ).
P66shc представляет собой белок, опосредующий передачу сигналов IGF-1 после рецептора путем активации пути MAPK. Мыши P66shc — / — имели нормальный фенотип, но жили на 28% дольше, чем контроли дикого типа ( 41 ). Однако эти данные не были подтверждены в недавнем исследовании ( 42 ).
Роль передачи сигналов GH / IGF-1 / инсулин в старении и долголетии была глубоко изучена на всех этих моделях животных. В то время как у беспозвоночных влияние подавления в пути IGF-1 / инсулин на продолжительность жизни было очевидным и значительным, в мышиных моделях этот эффект был ослаблен и не воспроизводим в некоторых случаях, таких как в линиях IGF-1R ± и P66shc — / -мышей. Тем не менее, большинство из этих моделей показали наличие некоторых общих черт среди долгоживущих мышей, таких как пониженные уровни циркулирующего IGF-1 и инсулина и повышенная чувствительность к инсулину, которые, вероятно, способствуют снижению заболеваемости раком, улучшению устойчивости к стрессу и продлению срока жизни. Генетические изменения, способные нарушить систему IGF-1, могут сохранять здоровье животных на более длительные периоды и могут откладывать или облегчать некоторые возрастные заболевания. В этом процессе нервная и жировая ткани играют важную роль.
Кроме того, необходимы дополнительные данные для определения наилучшего момента времени в течение срока жизни для вмешательства в подавление системы IGF-1 для получения положительного влияния на продолжительность жизни. У мышей igf f / f C57B l / 6 дефицит циркулирующего IGF-1, начиная с 5-месячного или более раннего возраста, увеличивал продолжительность жизни на 15% только у самок с уменьшением числа органов, имеющих патологию в конце жизни по сравнению с контрольной группой. Кроме того, дефицит IGF-1 в позднем возрасте (15 месяцев) снижал риск развития рака, но не оказывал положительного влияния на продолжительность жизни ( 43 ). Эти данные подчеркивают важность дефицита IGF-1 в раннем возрасте для увеличения продолжительности жизни. С другой стороны, Мао и соавт. ( 44) недавно сообщили, что позднее введение 18-месячных мышам CB6F1 моноклонального антитела, направленного против рецептора IGF-1, продлило продолжительность жизни у самок на 9% и улучшило некоторые аспекты здоровья.
Система IGF-1 у долгоживущих людей.
Столетние долгожители считаются лучшей человеческой моделью для изучения биологических детерминант долголетия, достигших самых крайних значений продолжительности жизни человека ( 45 ).
В нескольких исследованиях сравнивались уровни циркулирующего инсулина и IGF-1 у долгожителей с таковыми у более молодых контролей ( 46 ).
Метаболическое возрастное ремоделирование — это физиологический процесс, происходящий во всей популяции. Старение часто связано со снижением толерантности к глюкозе, что связано с повышенной резистентностью к инсулину ( 47 ), но у долгоживущих людей есть исключение. Было обнаружено ( 48), что резистентность к инсулину возрастает с возрастом и снижается у лиц старше 90 лет, проживающих в южной Италии. Действительно, долгоживущие субъекты показали более высокую чувствительность к инсулину и лучшее сохранение функции бета-клеток, чем более молодые субъекты. Такая разница также не зависела от основных антропометрических и метаболических факторов. У 100-летних пациентов концентрация глюкозы в плазме крови в течение 2 часов была ниже, чем у лиц пожилого возраста (средний возраст 78 лет). У долгожителей инсулин-опосредованное потребление глюкозы было выше, чем у пожилых контролей во время эугликемического захвата глюкозы, что поддержало сохраненную толерантность к глюкозе и действие инсулина в этой долгоживущей группе ( 49, 50). Аналогичные результаты, подтверждающие лучшую чувствительность к инсулину, наблюдались в других популяціях долгожителей ( 51, 52 ).
Кроме того, долгожители показали сохраненное действие инсулина не только на метаболизм глюкозы, но и на жировую ткань. Фактически, инфузия инсулина обычно связана с ингибированием липолиза и, таким образом, со значительным снижением концентрации свободных жирных кислот и триглицеридов в плазме. У долгожителей ингибирующая активность инсулина при липолизе была выше, чем у контрольных участников (средний возраст 78 лет) ( 50 ). Следует отметить, что у долгожителей по сравнению со взрослыми контролями также наблюдается более низкий симпатический тонус, что может быть связано с лучшим действием инсулина и, следовательно, с низким уровнем инсулина в плазме натощак ( 53, 54).
Данные о системе IGF-1 в отношении продолжительности жизни все еще противоречивы у долгоживущих субъектов ( 46 ). Паолиссо и соавт. ( 55 ) описали повышенное соотношение IGF-1 / IGFBP-3 в плазме у здоровых долгожителей по сравнению с пожилыми людьми. Они предположили, что это повышенное соотношение свидетельствует о более высокой биодоступности IGF-1, что способствует улучшению действия инсулина у долгожителей. Bonafè et al. ( 56 ) сообщили, что субъекты с по крайней мере аллелем А гена рецептора IGF-1 (G / A, кодон 1013) имели низкие уровни свободного IGF-1 в плазме и были более представлены среди долгоживущих людей. Arai et al. ( 57) описали относительно низкие уровни сывороточного IGF-1 в популяции японских долгожителей. В этой популяции самые низкие показатели как IGF-1, так и IGFBP-3 были связаны с повышенной смертностью ( 58 ).
Эти противоречивые результаты, вероятно, отражают сложность системы IGF и этнические различия в зарегистрированном населении. Кроме того, долгожителей часто сравнивали с контрольной группой более молодых субъектов. Таким образом, в большинстве этих исследований было невозможно сделать вывод, были ли различия между IGF-1 в обеих группах связаны с разной продолжительностью жизни или отражали физиологически зависимое от возраста снижение IGF-1. Действительно, есть несколько ограничений для изучения долгожителей: (1) низкая распространенность (1 столетний на 5-10 000 жителей), (2) наличие слабости из-за экстремального возраста (почти 95% долгожителей имеют как минимум 1 критерий астении), ( 3) отсутствие контрольной группы того же возраста ( 45, 59). Из-за этих ограничений эта человеческая модель не подходит для изучения возрастных переменных, которые могут участвовать в модуляции продолжительности жизни.
Потомки столетних людей представляют собой еще одну интересную модель для определения соответствующих факторов, связанных с долголетием человека и здоровым старением. Согласованный набор наблюдений в разных странах позволяет предположить, что потомки долгожителей более здоровы, чем представители тех же демографических групп ( 51, 60, 61) и биологически (эпигенетически) моложе своего хронологического возраста ( 62 ). В целом, эти исследования показывают, что родственники долгожителей имеют высокую вероятность прожить дольше и иметь хорошее здоровье ( 60, 63). Кроме того, изучение потомства долгожителей имеет преимущество в наличии соответствующей демографически подобранной контрольной группы, состоящей из сопоставимого по возрасту потомства, в котором оба родителя родились в одной и той же когорте столетних, но умерли до порогового возраста, после которого люди классифицируется как «долгожители». Эта стратегия имеет решающее значение для предотвращения когортных эффектов. Таким образом, модель потомства долгожителей может преодолеть некоторые ограничения, которые обнаруживаются при исследовании долгожителей (редкость, слабость и отсутствие надлежащего контроля) ( 60 ).
В нескольких исследованиях система IGF-1 / инсулин была охарактеризована у потомков долгожителей и в соответствующей контрольной группе.
Мы оценили циркулирующую биоактивность IGF-1, измеренную с помощью инновационного анализа активации рецептора киназы (KIRA), проведенного у долгожителей, потомков долгожителей и сопоставимых контрольных потомков. У потомков долгожителей и долгожителей была относительно более низкая циркулирующая биологическая активность IGF-1 по сравнению с контрольной группой. Интересно, что биологическая активность IGF-1 у потомков долгожителей была обратно связана с чувствительностью к инсулину ( 51 ).
Suh et al. ( 64 ) оценивали уровни IGF-1 в сыворотке у потомков еврейских долгожителей ашкенази и в сопостаимых по возрасту контролях. У детей долгожителей женского пола уровень IGF-1 в сыворотке был на 35% выше, чем у контрольних участников. Эта разница может представлять компенсаторный ответ на снижение передачи сигналов рецептора IGF-1. Кроме того, у еврейских долгожителей ашкенази было описано чрезмерное присутствие гетерозиготных мутаций в гене рецептора IGF-1 вместе с относительно высокими уровнями IGF-1 в сыворотке и ослабленной активностью рецептора IGF-1 по сравнению с контрольной группой без семейного долголетия.
Для изучения долголетия другие авторы исследовали девяностолетних братьев и сестер и их потомков. В Лейденском исследовании долголетия была отобрана 421 семья, состоящая как минимум из двух доложите лей, братьев и сестер, их потомков и партнеров потомков в качестве контроля. В этих популяциях уровень глюкозы, инсулина и триглицеридов в сыворотке был лучшим биомаркером здорового старения (низкие уровни глюкозы и инсулина считались здоровыми) ( 65 ). Девятостолетние долгожители в самом низком соотношении IGF-1 / IGFBP-3 в кровотоке были связаны с лучшей выживаемостью ( 66 ). Потомки девятостолетних долгожителей показали лучшую чувствительность к инсулину по сравнению с их партнерами, в то время как аналогичные уровни IGF-1 и IGFBP-3 в сыворотке крови натощак наблюдались в обеих группах ( 67). Интересно, что 24-часовая общая секреция GH была на 28% ниже у потомства по сравнению с контролем ( 68 ).
Другой подход, принятый для изучения долголетия у людей, заключается в выборе семейных компонентов исключительного долголетия и здорового старения, основанных на строгих критериях, таких как показатель выбора продолжительности жизни семьи, принятый в Long Life Family Study. Эти семьи, отобранные по исключительной продолжительности жизни, сравнивались с контрольной группой без семейной истории долголетия ( 69 ). В этой популяции циркулирующие уровни IGF-1 оказались достоверным возрастным биомаркером ( 70 ).
В подтверждение потенциальной роли системы GH / IGF-1 / инсулин в долголетии человека, существует множество генетических исследований. Действительно, было выявлено, что несколько генетических локусов связаны с циркулирующими уровнями IGF-1 и IGFBP-3 и потенциально способны влиять на старение ( 71 ). Общегеномный анализ ассоциаций, проведенный у девяностолетних людей и популяции пациентов в возрасте <60 лет, показал четкую связь между генетической изменчивостью генов, участвующих в пути инсулин / IGF-1, и продолжительностью жизни человека ( 72 ). В проспективном исследовании пожилых людей женщины с генетическим профилем, свидетельствующим о снижении активности передачи сигналов инсулин / IGF-1, продемонстрировали более длительную продолжительность жизни ( 73). В четырех независимых когортах долгоживущих людей недавно было описано линейное увеличение распространенности гомозиготности по экзону 3 (G3R) рецептора GH с возрастом. Наличие генотипа d3 / d3 увеличило продолжительность жизни примерно на 10 лет ( 74 ).
Система IGF-1 и ограничение калорийности.
Одним из наиболее убедительных наблюдений в биологии старения является способность ограничения калорийности предотвращать или отсрачивать некоторые возрастные заболевания и увеличивать продолжительность жизни у млекопитающих ( 75 — 78 ). Биологические механизмы этого явления не совсем ясны, но было высказано предположение о потенциальной вовлеченности соответствующих изменений в энергетическом обмене, эндокринной системе и окислительных повреждениях.
Ограничение калорийности вызывает многочисленные гормональные изменения. У грызунов ограничение калорийности без голодания подавляло циркулирующие уровни IGF-1 и инсулина пропорционально уровню ограничения, повышало чувствительность к инсулину и устойчивость к стрессу и токсичности и снижало риск развития рака ( 79, 80 ). Интересно, что большинство этих характеристик, наблюдаемых у мышей дикого типа во время ограничения калорийности, напоминают те, о которых сообщалось у мышей, которые являются долгоживущими вследствие генетического нарушения передачи сигналов GH / IGF-1 / инсулин, как описано ранее.
Рандомизированные клинические испытания на людях показали, что ограничение калорийности не снижает уровень IGF-1 в сыворотке крови, если потребление белка не снижается ( 81, 82). Однако недавний метаанализ, оценивающий влияние ограничения питания на общепризнанные биомаркеры здорового старения, показал снижение уровня IGF-1 в крови у человека ( 83 ).
Другие гормональные изменения, такие как снижение уровня инсулина, гормонов щитовидной железы и уровня лептина, а также повышение уровня адипонектина и чувствительности к инсулину, наблюдались во время ограничения диеты ( 85, 86 ).
Эта гормональная адаптация может играть важную роль в продлении жизни через несколько механизмов:
1) Уменьшение скорости метаболизма, пролиферации клеток и окислительного стресса. Фактически, IGF-1 является мощным фактором роста, а гормон щитовидной железы является мощным стимулятором скорости основного обмена и окислительного метаболизма. Кроме того, паттерны транскрипции предполагают, что хроническое умеренное ограничение калорий у взрослых людей замедляет процесс старения, переключая клеточный метаболизм с роста на поддержание и восстановление деятельности ( 84 ).
2) Уменьшение накопления стареющих клеток. Было показано, что клеточное старение является ключевым медиатором старения ( 87 ). Со временем белковый гомеостаз уменьшается и накапливается повреждение. Интересно, что можно отсрочить некоторые возрастные заболевания, ослабляя накопление стареющих клеток ( 88, 89 ). Обычно путь mTOR активируется несколькими сигналами, включая питательные вещества, IGF-1 и инсулин ( рис. 2).). Падение регуляции этого пути, о котором сообщалось после ограничения калорийности, увеличило продолжительность жизни некоторых организмов. Этот эффект, по-видимому, является вторичным по отношению к усилению аутофагии, цитопротективного процесса пищеварения. Фактически, аутофагия — это процесс переработки клеток, который может удалять старые или поврежденные клеточные компоненты, предотвращая накопление стареющих клеток ( 90, 91 ).
3) Противодействие воспалению. Диетическое вмешательство как у животных, так и у людей может замедлить процесс старения, ослабляя воспалительный статус слабой степени ( 83, 92 ). Механизмы, лежащие в основе противовоспалительной активности ограничения питания, не определены четко. Предполагается, что этот эффект обусловлен уменьшением жировой массы и провоспалительных адипокинов, а также улучшением целостности кишечного барьера, наблюдаемым во время диетического вмешательства ( 93, 94 ).
Интересно отметить, что эндокринный биохимический профиль, наблюдаемый у субъектов во время ограничения калорийности, сопоставим с таковым у долгожителей, что подтверждает потенциальную роль эндокринной системы в модуляции продолжительности жизни. В дополнение к увеличению чувствительности к инсулину и снижению уровней IGF-1 в плазме / сыворотке, в нескольких исследованиях было показано повышение уровня циркулирующего адипонектина и снижение уровней циркулирующих лептина и тиреоидных гормонов у долгоживущих людей по сравнению с более молодыми субъектами.
Жировая ткань — это эндокринный орган, продуцирующий несколько цитокинов, участвующих в соответствующих процессах, таких как энергетический обмен, гомеостаз липидов и глюкозы и модуляция воспалительного ответа. Висцеральная жировая ткань играет основную роль в развитии метаболических заболеваний ( 95 ). Старение связано с увеличением жировой массы и перераспределением жировой ткани, характеризующимся потерей периферического подкожного жира и накоплением висцерального жира. У пожилых людей были описаны изменения в секреции, синтезе и функции адипокинов, вероятно, из-за дисбаланса в функции, пролиферации, размере и количестве жировых клеток( 86). Адипонектин является инсулин-сенсибилизирующим, противовоспалительным и антиатерогенным цитокином. Адипонектин циркулирует в крови в нескольких формах: тример, гексамер, мультимер с высокой молекулярной массой (HMW) и глобулярный адипонектин (протеолитически расщепленная форма). Полагают, что мультимер HMW является более активной формой адипонектина при защите от инсулинорезистентности и диабета ( 96). Циркулирующий адипонектин независимо и отрицательно связан с аспектами метаболического синдрома, включая резистентность к инсулину, массу тела, кровяное давление и липиды в сыворотке крови. Лептин в основном вырабатывается в подкожной и в меньшей степени в висцеральной белой жировой ткани. Этот цитокин регулирует потребление пищи, расход энергии и атерогенез. Лептин способствует снижению веса за счет снижения аппетита и стимулирования метаболизма и обладает провоспалительными свойствами ( 97 ).
В нескольких исследованиях сообщалось, что у долгожителей более высокий уровень адипонектина в плазме и более низкие концентрации лептина, чем у более молодых контролей ( 53, 98 — 102). Все формы адипонектина были значительно увеличены у долгожителей, но мультимер HMW был заметно выше ( 99 ). У долгожителей высокие концентрации адипонектина оказались независимыми от ИМТ, почечной или сердечно-сосудистой функции и были связаны с благоприятным метаболическим фенотипом (более высокий уровень ХС-ЛПВП, более низкий гликированный гемоглобин, инсулин, HOMA-IR и триглицериды) ( 98, 99 ). Повышенные уровни адипонектина были также обнаружены у потомков долгоживущих субъектов (старше 95 лет) ( 103 ).
Снижение уровня гормонов щитовидной железы, по-видимому, свойственно долгожителям. Мариотти и соавт. ( 104 ) сообщили, что у здоровых долгожителей были более низкие уровни TSH и FT3 в сыворотке и более высокие уровни rT3 в сыворотке по сравнению с таковыми, наблюдаемыми в других контрольных группах. В другой итальянской популяции долгожителей суммарные значения T4 были ниже нормального диапазона у 60% обследованных ( 105 ). Барановская и соавт. сообщили, что уровни T3 в сыворотке у долгожителей были ниже по сравнению с таковыми у ранних пожилых и молодых женщин ( 52 ). Недавно мы охарактеризовали профиль функции щитовидной железы в итальянской когорте из 672 пациентов (в возрасте 52–113 лет). Отмечено возрастное снижение уровня FT3 и отношения FT3 / FT4, в то время как FT4 и TSH увеличиваются с возрастом ( 106). В семьях китайских долгожителей снижение функции щитовидной железы (высокая ТТГ и низкая концентрация FT3), по-видимому, связано с возрастом, и этот фенотип является наследственным ( 107 ).
Корсонелло и соавт. ( 108 ) обнаружили у родственников долгожителей (потомство или племянницы / племянники) более низкие сопутствующие заболевания, уровни FT3, FT4 и TSH, чем у сопоставимых по возрасту контролей, которые не были родственниками долгожителей. В другой итальянской популяции более низкий уровень FT4 в плазме наблюдался у потомков долгожителей по сравнению с контрольной группой того же возраста ( 60 ).
В целом, долгожители являются худыми ( 109 ) и придерживаются здоровых привычек питания ( 110 ). Подобно субъектам во время ограничения калорийности, у долгожителей наблюдались более медленный рост / метаболизм клеток, лучший контроль передачи сигнала и усиление аутофагии. Посредством анализа метилирования ДНК по всему геному у долгожителей и их потомков мы выявили эпигенетически модулированные гены и пути, потенциально участвующие в процессе старения и долголетия. Наши результаты свидетельствуют о том, что эти популяции характеризовались лучшим сохранением статуса метилирования ДНК, более медленным ростом / метаболизмом клеток и лучшим контролем передачи сигнала через эпигенетические механизмы ( 111). У долгожителей сохранена биоэнергетическая функция благодаря митохондриальной гипертрофии, которая может компенсировать функциональные дефекты ( 112 ). Кроме того, у здоровых долгожителей наблюдаются высокие уровни аутофагии, о чем свидетельствуют более высокие уровни беклина-1 в сыворотке по сравнению как с молодыми пациентами с инфарктом миокарда, так и со здоровыми контролями ( 113 ). Повышение аутофагической активности также наблюдалось у субъектов, принадлежащих к семьям с исключительным долголетием ( 114 ).
Соответствующее явление возникает в отношении воспалительного статуса, который ослабляется у субъектов после ограничения калорийности ( 115, 116 ) и высок у долгожителей ( 117 — 119 ). По мере старения наблюдается состояние слабой и хронической воспалительной патологии ( возрастное воспаление) и повышенная распространенность ряда заболеваний, таких как сердечно-сосудистые заболевания, атеросклероз, опухоли, когнитивные нарушения, остеоартрит и диабет ( 120, 121).). Следовательно, ослабление хронического воспалительного статуса после ограничения калорийности представляет собой благоприятный эффект. Столетние долгожители показывают признаки воспаления, но в то же время, похоже, избавлены от его вредных последствий. Этот очевидный парадокс может быть объяснен тем фактом, что долгожители обладают сложным и своеобразным балансом между провоспалительными и противовоспалительными факторами, что приводит к более медленному, более ограниченному и сбалансированному развитию воспаления по сравнению с пожилыми, для которых характерен неэффективный отвтет для противодействия хроническому воспалению ( 120, 121 ).
Эти данные позволяют предположить общие механизмы увеличения продолжительности жизни и отсрочки возрастных заболеваний, имеющиеся у долгожителей и млекопитающих во время диеты с ограничением калорий.
Мнение авторов.
Доклинические модели позволили получить глубокое представление о процессе старения с помощью согласованных данных, учитывающих роль системы GH / IGF-1 / инсулин в модуляции продолжительности жизни. Хотя хорошо известно, что повышенная чувствительность к инсулину и низкие уровни инсулина связаны с улучшенной выживаемостью, есть несколько доказательств, показывающих, что ослабление оси GH / IGF-1 может оказывать благоприятное влияние на увеличение продолжительности жизни у людей. Однако до сих пор неизвестно, каковы оптимальные уровни IGF-1 в течение жизни, чтобы жить дольше и быть более здоровыми. Кроме того, чувствительность рецептора IGF-1 и активация пострецепторного пути не были оценены в большинстве исследований, включающих долгоживущих субъектов. Следовательно, невозможно определить реальное состояние активации передачи сигналов рецептора IGF-1 посредством простой дозы циркулирующих уровней IGF-1. Это затрудняет определение фармакологических или экологических стратегий, нацеленных на эту систему для увеличения продолжительности жизни и содействия здоровому старению. Всестороннее понимание этих аспектов остается главной проблемой для выявления вмешательств, направленных на замедление старения человека, и применения в реабилитационной медицине. В будущих исследованиях следует оценить функциональное состояние передачи сигналов рецептора IGF-1, в том числе с помощью профилирования транскрипции и анализа функциональных сетей, касающихся генов, регулируемых IGF-1, у долгоживущих субъектов.
Выводы
Поразительное сходство было описано в отношении эндокринного профиля между долгожителями и субъектами после диеты с ограничением калорий. Эндокринная и метаболическая адаптация, наблюдаемая в обеих моделях, может представлять собой физиологическую стратегию для увеличения продолжительности жизни за счет более медленного роста / метаболизма клеток, более медленной потери природного физиологического резерва, перехода клеточного метаболизма от клеточной пролиферации к восстановительной деятельности и уменьшения накопления стареющих клеток. По-видимому, эти механизмы, по крайней мере частично, опосредованы модуляцией системы GH / IGF-1 / инсулин.
Список литературы.
1. Franceschi C, Valensin S, Bonafè M, Paolisso G, Yashin AI, Monti D, et al.. The network and the remodeling theories of aging: historical background and new perspectives. Exp Gerontol. (2000) 35:879–96. 10.1016/S0531-5565(00)00172-8.
2. Bartke A, Darcy J. GH and ageing: Pitfalls and new insights. Best Pract Res Clin Endocrinol Metab. (2017) 31:113–25. 10.1016/j.beem.2017.02.005
3. Vitale G, Salvioli S, Franceschi C. Oxidative stress and the ageing endocrine system. Nat Rev Endocrinol. (2013) 9:228–40. 10.1038/nrendo.2013.29
4. Vitale G, Cesari M, Mari D. Aging of the endocrine system and its potential impact on sarcopenia. Eur J Intern Med. (2016) 35:10–15. 10.1016/j.ejim.2016.07.017
5. Reddy SSK, Chaiban JT. The Endocrinology of aging: a key to longevity “Great Expectations”. Endocr Pract. (2017) 23:1107–16. 10.4158/EP171793.RA
6. Junnila RK, List EO, Berryman DE, Murrey JW, Kopchick JJ. The GH/IGF-1 axis in ageing and longevity. Nat Rev Endocrinol. (2013) 9:366–76. 10.1038/nrendo.2013.67
7. Yakar S, Adamo ML. Insulin-like growth factor 1 physiology: lessons from mouse models. Endocrinol Metab Clin North Am. (2012) 41:231–47. 10.1016/j.ecl.2012.04.008 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 8. Higashi Y, Sukhanov S, Anwar A, Shai SY, Delafontaine P. IGF-1, oxidative stress and atheroprotection. Trends Endocrinol Metab. (2010) 21:245–54. 10.1016/j.tem.2009.12.005 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 9. Belfiore A, Malaguarnera R, Vella V, Lawrence MC, Sciacca L, Frasca F, et al.. Insulin receptor isoforms in physiology and disease: an updated view. Endocr Rev. (2017) 38:379–431. 10.1210/er.2017-00073 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 10. Kenyon C, Chang J, Gensch E, Rudner A, Tabtiang R A C… elegans mutant that lives twice as long as wild type. Nature (1993) 366:461–4. 10.1038/366461a0 [PubMed] [CrossRef] [Google Scholar] 11. Kimura KD, Tissenbaum HA, Liu Y, Ruvkun G. Daf-2, an insulin receptor-like gene that regulates longevity and diapause in Caenorhabditis elegans. Science (1997) 277:942–6. 10.1126/science.277.5328.942 [PubMed] [CrossRef] [Google Scholar] 12. Tatar M, Kopelman A, Epstein D, Tu MP, Yin CM, Garofalo RS, et al.. A mutant Drosophila insulin receptor homolog that extends life-span and impairs neuroendocrine function. Science (2001) 292:107–10. 10.1126/science.1057987 [PubMed] [CrossRef] [Google Scholar] 13. Clancy DJ, Gems D, Harshman LG, Oldham S, Stocker H, Hafen E, et al.. Extension of life-span by loss of CHICO, a Drosophila insulin receptor substrate protein. Science (2001) 292:104–6. 10.1126/science.1057991 [PubMed] [CrossRef] [Google Scholar] 14. Libina N, Berman JR, Kenyon C. Tissue-specific activities of C. elegans DAF-16 in the regulation of lifespan. Cell (2003)115:489–502. 10.1016/S0092-8674(03)00889-4 [PubMed] [CrossRef] [Google Scholar] 15. Broughton S, Partridge L. Insulin/IGF-like signalling, the central nervous system and aging. Biochem J. (2009) 418:1–12. 10.1042/BJ20082102 [PubMed] [CrossRef] [Google Scholar] 16. Reindl KM, Sheridan MA. Peripheral regulation of the growth hormone-insulin-like growth factor system in fish and other vertebrates. Comp Biochem Physiol A Mol Integr Physiol. (2012) 163:231–45. 10.1016/j.cbpa.2012.08.003 [PubMed] [CrossRef] [Google Scholar] 17. Snell GD. Dwarf, a new mendelian recessive character of the house mouse. Proc Natl Acad Sci USA. (1929) 15:733–4. 10.1073/pnas.15.9.733 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 18. Berryman D, Christiansen JS, Johannsson G, Thorner MO, Kopchick JJ. Role of the GH/IGF-1 axis in lifespan and healthspan: lessons from animal models. Growth Horm IGF Res. (2008) 18:455–71. 10.1016/j.ghir.2008.05.005 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 19. Flurkey K, Papaconstantinou J, Miller RA, Harrison DE. Lifespan extension and delayed immune and collagen aging in mutant mice with defects in growth hormone production. Proc Natl Acad Sci USA. (2001) 98:6736–41. 10.1073/pnas.111158898 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 20. Brown-Borg HM, Borg KE, Meliska CJ, Bartke A. Dwarf mice and the ageing process. Nature (1996) 384:33. 10.1038/384033a0 [PubMed] [CrossRef] [Google Scholar] 21. Bartke A, Wright JC, Mattison JA, Ingram DK, Miller RA, Roth GS. Extending the lifespan of long-lived mice. Nature (2001) 414:412. 10.1038/35106646 [PubMed] [CrossRef] [Google Scholar] 22. Panici JA, Harper JM, Miller RA, Bartke A, Spong A, Masternak MM. Early life growth hormone treatment shortens longevity and decreases cellular stress resistance in long-lived mutant mice. FASEB J. (2010) 24:5073–9. 10.1096/fj.10-163253 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 23. Sun LY, Spong A, Swindell WR, Fang Y, Hill C, Huber JA, et al.. Growth hormone-releasing hormone disruption extends lifespan and regulates response to caloric restriction in mice. Elife (2013) 2:e01098. 10.7554/eLife.01098 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 24. Coschigano KT, Clemmons D, Bellush LL, Kopchick JJ. Assessment of growth parameters and life span of GHR/BP gene-disrupted mice. Endocrinology (2000) 141:2608–13. 10.1210/endo.141.7.7586 [PubMed] [CrossRef] [Google Scholar] 25. Ikeno Y, Hubbard GB, Lee S, Cortez LA, Lew CM, Webb CR, et al.. Reduced incidence and delayed occurrence of fatal neoplastic diseases in growth hormone receptor/binding protein knockout mice. J Gerontol A Biol Sci Med Sci. (2009) 64:522–9. 10.1093/gerona/glp017 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 26. Gesing A, Wiesenborn D, Do A, Menon V, Schneider A, Victoria B, et al.. A long-lived mouse lacking both growth hormone and growth hormone receptor: a new animal model for aging studies. J Gerontol A Biol Sci Med Sci. (2017) 72:1054–61. 10.1093/gerona/glw193 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 27. Bonkowski MS, Rocha JS, Masternak MM, Al Regaiey KA, Bartke A. Targeted disruption of growth hormone receptor interferes with the beneficial actions of calorie restriction. Proc Natl Acad Sci USA. (2006) 103:7901–5. 10.1073/pnas.0600161103 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 28. Coschigano KT, Holland AN, Riders ME, List EO, Flyvbjerg A, Kopchick JJ. Deletion, but not antagonism, of the mouse growth hormone receptor results in severely decreased body weights, insulin, and insulin-like growth factor I levels and increased life span. Endocrinology (2003) 144:3799–810. 10.1210/en.2003-0374 [PubMed] [CrossRef] [Google Scholar] 29. Holzenberger M, Dupont J, Ducos B, Leneuve P, Géloën A, Even PC, et al.. IGF-1 receptor regulates lifespan and resistance to oxidative stress in mice. Nature (2003) 421:182–7. 10.1038/nature01298 [PubMed] [CrossRef] [Google Scholar] 30. Bokov AF, Garg N, Ikeno Y, Thakur S, Musi N, DeFronzo RA, et al.. Does reduced IGF-1R signaling in Igf1r+/− mice alter aging? Plos ONE (2011) 6:e26891. 10.1371/journal.pone.0026891 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 31. Xu J, Gontier G, Chaker Z, Lacube P, Dupont J, Holzenberger M. Longevity effect of IGF-1R+/− mutation depends on genetic background-specific receptor activation. Aging Cell (2014) 13:19–28. 10.1111/acel.12145 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 32. Mulvey L, Sinclair A, Selman C. Lifespan modulation in mice and the confounding effects of genetic background. J Genet Genomics (2014) 41:497–503. 10.1016/j.jgg.2014.06.002 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 33. Kappeler L, De Magalhaes Filho C, Dupont J, Leneuve P, Cervera P, Périn L, et al.. Brain IGF-1 receptors control mammalian growth and lifespan through a neuroendocrine mechanism. PLoS Biol. (2008) 6:e254. 10.1371/journal.pbio.0060254tt [PMC free article] [PubMed] [CrossRef] [Google Scholar] 34. Svensson J, Sjögren K, Fäldt J, Andersson N, Isaksson O, Jansson JO, et al. Liver-derived IGF-1 regulates mean life span in mice. PLoS ONE (2011) 6:e22640 10.1371/journal.pone.0022640 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 35. Conover CA, Bale LK. Loss of pregnancy-associated plasma protein A extends lifespan in mice. Aging Cell (2007) 6:727–9. 10.1111/j.1474-9726.2007.00328.x [PubMed] [CrossRef] [Google Scholar] 36. Conover CA. Role of PAPP-A in aging and age-related disease. Exp Gerontol. (2013) 48:612–3. 10.1016/j.exger.2012.06.017 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 37. Selman C, Lingard S, Choudhury AI, Batterham RL, Claret M, Clements M, et al.. Evidence for lifespan extension and delayed age-related biomarkers in insulin receptor substrate 1 null mice. FASEB J. (2008) 22:807–18. 10.1096/fj.07-9261com [PubMed] [CrossRef] [Google Scholar] 38. Taguchi A, Wartschow LM, White MF. Brain IRS2 signaling coordinates life span and nutrient homeostasis. Science (2000) 317:369–72. 10.1126/science.1142179 [PubMed] [CrossRef] [Google Scholar] 39. Kuro M, Matsumura Y, Aizawa H, Kawaguchi H, Suga T, Utsugu T, et al. Mutation of the mouse Klotho gene leads to a syndrome resembling ageing. Nature (1997) 390:45–51. 10.1038/36285 [PubMed] [CrossRef] [Google Scholar] 40. Kurosu H, Yamamoto M, Clark JD, Pastor JV, Nandi A, Gurnani P, et al.. Suppression of aging in mice by the hormone Klotho. Science (2005) 309:1829–33. 10.1126/science.1112766 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 41. Migliaccio E, Giorgio M, Mele S, Pelicci G, Reboldi P, Pandolfi PP, et al. The p66 Shc adaptor protein controls oxidative stress response and life span in mammals. Nature (1999) 402:309–13. 10.1038/46311 [PubMed] [CrossRef] [Google Scholar] 42. Ramsey JJ, Tran D, Giorgio M, Griffey SM, Koehne A, Laing ST, et al.. The influence of Shc proteins on life span in mice. J Gerontol A Biol Sci Med Sci. (2014) 69:1177–85. 10.1093/gerona/glt198 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 43. Ashpole NM, Logan S, Yabluchanskiy A, Mitschelen MC, Yan H, Farley JA, et al.. IGF-1 has sexually dimorphic, pleiotropic, and time-dependent effects on healthspan, pathology, and lifespan. Geroscience (2017) 39:129–45. 10.1007/s11357-017-9971-0 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 44. Mao K, Quipildor GF, Tabrizian T, Novaj A, Guan F, Walters RO, et al.. Late-life targeting of the IGF-1 receptor improves healthspan and lifespan in female mice. Nat Commun. (2018) 9:2394. 10.1038/s41467-018-04805-5 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 45. Franceschi C, Passarino G, Mari D, Monti D. Centenarians as a 21st century healthy aging model: a legacy of humanity and the need for a world-wide consortium (WWC100+). Mech Ageing Dev. (2017) 165(Pt. B):55–8. 10.1016/j.mad.2017.06.002 [PubMed] [CrossRef] [Google Scholar] 46. Vitale G, Barbieri M, Kamenetskaya M, Paolisso G. GH/IGF-I/insulin system in centenarians. Mech Ageing Dev. (2017) 165:107–114. 10.1016/j.mad.2016.12.001 [PubMed] [CrossRef] [Google Scholar] 47. Ferrannini E, Vichi S, Beck-Nielsen H, Laasko M, Paolisso G, Smith U. For European Group for the Study of Insulin Resistance (EGIR). Insulin action and age. Diabetes (1996) 45:947–53. 10.2337/diab.45.7.947 [PubMed] [CrossRef] [Google Scholar] 48. Paolisso G, Barbieri M, Rizzo MR, Carella C, Rotondi M, Bonafè M, et al. Low insulin resistance and preserved beta-cell function contribute to human longevity but are not associated with TH-INS genes. Exp Gerontol. (2001) 37:149–56. 10.1016/S0531-5565(01)00148-6 [PubMed] [CrossRef] [Google Scholar] 49. Paolisso G, Gambardella A, Ammendola S, D’Amore A, Balbi V, Varricchio M, et al.. Glucose tolerance and insulin action in healty centenarians. Am J Physiol. (1996) 270:E890–4. 10.1152/ajpendo.1996.270.5.E890 [PubMed] [CrossRef] [Google Scholar] 50. Paolisso G, Gambardella A, Ammendola S, Tagliamonte MR, Rizzo MR, Capurso A, et al.. Preserved antilipolytic insulin action is associated with a less atherogenic plasma lipid profile in healthy centenarians. J Am Geriatr Soc. (1997) 45:1504–9. 10.1111/j.1532-5415.1997.tb03203.x [PubMed] [CrossRef] [Google Scholar] 51. Vitale G, Brugts M, Ogliari G, Castaldi D, Fatti L, Varewijck A, et al.. Low circulating IGF-I bioactivity is associated with human longevity: findings in centenarians’ offspring. Aging (2012) 4:580–89. 10.18632/aging.100484 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 52. Baranowska B, Wolinska-Witort E, Bik W, Baranowska-Bik A, Martynska L, Broczek K, et al.. Evaluation of neuroendocrine status in longevity. Neurobiol Aging (2007) 28:774–83. 10.1016/j.neurobiolaging.2006.03.014 [PubMed] [CrossRef] [Google Scholar] 53. Paolisso G, Manzella D, Barbieri M, Rizzo MR, Gambardella A, Varricchio M. Baseline heart rate variability in healthy centenarians: differences vs. aged subject. Clin. Sci. (1999) 97:579–84. 10.1042/cs0970579 [PubMed] [CrossRef] [Google Scholar] 54. Paolisso G, Tagliamonte MR, Rizzo MR, Carella C, Gambardella A, Barbieri M, et al. Low plasma Insulin like growth factor-1 concentrations predict worsening of insulin mediated glucose uptake in the elderly. J. Am. Geriatr. Soc. (1999) 47:1312–8. 10.1111/j.1532-5415.1999.tb07431.x [PubMed] [CrossRef] [Google Scholar] 55. Paolisso G, Ammendola S, Del Buono A, Gambardella A, Riondino M, Tagliamonte MR, et al.. Serum levels of insulin-like growth factor-I (IGF-I) and IGF-binding protein-3 in healthy centenarians: relationship with plasma leptin and lipid concentrations, insulin action, and cognitive function. J Clin Endocrinol Metab. (1997) 82:2204–9. 10.1210/jcem.82.7.4087 [PubMed] [CrossRef] [Google Scholar] 56. Bonafè M, Barbieri M, Marchegiani F, Olivieri F, Ragno E, Giampieri C, et al.. Polymorphic variants of insulin-like growth factor I (IGF-I) receptor and phosphoinositide 3-kinase genes affect IGF-I plasma levels and human longevity: cues for an evolutionarily conserved mechanism of life span control. J Clin Endocrinol Metab. (2003) 88:3299–304. 10.1210/jc.2002-021810 [PubMed] [CrossRef] [Google Scholar] 57. Arai Y, Hirose N, Yamamura K, Shimizu K, Takayama M, Ebihara Y, et al.. Serum insulin-like growth factor-1 in centenarians: implications of IGF-1 as a rapid turnover protein. J Gerontol A Biol Sci Med Sci. (2001) 56:M79–82. 10.1093/gerona/56.2.M79 [PubMed] [CrossRef] [Google Scholar] 58. Arai Y, Takayama M, Gondo Y, Inagaki H, Yamamura K, Nakazawa S, et al.. Adipose endocrine function, insulin-like growth factor-1 axis, and exceptional survival beyond 100 years of age. J Gerontol A Biol Sci Med Sci. (2008) 63:1209–18. 10.1093/gerona/63.11.1209 [PubMed] [CrossRef] [Google Scholar] 59. Herr M, Jeune B, Fors S, Andersen-Ranberg K, Ankri J, Arai Y, et al.. Frailty and associated factors among centenarians in the 5-COOP countries. Gerontology (2018) 64:521–31. 10.1159/000489955 [PubMed] [CrossRef] [Google Scholar] 60. Bucci L, Ostan R, Cevenini E, Pini E, Scurti M, Vitale G, et al.. Centenarians’ offspring as a model of healthy aging: a reappraisal of the data on Italian subjects and a comprehensive overview. Aging (Albany. NY). (2016) 8:1–11. 10.18632/aging.100912 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 61. Gueresi P, Miglio R, Monti D, Mari D, Sansoni P, Caruso C, et al.. Does the longevity of one or both parents influence the health status of their offspring? Exp Gerontol. (2013) 48:395–400. 10.1016/j.exger.2013.02.004 [PubMed] [CrossRef] [Google Scholar] 62. Horvath S, Pirazzini C, Bacalini MG, Gentilini D, Di Blasio AM, Delledonne M, et al.. Decreased epigenetic age of PBMCs from Italian semi-supercentenarians and their offspring. Aging (2015) 7:1159–70. 10.18632/aging.100861 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 63. Caselli G, Pozzi L, Vaupel JW, Deiana L, Pes G, Carru C, et al.. Family clustering in Sardinian longevity: a genealogical approach. Exp Gerontol. (2006) 41:727–36. 10.1016/j.exger.2006.05.009 [PubMed] [CrossRef] [Google Scholar] 64. Suh Y, Atzmon G, Cho MO, Hwang D, Liu B, Leahy DJ, et al.. Functionally significant insulin-like growth factor I receptor mutations in centenarians. Proc Natl Acad Sci USA. (2008) 105:3438–42. 10.1073/pnas.0705467105 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 65. Deelen J, van den Akker EB, Trompet S, van Heemst D, Mooijaart SP, Slagboom PE, Beekman M. Employing biomarkers of healthy ageing for leveraging genetic studies into human longevity. Exp Gerontol. (2016) 82:166–74. 10.1016/j.exger.2016.06.013 [PubMed] [CrossRef] [Google Scholar] 66. van der Spoel E, Rozing MP, Houwing-Duistermaat JJ, Slagboom PE, Beekman M, de Craen AJ, et al.. Association analysis of insulin-like growth factor-1 axis parameters with survival and functional status in nonagenarians of the Leiden Longevity Study. Aging (2015) 7:956–63. 10.18632/aging.100841 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 67. Rozing MP, Westendorp RG, Frölich M, de Craen AJ, Beekman M, Heijmans BT, et al.. Human insulin/IGF-1 and familial longevity at middle age. Aging (2009) 1:714–22. 10.18632/aging.100071 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 68. van der Spoel E, Jansen SW, Akintola AA, Ballieux BE, Cobbaert CM, Slagboom PE, et al.. Growth hormone secretion is diminished and tightly controlled in humans enriched for familial longevity. Aging Cell (2016) 15:1126–31. 10.1111/acel.12519 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 69. Sebastiani P, Sun FX, Andersen SL, Lee JH, Wojczynski MK, Sanders JL, et al.. Families enriched for exceptional longevity also have increased health-span: findings from the long life family study. Front Public Health (2013) 1:38. 10.3389/fpubh.2013.00038 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 70. Sebastiani P, Thyagarajan B, Sun F, Honig LS, Schupf N, Cosentino S, et al.. Age and sex distributions of age-related biomarker values in healthy older adults from the long life family study. J Am Geriatr Soc. (2016) 64:e189–94. 10.1111/jgs.14522 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 71. Teumer A, Qi Q, Nethander M, Aschard H, Bandinelli S, Beekman M, et al.. Genomewide meta-analysis identifies loci associated with IGF-I and IGFBP-3 levels with impact on age-related traits. Aging Cell (2016) 15:811–24. 10.1111/acel.12490 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 72. Deelen J, Uh HW, Monajemi R, van Heemst D, Thijssen PE, Böhringer S, et al.. Gene set analysis of GWAS data for human longevity highlights the relevance of the insulin/IGF-1 signaling and telomere maintenance pathways. Age (2013) 35:235–49. 10.1007/s11357-011-9340-3 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 73. van Heemst D, Beekman M, Mooijaart SP, Heijmans BT, Brandt BW, Zwaan BJ, et al.. Reduced insulin/IGF-1 signalling and human longevity. Aging Cell (2005) 4:79–85. 10.1111/j.1474-9728.2005.00148.x [PubMed] [CrossRef] [Google Scholar] 74. Ben-Avraham D, Govindaraju DR, Budagov T, Fradin D, Durda P, Liu B, et al.. The GH receptor exon 3 deletion is a marker of male-specific exceptional longevity associated with increased GH sensitivity and taller stature. Sci Adv. (2017) 3:e1602025. 10.1126/sciadv.1602025 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 75. McKiernan SH, Colman RJ, Lopez M, Beasley TM, Aiken JM, Anderson RM, et al.. Caloric restriction delays aging-induced cellular phenotypes in rhesus monkey skeletal muscle. Exp Gerontol. (2011) 46:23–9. 10.1016/j.exger.2010.09.011 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 76. Colman RJ, Anderson RM, Johnson SC, Kastman EK, Kosmatka KJ, Beasley TM, et al. Calorie restriction delays disease onset and mortality in rhesus monkeys. Science (2009) 325:201–4. 10.1126/science.1173635 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 77. Willcox DC, Willcox BJ, Todoriki H, Curb JD, Suzuki M. Caloric restriction and human longevity: what can we learn from the Okinawans? Biogerontology (2006) 7:173–7. 10.1007/s10522-006-9008-z [PubMed] [CrossRef] [Google Scholar] 78. Mattison JA, Roth GS, Beasley TM, Tilmont EM, Handy AM, Herbert RL, et al.. Impact of caloric restriction on health and survival in rhesus monkeys from the NIA study. Nature (2012) 489:318–21. 10.1038/nature11432 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 79. Dunn SE, Kari FW, French J, Leininger JR, Travlos G, Wilson R, et al.. Dietary restriction reduces insulin-like growth factor I levels, which modulates apoptosis, cell proliferation, and tumor progression in p53-deficient mice. Cancer Res. (1997) 57:4667–72. [PubMed] [Google Scholar] 80. Berrigan D, Perkins SN, Haines DC, Hursting SD. Adult-onset calorie restriction and fasting delay spontaneous tumorigenesis in p53-deficient mice. Carcinogenesis (2002) 23:817–22. 10.1093/carcin/23.5.817 [PubMed] [CrossRef] [Google Scholar] 81. Redman LM, Veldhuis JD, Rood J, Smith SR, Williamson D, Ravussin E, et al.. The effect of caloric restriction interventions on growth hormone secretion in nonobese men and women. Aging Cell (2010) 9:32–9. 10.1111/j.1474-9726.2009.00530.x [PMC free article] [PubMed] [CrossRef] [Google Scholar] 82. Fontana L, Villareal DT, Das SK, Smith SR, Meydani SN, Pittas AG, et al.. Effects of 2-year calorie restriction on circulating levels of IGF-1, IGF-binding proteins and cortisol in nonobese men and women: a randomized clinical trial. Aging Cell (2016) 15:22–7. 10.1111/acel.12400 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 83. Lettieri-Barbato D, Giovannetti E, Aquilano K. Effects of dietary restriction on adipose mass and biomarkers of healthy aging in human. Aging (2016) 8:3341–55. 10.18632/aging.101122 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 84. Mercken EM, Crosby SD, Lamming DW, JeBailey L, Krzysik-Walker S, Villareal DT, et al.. Calorie restriction in humans inhibits the PI3K/AKT pathway and induces a younger transcription profile. Aging Cell (2013) 12:645–51. 10.1111/acel.12088 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 85. Arai Y, Kojima T, Takayama M, Hirose N. The metabolic syndrome, IGF-1, and insulin action. Mol Cell Endocrinol. (2009) 299:124–8. 10.1016/j.mce.2008.07.002 [PubMed] [CrossRef] [Google Scholar] 86. Redman LM, Ravussin E. Endocrine alterations in response to calorie restriction in humans. Mol Cell Endocrinol. (2009) 299:129–36. 10.1016/j.mce.2008.10.014 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 87. Franceschi C, Garagnani P, Vitale G, Capri M, Salvioli S. Inflammaging and ‘Garb-aging’. Trends Endocrinol Metab. (2017) 28:199–212. 10.1016/j.tem.2016.09.005 [PubMed] [CrossRef] [Google Scholar] 88. Qian M, Liu B. Pharmaceutical Intervention of Aging. Adv Exp Med Biol. (2018) 1086:235–54. 10.1007/978-981-13-1117-8_15 [PubMed] [CrossRef] [Google Scholar] 89. Baker DJ, Wijshake T, Tchkonia T, LeBrasseur NK, Childs BG, van de Sluis B, et al.. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature (2011) 479:232–6. 10.1038/nature10600 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 90. Derous D, Mitchell SE, Wang L, Green CL, Wang Y, Chen L, et al.. The effects of graded levels of calorie restriction: XI. Evaluation of the main hypotheses underpinning the life extension effects of CR using the hepatic transcriptome. Aging (2017) 9:1770–824. 10.18632/aging.101269 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 91. Madeo F, Tavernarakis N, Kroemer G. Can autophagy promote longevity? Nat Cell Biol. (2010) 12:842–6. 10.1038/ncb0910-842 [PubMed] [CrossRef] [Google Scholar] 92. Cevenini E, Monti D, Franceschi C. Inflamm-ageing. Curr Opin Clin Nutr Metab Care. (2013) 16:14–20. 10.1097/MCO.0b013e32835ada13 [PubMed] [CrossRef] [Google Scholar] 93. Meydani SN, Das SK, Pieper CF, Lewis MR, Klein S, Dixit VD, et al.. Long-term moderate calorie restriction inhibits inflammation without impairing cell-mediated immunity: a randomized controlled trial in non-obese humans. Aging (2016) 8:1416–31. 10.18632/aging.100994 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 94. Ott B, Skurk T, Hastreiter L, Lagkouvardos I, Fischer S, Büttner J, et al.. Effect of caloric restriction on gut permeability, inflammation markers, and fecal microbiota in obese women. Sci Rep. (2017) 7:11955. 10.1038/s41598-017-12109-9 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 95. Unamuno X, Gómez-Ambrosi J, Rodríguez A, Becerril S, Frühbeck G, Catalán V. Adipokine dysregulation and adipose tissue inflammation in human obesity. Eur J Clin Invest. (2018) 48:e12997. 10.1111/eci.12997 [PubMed] [CrossRef] [Google Scholar] 96. Liu M, Liu F. Regulation of adiponectin multimerization, signaling and function. Best Pract Res Clin Endocrinol Metab. (2014) 28:25–31. 10.1016/j.beem.2013.06.003 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 97. Balaskó M, Soós S, Székely M, Pétervári E. Leptin and aging: Review and questions with particular emphasis on its role in the central regulation of energy balance. J Chem Neuroanat. (2014) 61–62:248–55. 10.1016/j.jchemneu.2014.08.006 [PubMed] [CrossRef] [Google Scholar] 98. Arai Y, Nakazawa S, Kojima T, Takayama M, Abihara Y, Shimizu K, et al. High adiponectin concentration and its role for longevity in female centenarians. Geriatr Gerontol Int. (2006) 6:32–9. 10.1111/j.1447-0594.2006.00304.x [CrossRef] [Google Scholar] 99. Bik W, Baranowska-Bik A, Wolinska-Witort E, Kalisz M, Broczek K, Mossakowska M, et al.. Assessment of adiponectin and its isoforms in Polish centenarians. Exp Gerontol. (2013) 48:401–7. 10.1016/j.exger.2013.01.015 [PubMed] [CrossRef] [Google Scholar] 100. Meazza C, Vitale G, Pagani S, Castaldi D, Ogliari G, Mari D, et al.. Common adipokine features of neonates and centenarians. J Pediatr Endocrinol Metab. (2011) 24:953–7. 10.1515/JPEM.2011.373 [PubMed] [CrossRef] [Google Scholar] 101. Baranowska B, Bik W, Baranowska-Bik A, Wolinska-Witort E, Szybinska A, Martynska L, et al.. Neuroendocrine control of metabolic homeostasis in Polish centenarians. J Physiol Pharmacol. (2006) 57 (Suppl. 6):55–61. [PubMed] [Google Scholar] 102. Miura Y, Hashii N, Tsumoto H, Takakura D, Ohta Y, Abe Y, et al.. Change in N-glycosylation of plasma proteins in Japanese semisupercentenarians. PLoS ONE (2015) 10:e0142645. 10.1371/journal.pone.0142645 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 103. Atzmon G, Pollin TI, Crandall J, Tanner K, Schechter CB, Scherer PE, et al.. Adiponectin levels and genotype: a potential regulator of life span in humans. J Gerontol A Biol Sci Med Sci. (2008) 63:447–53. 10.1093/gerona/63.5.447 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 104. Mariotti S, Barbesino G, Caturegli P, Bartalena L, Sansoni P, Fagnoni F, et al.. Complex alteration of thyroid function in healthy centenarians. J Clin. Endocrinol Metab. (1993) 77:1130–4. 10.1210/jcem.77.5.8077303 [PubMed] [CrossRef] [Google Scholar] 105. Maugeri D, Russo MS, Di Stefano F, Receputo G, Rosso D, Rapisarda R, et al.. Thyroid function in healthy centenarians. Arch Gerontol Geriatr. (1997) 25:211–7. 10.1016/S0167-4943(97)00012-5 [PubMed] [CrossRef] [Google Scholar] 106. Ostan R, Monti D, Mari D, Arosio B, Gentilini D, Ferri E, et al.. Heterogeneity of thyroid function and impact of peripheral thyroxine deiodination in centenarians and semi-supercentenarians: association with functional status and mortality. J Gerontol A Biol Sci Med Sci. (2018). 10.1093/gerona/gly194. [Epub ahead of print]. [PubMed] [CrossRef] [Google Scholar] 107. He Y, Chen X, Yan D, Xiao F, Liu Y, Lin R, et al.. Thyroid function decreases with age and may contribute to longevity in chinese centenarians’ families. JAGS (2015) 63:1474–6. 10.1111/jgs.13553 [PubMed] [CrossRef] [Google Scholar] 108. Corsonello A, Montesanto A, Berardelli M, De Rango F, Dato S, Mari V, et al.. A cross-section analysis of FT3 age-related changes in a group of old and oldest-old subjects, including centenarians’ relatives, shows that a down-regulated thyroid function has a familial component and is related to longevity. Age Ageing (2010) 39:723–7. 10.1093/ageing/afq116 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 109. Pereira da Silva A, Matos A, Valente A, Gil Â, Alonso I, Ribeiro R, et al.. Body composition assessment and nutritional status evaluation in men and women portuguese centenarians. J Nutr Health Aging (2016) 20:256–66. 10.1007/s12603-015-0566-0 [PubMed] [CrossRef] [Google Scholar] 110. Franceschi C, Ostan R, Santoro A. Nutrition and inflammation: are centenarians similar to individuals on calorie-restricted diets? Annu Rev Nutr. (2018) 38:329–56. 10.1146/annurev-nutr-082117-051637 [PubMed] [CrossRef] [Google Scholar] 111. Gentilini D, Mari D, Castaldi D, Remondini D, Ogliari G, Ostan R, et al.. Role of epigenetics in human aging and longevity: genome-wide DNA methylation profile in centenarians and centenarians’ offspring. Age (2013) 35:1961–73. 10.1007/s11357-012-9463-1 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 112. Sgarbi G, Matarrese P, Pinti M, Lanzarini C, Ascione B, Gibellini L, et al.. Mitochondria hyperfusion and elevated autophagic activity are key mechanisms for cellular bioenergetic preservation in centenarians. Aging (2014) 6:296–310. 10.18632/aging.100654 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 113. Emanuele E, Minoretti P, Sanchis-Gomar F, Pareja-Galeano H, Yilmaz Y, Garatachea N, et al.. Can enhanced autophagy be associated with human longevity? Serum levels of the autophagy biomarker beclin-1 are increased in healthy centenarians. Rejuvenation Res. (2014) 17:518–24. 10.1089/rej.2014.1607 [PubMed] [CrossRef] [Google Scholar] 114. Raz Y, Guerrero-Ros I, Maier A, Slagboom PE, Atzmon G, Barzilai N, et al.. Activation-induced autophagy is preserved in CD4+ T-cells in familial longevity. J Gerontol A Biol Sci Med Sci. (2017) 72:1201–6. 10.1093/gerona/glx020 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 115. Fontana L, Villareal DT, Weiss EP, Racette SB, Steger-May K, et al. Calorie restriction or exercise: effects on coronary heart disease risk factors. A randomized, controlled trial. Am J Physiol Endocrinol Metab. (2007) 293:E197–202. 10.1152/ajpendo.00102.2007 [PubMed] [CrossRef] [Google Scholar] 116. Ravussin E, Redman LM, Rochon J, Das SK, Fontana L, et al.. A 2-year randomized controlled trial of human caloric restriction: feasibility and effects on predictors of health span and longevity. J Gerontol A Biol Sci Med Sci. (2015) 70:1097–104. 10.1093/gerona/glv057 [PMC free article] [PubMed] [CrossRef] [Google Scholar] 117. Bruunsgaard H, Andersen-Ranberg K, Jeune B, Pedersen AN, Skinhoj P, Pedersen BK. A high plasma concentration of TNF-α is associated with dementia in centenarians. J Gerontol A Biol Sci Med Sci. (1999) 54:M357–64. 10.1093/gerona/54.7.M357 [PubMed] [CrossRef] [Google Scholar] 118. Gangemi S, Basile G, Merendino RA, Minciullo PL, Novick D, et al.. Increased circulating interleukin-18 levels in centenarians with no signs of vascular disease: another paradox of longevity? Exp Gerontol. (2003) 38:669–72. 10.1016/S0531-5565(03)00061-5 [PubMed] [CrossRef] [Google Scholar] 119. Gerli R, Monti D, Bistoni O, Mazzone AM, Peri G, et al.. Chemokines, sTNF-Rs and sCD30 serum levels in healthy aged people and centenarians. Mech. Ageing Dev. (2000) 121:37–46. 10.1016/S0047-6374(00)00195-0 [PubMed] [CrossRef] [Google Scholar] 120. Franceschi C, Capri M, Monti D, Giunta S, Olivieri F, Sevini F, et al.. Inflammaging and anti-inflammaging: a systemic perspective on aging and longevity emerged from studies in humans. Mech Ageing Dev. (2007) 128:92–105. 10.1016/j.mad.2006.11.016 [PubMed] [CrossRef] [Google Scholar] 121. Salvioli S, Monti D, Lanzarini C, Conte M, Pirazzini C, Bacalini MG, et al.. Immune system, cell senescence, aging and longevity–inflamm-aging reappraised. Curr Pharm Des. (2013) 19:1675–9. 10.2174/1381612811319090015
Источник:
Giovanni Vitale, Giuseppe Pellegrino, Maria Vollery, and Leo J. Hofland. ROLE of IGF-1 System in the Modulation of Longevity: Controversies and New Insights From a Centenarians’ Perspective Front Endocrinol (Lausanne). 2019; 10: 27.
Источник


