В одной из недавних статей «Киборги идут, или как Neuralink Илона Маска приближает киберпанк», опубликованной в корпблоге компании FirstVDS, уважаемый @klimensky затронул тему Neuralink и нейрокомпьютерных интерфейсов в целом. 1 февраля 2024 года в корпоративном блоге компании Onlinepatent уважаемая Людмила Кудрявцева @ko_ya также опубликовала классную статью «Не только Neuralink: что такое нейроинтерфейсы и кто кроме Маска разрабатывает их». Действительно, нейроинтерфейсы типа «мозг-компьютер» (BCI, brain-computer interface) уже являются не причудой таких практикующих футурологов, как Курцвейл или Маск, а растущей нишей высокотехнологичного рынка. Ниже я остановлюсь на некоторых технических аспектах таких устройств, постараюсь рассмотреть их перспективы и опасения, с ними связанные.
Как и любая технология, способная принципиально изменить жизнь общества, нейроинтерфейс вызывает опасения, гипертрофированный скепсис, а также завышенные ожидания. Страхи, связанные с нейроинтерфейсами, приобретают отчётливо луддитские акценты. Тем не менее, капиталистический и грантовый уклад современной науки явно располагает к развитию и демократизации этой технологии. Первые варианты применения интерфейсов «мозг-компьютер» (далее BCI) — биомедицинские. Эти устройства уже востребованы для лечения таких тяжёлых заболеваний как боковой амиотрофический склероз (болезнь Стивена Хокинга) и синдром запертого человека.
Использование нейроимплантатов в медицине уже стало обычной практикой. Например, кохлеарные имплантаты широко применяются для усиления слуха (составляя конкуренцию обычным слуховым аппаратам), а первый такой имплантат был внедрён человеку в 1976 году.

То же можно сказать и о глубокой стимуляции мозга (DBS). Эта терапия, как инвазивная, так и неинвазивная, применяется, в частности, для облегчения болезни Паркинсона и для купирования хронической боли. У неё есть серьёзные побочные эффекты, в том числе, нарушение фазы глубокого сна, но на фоне серьёзности основного заболевания они справедливо считаются приемлемыми. Ранее я рассказывал на Хабре аналогичную историю о возвращении талидомида в клиническую практику.
В настоящее время индустрия нейроимплантатов развивается как одно из ответвлений «Интернета вещей» и давно вышла за рамки академических и спекулятивных исследований. «Интернет Вещей» — это беспроводные и всё более миниатюрные устройства. Первый беспроводной нейроимплантат был протестирован в конце 2016 года для восстановления подвижности задних лап у макак-резусов. Животным специально перебивали позвоночник, но имплантат позволял им сохранять мобильность в течение нескольких недель..

Другой знаковый проект – система BrainGate, многосторонний научно-коммерческий проект, совместно выполняемый Брауновским университетом и центральной больницей штата Массачусетс. В BrainGate применяется массив микроэлектродов, приживляемых в моторную кору и записывающих нейронные импульсы, позволяющие проследить высшую нервную деятельность от намерения до движения. Эти сигналы можно программно преобразовать в команды, которые затем используются для управления курсором на экране компьютера, роботизированным манипулятором или умной инвалидной коляской, на которой находится пациент с нейроимплантатом.
В рамках смежного проекта BrainGate2 применялась система электродов-бусинок, вживляемых в моторную кору и в руку обездвиженного пациента. Она позволила восстановить двигательную активность в такой степени, что человек (парализованный после аварии при падении с велосипеда) был в состоянии выйти в Интернет через планшет:

В 2021 году в рамках клинического исследования BrainGate, проводимого в период с 2009 по 2038 год, пациентам с квадроплегией впервые удалось управлять беспроводным BCI, вживлённым в кору головного мозга и дистанционно подключаемым к беспроводному передатчику. Система позволяет передавать сигналы с разрешением до одного нейрона без необходимости ограничивать движения пользователя. Беспроводная и проводная система подключаются к мозгу через один и тот же интерфейс, позволяют обращаться с планшетом. При этом обеспечивается как высокая точность кликабельности, так и набор текста на клавиатуре (другие примеры с набором текста на клавиатуре будут рассмотрены ниже).
Можно сказать, что такие устройства выводят нейрофизиологические функции инвалида из большого минуса в небольшой плюс. Схожая система NeuroLife позволила обогнуть повреждённый позвоночник, так, что пациент смог уверенно управлять кистями рук. Тем не менее, уже подоспело и следующее поколение устройств, которые увеличивают «пропускную способность» здорового мозга, улучшают его функцию. Например, профессор Ньютон Ховард из Оксфордского университета представил прототип Ni2O, который можно сравнить с наноразмерным усилителем нейронных импульсов, работа которого основана на проприетарных алгоритмах. Наконец, отмечу «усилитель памяти», разработанный в 2017 году в Университете Южной Калифорнии и, по заявлению исследователей, помогающий своему носителю лучше проходить мнемонические тесты.
История разработок и ЭЭГ
По-видимому, идеи о налаживании электрически опосредованного взаимодействия между машиной и нейронной тканью восходят к рубежу 1950-х и 1960-х, когда была достаточно изучена и освоена электроэнцефалография (первая неинвазивная процедура ЭЭГ успешно проведена в 1924 году в Германии Хансом Бергером). Нейрокомпьютерные интерфейсы, в отличие от аппарата для энцефалографии, обеспечивают не только считывание, но и провоцирование (стимуляцию) нейронных импульсов, а в перспективе – и запись синтетических воспоминаний. Эти исследования во многом прояснили организацию и работу центральной нервной системы, а также её взаимодействие с периферической. Потенциально нейроимплантаты помогают справиться не только с такими дегенеративными заболеваниями как болезнь Паркинсона, но и с последствиями тяжёлых травм и опухолей мозга. Начиная с 1960-х нейроимплантаты применяются для лечения глухоты, слепоты, паралича и эпилепсии. Развитие такого аппаратного обеспечения идёт медленно, так как пока очень сложно обеспечивать бесшовное взаимодействие между проводником и нейронной тканью. Поскольку структуру нейронной ткани не изменить, приходится приближать к ней свойства электродов. Элементарный набор требований к таким электродам:
1) Выгодное соотношение «сигнал-шум»
2) Высокая плотность датчиков
3) Биосовместимость
4) Долгосрочная стабильность
5) Минимальная опасность воспаления
Все эти требования располагают к исследованиям по поиску новых материалов для высокопроизводительного электрода. Здесь сохраняется постоянный конфликт между электропроводимостью и биосовместимостью. Основная сложность в том, что на все металлы кроме титана возможна иммунная и воспалительная реакция.
Электроника во вживляемых устройствах (например, в кохлеарных имплантатах) в основном изготавливается из металлов и оксидов металлов, которые практически не совместимы с нейронной тканью. Из-за несовпадения жёсткости между имплантатом и тканью такие электроды с трудом образуют конформный контакт с тканью, тем самым препятствуя интеграции нейронов и имплантата. Соответственно, производительность BMI напрямую зависит от механических и электрических свойств материала. Требуется как можно сильнее снизить модуль и электрический импеданс BMI, и для этого можно увеличить площадь контакта имплантата с тканью. Для этого рабочий элемент имплантата должен быть сопоставим по размеру с нейроном, то есть, стать наноразмерным.
С функциональной точки зрения кора больших полушарий неоднородна, равно как неоднородны и скорость отклика нейронов и активность образования синапсов у разных людей. Таким образом, для оптимального распределения имплантатов и силы их сигнала можно было бы выявить оптимальные точки для имплантации и разработать соединяемость между ними при помощи алгоритмов глубокого обучения. Речь о надстройке аппаратной нейронной сети над биологической. Такой метод привёл бы к созданию нейроинтерфейсов с замкнутым циклом работы, проект подобного интерфейса описан, например, здесь. Обучение такого интерфейса следовало бы проводить на высшей нервной деятельности его будущего пользователя, то есть, сильно персонализировать такие алгоритмы. Длительность обучения зависит от количества команд, которые получает нейроинтерфейс, а также от возраста и степени физического и умственного здоровья носителя.
Эксплуатация интерфейса
В научной литературе эксплуатация нейроинтерфейса структурируется таким образом: имплантаты (электроды) фиксируют сигналы мозга, которые затем передаются на вычислительное устройство (микроконтроллер) для очистки сигнала от шума. Шум может провоцироваться как внешними факторами, так и зависеть от качества самого имплантата. Затем полученный сигнал анализируется и интерпретируется. Потенциально для этого можно было бы использовать нейронные сети, обученные на высшей нервной деятельности как большой человеческой популяции, так и конкретного носителя интерфейса. Процесс можно представить примерно так:

Современные BCI отличаются по степени инвазивности. Их можно разделить на три категории: инвазивные, неинвазивные и полуинвазивные. При установке инвазивного нейроинтерфейса микроэлектроды внедряются непосредственно в кору мозга. Такие устройства обладают максимальной эффективностью, но несут и наибольшие риски, которые мы подробнее обсудим в разделе о материалах и физиологических реакциях. Неинвазивные BMI функционально аналогичны аппарату для электроэнцефалографии (EEG), в том числе, магнитной (MEG), с их помощью можно преимущественно анализировать электрическую активность мозга, но не влиять на неё. Имплантации как таковой не происходит. Полуинвазивные имплантаты заводятся под черепную коробку и примыкают к коре мозга, обеспечивая электрокортикографию (ECoG)..
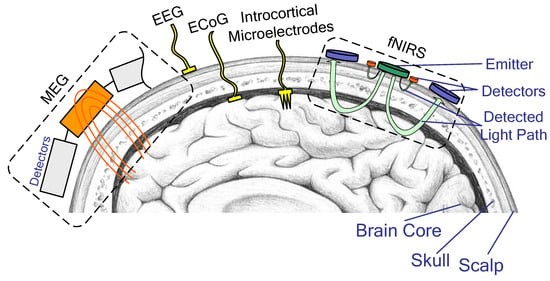
В настоящее время инвазивные и полуинвазивные BCI-интерфейсы используются почти исключительно в медицине, в том числе, регенеративной. Эти приборы нужны для частичного купирования тяжёлой инвалидности. В свою очередь, неинвазивные BMI постепенно проникают в игровую индустрию. Тема игровых нейрогаджетов огромна и заслуживает отдельной статьи на Хабре, но для интересующихся я оставлю здесь ссылку на лекцию Тимофея Глинина, в которой подробно разобрана эта тема.
Таким образом, большинство BCI (считая Neuralink) сейчас применяются в нейромедицинских целях, в частности, для компенсации работы органов чувств и восстановления утраченных моторных функций. Интересная разработка была впервые представлена в 2017 году исследователями из Стэнфорда: парализованной женщине вживили имплантат, при помощи которого она смогла силой мысли набирать текст со скоростью восемь слов в минуту. С тех пор подобные разработки постоянно совершенствуются, и в 2021 году был представлен интерфейс, позволяющий преобразовывать в текст «рукописные» символы, которые представлял себе пациент (65-летний парализованный мужчина). Этот метод позволяет набирать до 18 английских слов в минуту или около 90 символов. Алгоритм для этого прибора действует по принципу распознавания паттернов.
Моторные BCI действуют по принципу поиска альтернативных нейронных путей, обходя повреждённые или разорванные участки. Они фиксируют моторные команды мозга и передают их на внешние устройства. В частности, при помощи такого интерфейса больной может управлять инвалидной коляской. Дальнейшее развитие этих технологий должно привести нас к полноценному нейропротезированию, при котором человек сможет управлять бионическими протезами с той же лёгкостью и точностью, как собственными конечностями. Примерная эволюция нейропротезов предполагает восстановление сначала подвижности, затем ловкости, а после этого и полноценных тактильных ощущений. Выдающаяся разработка такого рода называется LUKE Arm (в честь бионической руки, которой обладал Люк Скайуокер, герой «Звёздных войн»). Устройство разработал Дин Кеймен, инженер, сотрудничавший с Mobius Bionics и Segway. Здесь можно наводить курсор на плюсики и оценить, какие тонкие движения может выполнять такая рука и насколько многочисленны её степени свободы.
Возвращаясь к примеру Neuralink, отмечу ширящийся разрыв между умными протезами и настоящими интерфейсами «мозг-компьютер». Для наиболее современных устройств, в частности, Neuralink Маска, характерна миниатюризация электродов до плотности нескольких сотен на квадратный сантиметр, что позволяет стимулировать конкретные нейроны с практически безошибочной точностью. Улучшается и разрешение при считывании нейронных импульсов.
Кроме того, как упоминалось выше, BCI превращаются в системы с замкнутым циклом, при помощи которых можно не только считывать данные, но и реагировать на них. Так, в 2023 году уже разработан замкнутый BCI, позволяющий на взлёте гасить эпилептические припадки. Он обнаруживает всплески ненормальной активности в мозге эпилептика и в ответ стимулирует нужные участки мозга электрическими импульсами заданной мощности.
Такие исследования приближают нас к полному пониманию нейронной сигнализации, обеспечивающей коммуникацию внутри мозга. Это система электрохимических сигналов, передающих информацию как в центральной, так и в периферической нервной системе. По нервным волокнам передаются электрические импульсы, называемые «потенциалами действия». Они образуют целые сигнальные цепи, управляющие нашими мыслями, эмоциями и действиями.
Разумеется, считывать нейронную сигнализацию удобнее при помощи инвазивных имплантатов, но коммерческий потенциал имеют их неинвазивные альтернативы (носимые устройства, которые можно рассматривать как часть Интернета Вещей). Среди подобных устройств упомяну умный обруч-наушники «Muse», работающий по принципу ЭЭГ:

Прибор позволяет детектировать и интерпретировать мозговые волны, запоминает их паттерны и позволяет пользователю «телепатически» управлять цифровыми интерфейсами, девайсами или умными протезами. Он подстраивается под биоритмы и помогает, например, регулировать ритм и улучшать качество сна.
Взаимодействие нервной ткани и вживляемых имплантатов
Здесь сделаем предварительный вывод: сила и качество сигнала нейроинтерфейса, равно как и его точность при записи информации напрямую зависят от расстояния между электродом и нейроном. По данным компьютерных симуляций и непосредственных измерений, расстояние между имплантатом и тканью должно оставаться в пределах 50-100 мкм; в таких масштабах электрод может надёжно снимать сигнал с нейрона. Между нейроном и электродом всегда наблюдается реакция на инородное тело, поэтому размер отдельного электрода может быть порядка микрон. При таком размере минимизируется травматичность и повышается плотность точек, в каждой из которой можно снимать информацию с нейрона. Насколько мне удалось выяснить, физиологический механизм реакции на инородное тело пока изучен слабо, и поэтому побочные (прежде всего, воспалительные) реакции пока неизбежны.
Реакция тканей
Существует серьёзное различие между жёсткостью вживляемого электрода и жёсткостью нейрона. Модуль упругости кремния приближается к 150 ГПа, а модуль упругости нейронов головного мозга обычно составляет около 100 кПа. Поэтому вживление электрода неизбежно вызывает механическую травму, рано или поздно приводящую к воспалению. Естественно, воспалённая ткань вытесняет металлический электрод, а также рубцуется. При этом в области вокруг электрода повышается внутричерепное давление. Известно, что в течение суток после имплантации через обволакивающую нейроны ткань микроглии к месту вторжения подтягиваются хемокины, цитокины, реактивные формы кислорода, нейромедиаторы и огромное количество фагоцитов. Фагоциты убирают мёртвые нейроны и сгустки крови, чтобы исключить образование тромбов, а также способствуют образованию рубца и удаляют остатки погибших нейронов. Весь процесс в целом аналогичен воспалению.
После первичного заживления вокруг электрода сохраняется повышенная активность микроглии и вступают в дело астроциты – ветвящиеся глиальные клетки, занимающие буферную зону между имплантатом и окружающей тканью коры. Дальнейшая хроническая реакция на инородное тело заключается в постоянном присутствии многоядерных гигантских клеток, литических ферментов и активных форм кислорода – по-видимому, организм стремится «растворить» имплантат и силами фагоцитов вынести его за пределы ЦНС. Образование глиального рубца подробно описано здесь, и, по-видимому, из-за роста астроцитов имплантат постепенно становится нефункционален (из-за превышения вышеуказанного промежутка в 100 мкм между ним и нейроном). Таким образом, при подборе материалов для имплантатов нового поколения необходимо максимально снизить реакцию на инородное тело.
Материалы для электродов
Примерно в 1970-е начинается активное развитие технологий микросборки, при помощи которых были предприняты первые попытки заключать металлические электроды в силиконовые каналы. Примерами таких разработок являются микроэлектродные массивы. До начала 2000-х были испробованы не только силиконовые, но и стеклянные, и керамические оболочки для электродов, но при передаче сигнала они опасно разогреваются. Поэтому сейчас им на смену приходят биосовместимые полимерные решения, а также гибридные электроды, в конструкции которых сочетается металл и полимер. В 2019 году группа Либера представила гибридные электроды нового поколения, при помощи которых удобно не только снимать сигнал, но и обеспечивать доставку лекарств через гематоэнцефалический барьер. Из неорганических материалов в этой области может найтись применение углеволокну, а из органических сейчас широко применяются поли-пара-ксилилен, полидиметилсилоксан (ПДМС), полиимиды и гидрогели. В данном случае также могут пригодиться электропроводящие полимеры, такие, как полиацетилен – но такие полимеры для устойчивой передачи сигнала всё равно требуется легировать металлом. Вероятно, всё это временные решения, приемлемые для медицинской неврологической практики, но препятствующие широкому распространению нейроимплантатов как потребительского товара. Можно предположить, что ситуация изменится, когда описываемые устройства из микроразмерных станут наноразмерными, и их можно будет встраивать непосредственно в нейроны.
Нейропыль
Этот текст был бы неполон без упоминания о нейропыли, первая модель которой была разработана в 2016 году под руководством Хосе Кармены и Мишеля Махарбиза из Калифорнийского университета в Беркли. Краткая статья об этом изобретении на Хабре уже публиковалась под авторством уважаемой @Alex_Writer, а в Википедии, как ни странно, такая технология до сих пор называется «гипотетической». (Ультразвуковая) нейронная пыль представляет собой рой датчиков, предназначенных для мониторинга нервной активности у подопытного животного. Кармена и Махарбиз фиксировали работу седалищного нерва у крысы под анестезией.
Система работает на ультразвуке, используя его как для беспроводной передачи данных, так и в качестве источника питания, поэтому обходится без проводов и батарей. «Пылинкой» (в терминологии авторов – «mote») служит электронный трансивер размером 0,8 x 1 x 3 мм, имплантируемый под кожу. Он отправляет ультразвуковые импульсы другому имплантату, представляющему собой пьезоэлектрический кристалл, кристалл генерирует слабое электричество. Кристалл также реагирует на электрические импульсы в нейронах (в зависимости от активности импульсов частота вибрации кристалла меняется) и передаёт эту информацию в трансивер методом обратного рассеяния. Вероятно, такое устройство могло бы применяться в качестве маячка для отслеживания передвижения животного, а также прикрепляться к любому органу, нерву, мышце и считывать данные об их состоянии. В случае выборочной стимуляции моторных нервов (исследованием таких возможностей занимаются, в частности, GlaxoSmithKline и компания Verily Life Sciences в составе Google) такие устройства могли бы породить новый класс лекарств («электрофармакологические» препараты), которые помогли бы при лечении именно периферической нервной системы.
Ещё предстоит выяснить, как долго эти устройства сохраняют работоспособность в организме, как в их случае выглядит описанная выше реакция на инородное тело, сколько всего таких «пылинок» можно безопасно внедрить в организм в пересчёте на массу тела, а также каковы возможные антиутопические варианты злоупотребления таким тонким инструментом слежки. Но в медицине (например, при раннем обнаружении раковых опухолей) и при дальнейшей миниатюризации такие устройства действительно могут оказаться незаменимы.
Этические вопросы использования описанных здесь технологий предпочту вынести в комментарии.

