
У нас их примерно 205, суммарно они весят около 5-6 кг и каждые 10 лет полностью обновляются на клеточном уровне. А еще есть идиоматическое выражение, утверждающее, что у всех есть это в шкафу. Речь, конечно, идет о скелете и о костях, его составляющих. Травмы, связанные с повреждением костей, одни из самых распространенных в мире. Порой такие травмы требуют не лечения кости, а ее замену. Трансплантация костей сопряжена с рядом опасностей для пациента, в числе которых последующие боли, инфекции, кровотечения, повреждения сопряженных тканей и т.д.
Некоторые ученые считают, что ключ к успешной костной трансплантологии лежит в применении напечатанных костей, которые будут идеально подходить конкретному пациенту и будут лишены дефектов. Как ученые печатали кости, что для этого было применено и какие результаты показала операция имплантации на крысе? Об этом мы узнаем из доклада исследовательской группы. Поехали.
Основа исследования
Методы лечения травм костей практически не изменились с самых древних времен. Ученые даже проанализировали 36 скелетов неандертальцев, на которых были признаки переломов. Из них лишь у 11 лечение этих травм можно назвать неудачным.
Однако такая успешность лечения во все времена не касается всех типов переломов. Некоторые травмы удалось успешно и без последствий лечить уже при наличии достаточно современного медицинского оборудования, знаний и методик.
На данный момент в трансплантологии костей часто применяют аллотрансплантаты или аллопластические материалы.
Аллотрансплантация* — пересадка органа от человека человеку (от особи одного вида особи того же вида).
Данные методы достаточно продвинуты, но не всемогущи. Черепно-челюстно-лицевые дефекты (врожденные, онкологического или травматического происхождения) достаточно сложны. В таких случаях необходимы имплантаты, специфичны конкретному пациенту. Следовательно, их нельзя взять у донора, а необходимо изготовить. В таких случаях применяется краниопластика, однако имплантат не будет обладать регенерацией и не будет расти вместе с другими костями пациента. Также используют губчатое вещество кости, деминерализованную костную матрицу, синтетические костные чипсы или костные замазки, которыми заполняется участок дефекта. Но эти материалы не пористые и обладают ограниченной связанной пористостью. Из-за этого снижается поверхностная клеточная миграция и васкуляризация (образование сосудов) клеток, что может привести к инкапсуляции*, а не к интеграции тканей. В результате чего сильно возрастает риск инфекции.
Инкапсуляция* — образование капсулы вокруг инородного тела в организме.
Исследователи предлагают использовать трехмерную печать, ибо этот метод позволяет сделать недорогой имплантат, который будет идеально подходить под определенный дефект у конкретного пациента.
Исследователи также отмечают, что в биомедицинской трехмерной печати пока недостает высокоэффективных материалов, которые будут совмещать в себе простоту изготовления, применения в печати и биологическую функциональность. А это значит что нужно создать свой материал, естественно.

Гиперэластичная кость
И имя сего нового материала — «гиперэластичная кость» (гиперэластичный костный материал). Изготавливается этот остеорегенеративный материал путем экструзии при комнатной температуре гидроксиапатита (твердое вещество, 90% от общей массы) и поли(молочно-гликолевой кислоты) (жидкое вещество, 10% от общей массы) в трехмерные формы без необходимости в спекании*, отверждении* или других формах физико-химической стабилизации.
Спекание* — процесс изготовления твердых и пористых материалов из мелкой порошкообразной основы при повышенных температурах и/или высоком давлении.
Отверждение* — необратимый процесс превращения жидких реакционноспособных олигомеров и (или) мономеров в твердые неплавкие и нерастворимые сетчатые полимеры.
Полученный трехмерный напечатанный каркас обладает хорошей эластичностью и высокой абсорбцией. Кроме того, каркас вызывает остеогенную дифференцировку* полученных из костного мозга мезенхимальных стволовых клеток человека без добавления остеоиндуцирующих катализаторов.
Дифференцировка клеток* — процесс формирования специализированного фенотипа клетки, отображающего ее функции. Утрировано, трудоустройство клетки, которая ранее не имела точной профессии.
При этом гиперэластичная кость не вызывала отрицательного иммунного ответа, становилась васкуляризованной и интегрировалась с окружающими тканями, поддерживая рост новой кости. Еще одним достижением является возможность переноса трансдуцированных человеческих жировых стволовых клеток посредством напечатанного имплантата.
Далее мы с вами подробнее ознакомимся с результатами практического испытания. Ученые провели сравнительный анализ остеорегенеративной способности гиперэластичной кости и коммерческого варианта (аутологичная кость) при дефектах черепа критических размеров у крыс. Но сначала немного о подготовке к эксперименту и о том, как именного изготавливался испытуемый материал и имплантат.
Изготовление гиперэластичной кости
Как мы уже знаем, каркас гиперэластичной кости был изготовлен из гидроксиапатита и поли (молочно-гликолевой кислоты).

Принтер BioPlotter
Все образцы были напечатаны с помощью принтера BioPlotter Manufacturing от компании EnvisionTEC. Толщина листов (5х5 см), состоящих из 5 слоев по 120 мкм, составила суммарно 0.6 мм. Далее из листов были выдавлены круглые (8 мм в диаметре) заготовки с помощью стилета для биопсии. Полученные заготовки были промыты и стерилизованы.

Изображение №1: процесс изготовление имплантатов.
Операция по имплантации
В качестве подопытных выступили лабораторные Спрег-Доули крысы — самцы весом примерно 500 грамм каждый.
Во время проведения операции подопытные были под общим наркозом (2% изофлуран / 100% кислород). Между ламбдовидным и венечным швами был сделан сагиттальный надрез (1,5 см) для обнажения черепа. С помощью ручной дрели с трепаном (игла с фрезой или сверлом для формирования отверстий в плотных тканях) был создан искусственный дефект черепа 8 мм в диаметре.
Подопытные были разделены на 4 группы:
- 7 особей — отрицательно-контрольная группа (без имплантата на дефекте);
- 6 особей — положительно-контрольная группа (с аутологичной костью в качестве имплантата);
- 6 особей — исследуемая группа №1 (с каркасом из поли (молочно-гликолевой кислоты) в качестве имплантата);
- 10 особей — исследуемая группа №2 (с гиперэластичной костью в качестве имплантата).

После имплантации (или без ее) надкостницу и кожу закрывали с использованием подвижного рассасывающегося шва, а подопытным вводили обезболивающее. Подопытные содержались в клетках по двое. Доступ к воде и пище был неограничен.
Образцы черепов анализировались посредством конусно-лучевой компьютерной томографии. Интересующие области были вырезаны из кости черепа, помещены в 70% этанол и отсканированы с помощью микро-компьютерного томографа. Далее с помощью программного обеспечения для анализа изображений медицинского характера (Mimics Medical 19.0) ученые более детально исследовали участки черепа, где были внедрены имплантаты.
После проведения микро-компьютерной томографии образцы были разрезаны пополам для гистологического анализа и визуализированы с помощью сканирующей электронной микроскопии. Также была проведена оценка степени регенерации спустя 8 и 12 недель.
А теперь приступим непосредственно к результатам наблюдений.
Результаты исследования
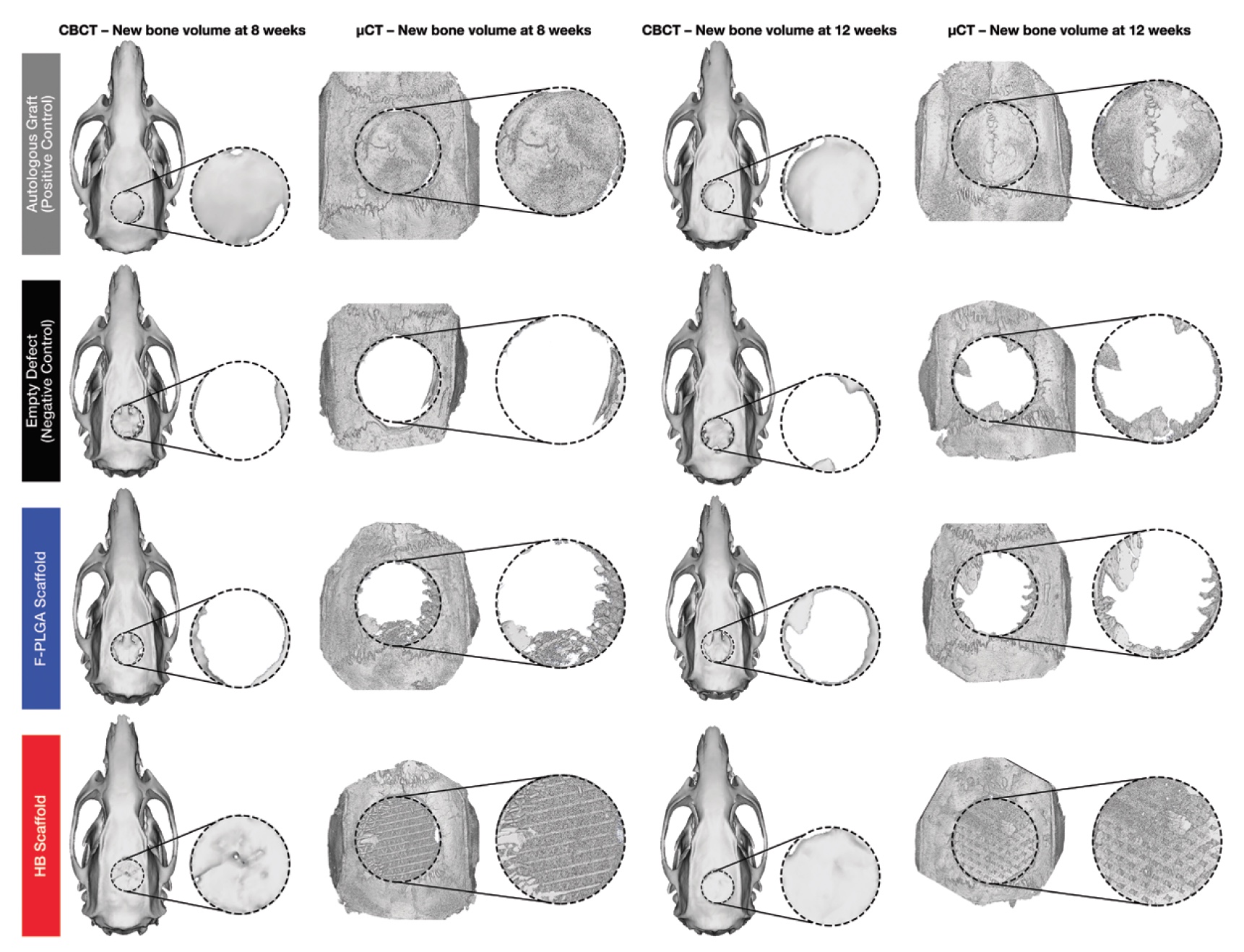
Изображение №3а: серый — с аутологичной костью; черный — без имплантата; синий — с имплантатом из поли (молочно-гликолевой кислоты); красный — с гиперэластичной костью.
На изображении выше (3а) представлены трехмерные реконструкции конусно-лучевой и микро-компьютерной томографий. Количество регенерированной костной ткани определяли по количеству минерализованной кости как доли от общего объема ткани, представляющего интерес. Объем кости на долю общего объема для гиперэластичной кости, поли (молочно-гликолевой кислоты) и для отрицательно-контрольной группы были нормализованы относительно объема кости на долю общего объема для положительно-контрольной группы (с аутологичной костью). Таким образом проводился сравнительный анализ показателей эффективности работы всех вариантов имплантата.
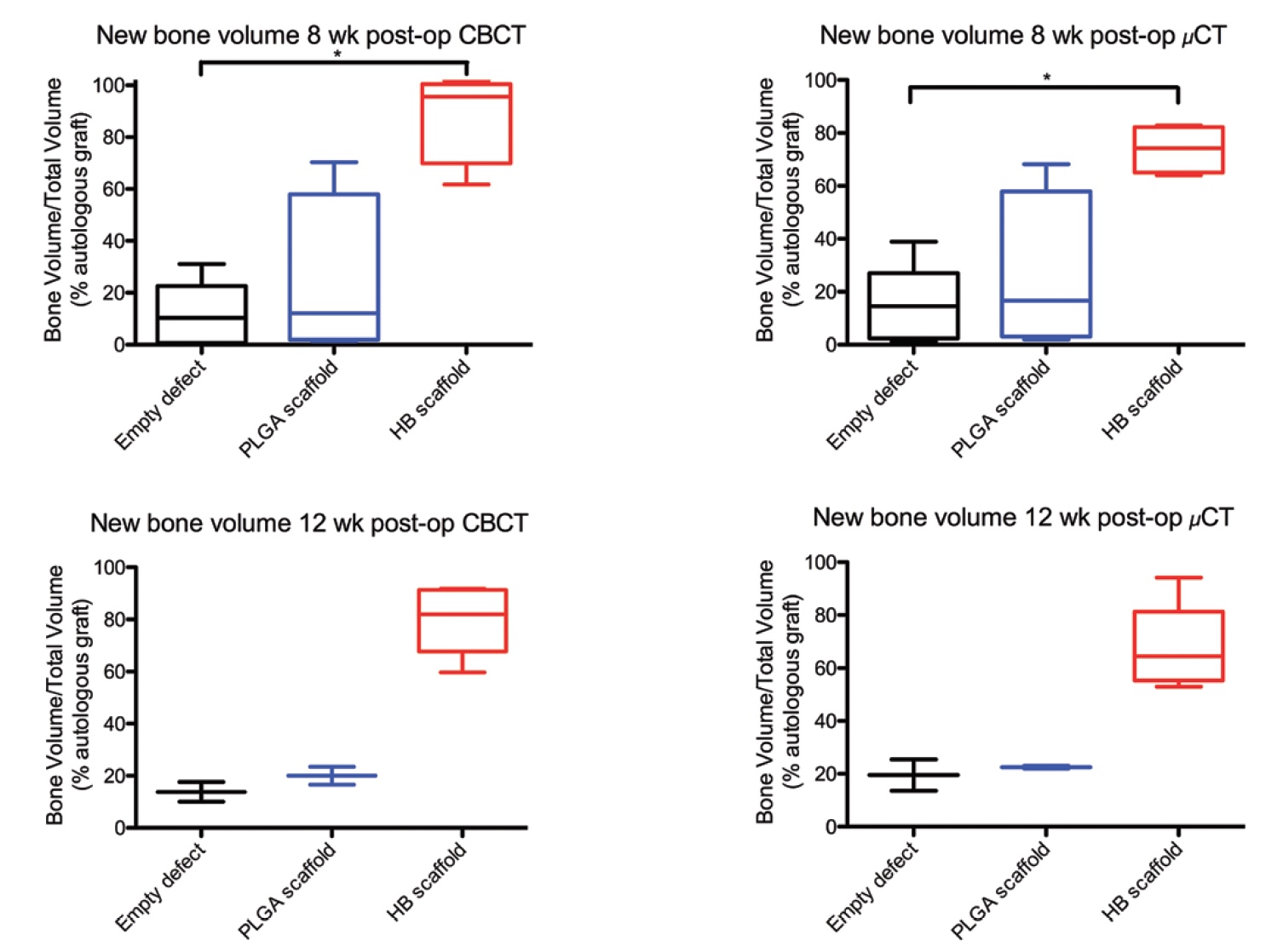
Изображение №3b
Конусно-лучевая и микро-компьютерная томографии показали увеличение количества минерализованного костного матрикса в дефектах, обработанных гиперэластичными костными имплантами (3b).
По данным конусно-лучевой томографии объем минерализованной кости в случае применения гиперэластичного костного имплантата составил 55,7% на 8 неделе и 57,0% на 12 неделе наблюдений. По данным микро-компьютерной томографии — 36,1% на 8 неделе и 37,1% на 12 неделе наблюдений. Это данные до нормализации.
После была проведена нормализация к показателям объема минерализованной кости в случае аутологичных трансплантатов. Теперь стало видно, что объем регенерации с применением гиперэластичной кости составил 95,6% и 82,0% (8-ая и 12-ая неделя наблюдений) от объема положительно-контрольной группы (с аутологичной костью). А микро-компьютерная томография дала следующие результаты: 74.2% и 64.5% (8-ая и 12-ая неделя наблюдений).
Применение исключительно поли (молочно-гликолевой кислоты) в качестве материала для имплантации оказалось достаточно неэффективным: 16.6% и 22.5% (8-ая и 12-ая неделя наблюдений) от объема положительно-контрольной группы. Малоэффективность этого метода подтверждается еще и тем, что его результаты не сильно отличаются от результатов отрицательно-контрольной группы, у которой вообще не было имплантатов: 10.3% и 13.8% на конусно-лучевой томографии и 14.5% и 19.5% на микро-компьютерной томографии.
Сравнение результатов испытываемого нового материала (гиперэластичной кости) с результатами отрицательно-контрольной группы показало разницу в объеме минерализованной кости в 7,81 раза на 8 неделе и в 5,75 раза на 12 неделе в пользу гиперэластичной кости.
Таким образом, с точки зрения объема регенерации применение гиперэластичной кости практически сопоставимо с применением коммерческих вариантов имплантатов с аутологичной костью.
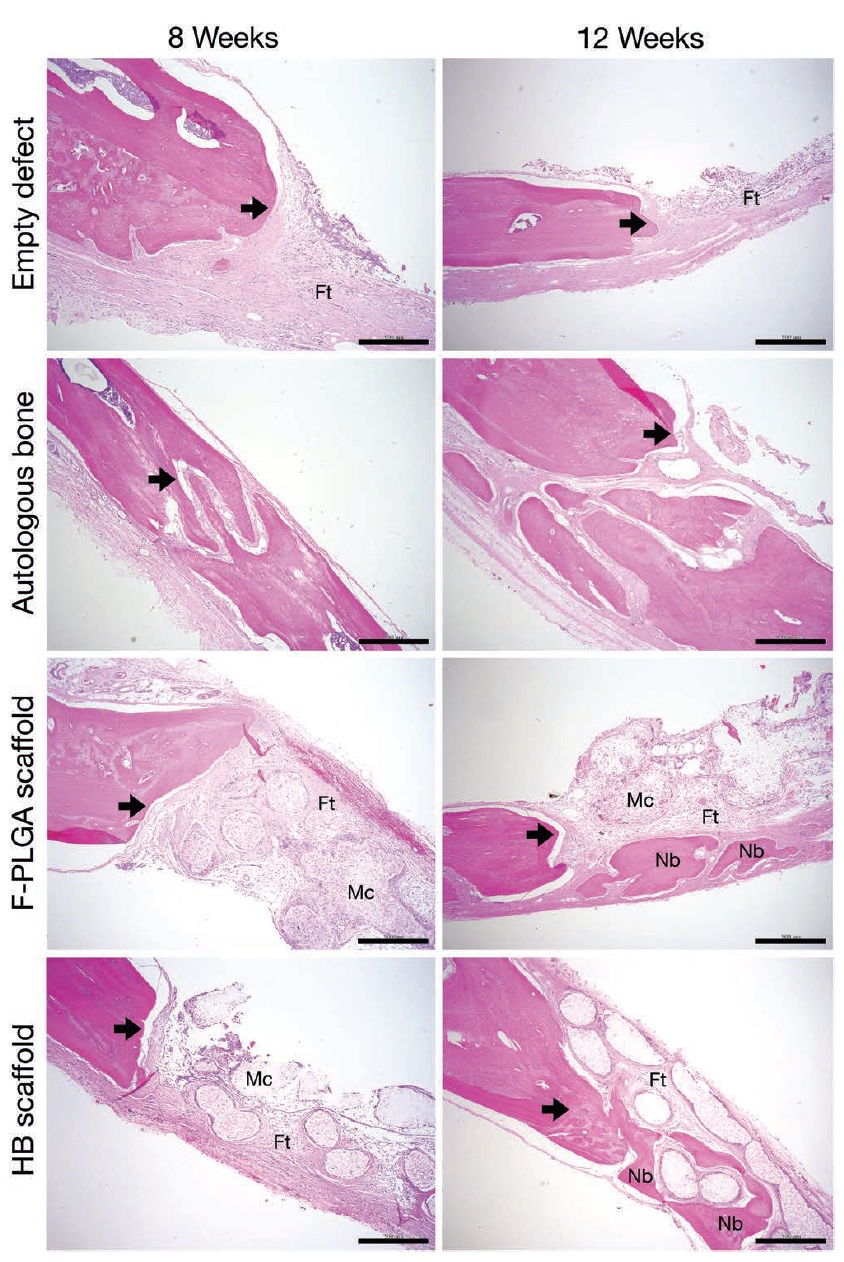
Изображение №4: стрелки — дефектный край; Ft — фиброзные (волокнистые) ткани; Mc — мембранно-клеточный компонент; Nb — новая кость.
Проведенный гистологический анализ лишь подтвердил данные конусно-лучевой и микро-компьютерной томографий. Учеными были определены края дефектов, а образования новой кость специально были окрашены с помощью эозина для лучшей визуализации.
В случае отрицательно-контрольной группы наблюдалась фиброзная ткань, но образование новой кости было минимальным (верхний ряд на изображении №4). Образцы с поли (молочно-гликолевой кислотой) также не могли похвастаться большим объемом новообразованной кости (третий ряд).
А вот образцы, где была применена гиперэластичная кость, напротив показали формирование минерализованной костной ткани на поверхности краев дефектов (4-ый ряд). На 8 неделе наблюдений в местах дефектов проявляется фиброзная ткань и мембранно-клеточные компоненты внутри имплантата, а на 12-ой неделе начинается образование новой кости вокруг элементов каркаса имплантата.

Изображение №5
И напоследок, анализ РЭМ (растровый электронный микроскоп) снимков образцов с гиперэластичной костью на 12 недели наблюдений показал образование тесного клеточного контакта тканей с материалом внутри имплантата.
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых.
Эпилог
В данном труде ученые продемонстрировали новый тип остеогенных биоматериалов, которые позволяют создавать имплантаты для лечения дефектов костей. Самыми важными особенностями своего детища ученые называют: простота имплантации, простота изготовления, высокая эффективность, низкая стоимость производства и кастомизация имплантата под определенного пациента.
Гиперэластичная кость действительно очень эластична и может принимать необходимую форму как в процессе изготовления, так и в момент имплантации, что сильно облегчает этот процесс. Керамические и полимер-керамические имплантаты не могут таким похвастаться.
Но даже не это самое важное достоинство. Высокая степень регенерации кости и приживаемости имплантата — это куда важнее. Уже через 4 недели после имплантации начинается активный процесс минерализации костных тканей.
Ученые также отмечают, что подобная скорость и эффективность крайне важны в случае достаточно больших дефектов (как это было продемонстрировано во время практических опытов).
Использование подобной технологии может очень сильно упростить жизнь как врачам, так и пациентам. Индивидуальность лечения, скорость производства, имплантации и быстрое выздоровление без побочных эффектов — это отличная реклама для новой технологии. В дальнейшем ученые намерены провести еще несколько экспериментов, детальнее изучить процесс регенерации и усовершенствовать свое изобретение.
Однако стоит отметить, что наличие подобных новшеств не означает, что можно ломать кости налево и направо. Так что правила безопасности никто не отменял.
Да, сегодня не пятница и не время для офф-топа, но я не удержался. 🙂
«Труп невесты» (2005 год, режиссер Тим Бёртон)
Благодарю за внимание, оставайтесь любопытствующими и хорошей всем рабочей недели, ребята. 🙂
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас оформив заказ или порекомендовав знакомым, 30% скидка для пользователей Хабра на уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5-2650 v4 (6 Cores) 10GB DDR4 240GB SSD 1Gbps от $20 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
VPS (KVM) E5-2650 v4 (6 Cores) 10GB DDR4 240GB SSD 1Gbps до лета бесплатно при оплате на срок от полугода, заказать можно тут.
Dell R730xd в 2 раза дешевле? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?
Источник


