
…… потому что бояться смерти есть не что иное, как думать, что знаешь то, чего не знаешь. Ведь никто же не знает ни того, что такое смерть, ни того, не есть ли она для человека величайшее из благ, а все боятся ее, как будто знают наверное, что она есть величайшее из зол. Но не самое ли это позорное невежество – думать, что знаешь то, чего не знаешь? ……
Платон “Апология Сократа”
- Как современная наука видит старение?
- Есть ли у нас шанс дожить до того момента, когда появится лекарство позволяющее отменить старость и продлить активную жизнь до 120 и более лет?
- Что мне делать прямо сейчас?
Попытка дать ответ на эти вопросы под катом, мы продолжаем путешествие по технологиям и понятиям Life extension.
Небольшое введение
Итак, это третья статья из цикла исследований про продление жизни. Напоминаю, что эти статьи пишутся в режиме исследования и предназначены для некоей классификации данных + личной мотивации продолжать исследования.
Как мне видится такой формат работает — я начал проходить курс “Introduction to Biology — The Secret of Life” в Massachusetts Institute of Technology для повышения уровня образованности в данной сфере, изучаю много литературы и продолжаю погружение в тему. И это становится все интереснее и интереснее!
Также в комментах мы обсуждаем детали статей, что позволяет их улучшать и в в следующих статьях разбираться с возникающими вопросами, поэтому не стесняйтесь писать их.
Не стесняйтесь ставить оценки и говорить спасибо если вам кажется, что это полезно. Так вы повышаете шансы на продолжение.
И напомню, что цель не только продлить жизнь, но и “прожить ее так, чтобы потом не было мучительно больно за бесцельно прожитые годы”. То есть мы хотим сохранить наши мозг и тело активными и бодрыми до момента отключения сознания от носителя для того, чтобы не становиться обузой для близких и окружающих, а, даже наоборот, приносить всем пользу и радость. То есть цель это не вечная жизнь, а продление активной фазы нашей жизни.
Благодарности. Я хочу принести благодарность:
- За комментарии Z3RG1 Они мне очень помогли и открыли целую область для изучения. Спасибо!
- За перевод лекций Роберта Сапольски — это огромная работа, которая открывает доступ к большому пласту знаний — спасибо!
Список лит-ры: внизу под спойлером, так как он получился очень большой.
Сама статья — не только компиляция основанная на прочитанной литературе, но и исследование ставящее вопросы, которые я планирую изучать дальше.
Механизмы старения — современный взгляд на процесс
Эволюция, в результате который образовались мы, люди, длилась около 4 миллиардов лет. Все это время организмы усложнялись и, в определенный момент всего этого сверхсложного процесса появились мы.
Мы, как люди, на данный момент все обладаем невероятно сложным организмом и мозгом и пытаемся понять — почему же мы стареем и умираем. Внутри этой фразы скрыты два вопроса:
- Почему я должен стареть — читай становиться малосильным, хуже двигающимся, хуже соображающим. Как я могу до самой смерти уменьшить эти признаки старения?
- Почему я должен умереть примерно в 90 лет? Как я могу продлить свою жизнь, например, до 120 лет?
Современная наука плотно изучает эти вопросы, но, в силу того, что мы — очень сложная система в которой все бесконечно взаимосвязано, единого и простого ответа пока нет и, непонятно возможен ли он в принципе.
Однако, мы глубоко залезли в основы работы нашего тела и клеток и, сегодня одной из основных причин старения и смерти исследователи называют нарушение работы митохондрии. Заметьте, не главная или единственная причина, а просто одна из основных.
Что такое митохондрия?
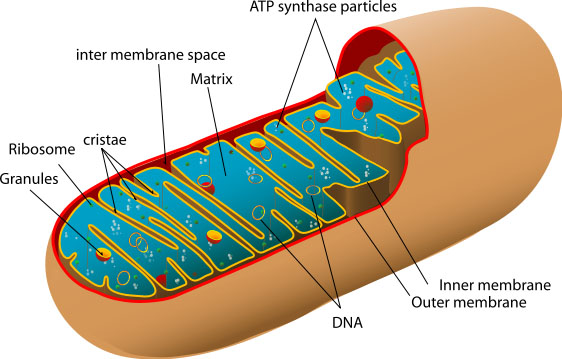
Митохондрия это двумембранная органнелла (постоянное образование внутри клетки) которая есть почти во всех наших клетках. Одна из основных функций митохондрии — синтез АТФ (аденозинтрифосфата).
Про АТФ можно запомнить одно — это основной компонент для проведения энергозатратных реакций в клетке, в день наше тело синтезирует около 40 кг. этого вещества.
Молекула АТФ выходит из митохондрии в клетку где участвует в реакциях и расщепляется на элементы. Эти элементы (продукты распада) идут обратно в митохондрию, где вновь соединяются в АТФ.
Химически процесс организован так — на вход поступает глюкоза и кислород, на выход идет углекислота, вода и АТФ. Два процесса нашего тела — питание (и выход), дыхание (и выдох) как раз поставляют и выводят вещества этого химического процесса.
Из Википедии:
В организме АТФ является одним из самых часто обновляемых веществ; так, у человека продолжительность жизни одной молекулы АТФ менее 1 мин. В течение суток одна молекула АТФ проходит в среднем 2000—3000 циклов ресинтеза (человеческий организм синтезирует около 40 кг АТФ в день, но содержит в каждый конкретный момент примерно 250 г), то есть запаса АТФ в организме практически не создаётся, и для нормальной жизнедеятельности необходимо постоянно синтезировать новые молекулы АТФ.

А еще интересно и важно для понимания механизмов старения то, что у митохондрии есть своя ДНК. Она так и называется Митохондриальная ДНК (мтДНК или mtDNA). Как это стало возможно?
Если почитать учебник биологии 11 класса 2015 года, то там описано это так:
Некоторые первичные гетеротрофы вступали в симбиотические отношения с аэробными бактериями. Захватив их, гетеротрофы начинали использовать их в качестве энергетических станций. Так возникли современные митохондрии. Эти симбионты дали начало животным и грибам.
Есть и другие теории, но нам сейчас это не особо важно. Важно лишь то, что эта мтДНК тоже кодирует белки и РНК.
Интересно: примерно 200 000 лет назад жила, так называемая Митохондриальная Ева от которой все мы унаследовали Митохондриальную ДНК (мтДНК или mtDNA).
Итак, как итог этого введения мы получаем, что в практически в каждой клетке нашего тела есть митохондрии, которые являются отдельными органеллами со своими ДНК и поставляют нам АТФ — основное “топливо” для проведения реакций в клетках. Образно митохондрии иногда называют “электростанциями клетки”.
Перейдем теперь к современным теориям о том как связано старение и нарушения работы митохондрий.
Теория №1 Свободнорадикальная теория старения (mitochondrial free radical theory of aging (MFRTA))
Данная теория уже устарела и считается, что она не объясняет причин старения. Поэтому, только борьбой со свободными радикалами, проблему старения не решить.
Согласно данной теории, одной из главных причин появления признаков старости являются активные формы кислорода (АФК) (англ. radical oxygen species (ROS)), которые являются побочным продуктом реакции окисления. Получившиеся АФК вступают в реакцию с молекулами клеток, повреждая их. А это приводит к апоптозу клетки.
В принципе все это нормально и наш организм постоянно проводит обновление (например ранки на коже, видимая часть). Однако часть тканей у нас почти не обновляется (хрящи, сухожилия, кристаллин в хрусталике) и там апоптоз постепенно приводит к проявлению всем знакомым признакам старения.
Также вторая часть проблемы повышенного уровня АФК, в том, что повышается вероятность повреждения ДНК и перерождения клетки в раковую. А если это происходит, то все становится плохо.
Эта теория была довольно сильна некоторое время, однако, постепенно накопились противоречия, которые данная теория не объясняла и теперь она “не торт”.
Противоречия:
-
С точки зрения этой теории увеличение уровня антиоксидантов в клетках должно уменьшать (замедлять) появление признаков старости и увеличивать продолжительность жизни. Однако, в ряде экспериментов (список лит-ры номера 19 — 28) было показано, что это не только не увеличивает продолжительность жизни, но иногда и уменьшает.
-
Также, согласно этой теории должна различаться продолжительность жизни разных животных. Чем больше производится АФК в митохондриях, тем короче продолжительность жизни. Однако, это не подтверждается. Например обычные мыши живут около 3-4 лет, а голые землекопы 25-30 лет. При этом уровень АФК у них практически одинаковый.
- У голых землекопов не наблюдается возрастных изменений (признаков старости), но при этом уровень окислительного стресса у них гораздо выше чем у стареющих мышей (список лит-ры 29)
Исходя из этого, на текущем этапе делаются выводы, что АФК это не побочные, нежелательные продукты работы митохондрий, а важные сигнальные молекулы способствующие продолжительности жизни. (список лит-ры 30-31)
Теория №2 Нарушение деятельности (дисфункция) митохондрий с возрастом.
С увеличением возраста уменьшается количество митохондрий в клетках (список лит-ры 34, 35) и, одновременно, уменьшается количество копий мтДНК в митохондриях. Также примерно на 40% уменьшается производительность транспортной системы митохондрий (список лит-ры 36-38)
То есть, признаки старости которые мы видим и ощущаем, связаны с уменьшением количества митохондрий (становится меньше производящих энергию органелл) + с уменьшением производительности оставшихся.
Данная теория поясняет почему мы наблюдаем у себя признаки и ощущения старения. Однако, хотя данные нарушения связаны с возрастными изменениями, первопричина их появления неизвестна. То есть, эти нарушения (уменьшения количества митохондрий, ДНК и проводимости) могут быть не причиной старения, а одним из его механизмов, который начинает работать из-за чего либо еще.
Исследователи отмечают, что биогенез митохондрий контролируется на многих уровнях одновременно. Например, гормоны щитовидки, эстрогены, глюкокортикостероиды влияют не только на рост и деление клеток, но и на работу митохондрий. (список лит-ры 39-43)
Первопричину (или комплекс причин) из-за которой это происходит еще предстоит найти, однако уже сегодня можно начать пытаться остановить процесс уменьшения количества митохондрий в клетках или, даже обернуть его вспять.
Гарантированно подойдут такие всем доступные методы как специальные физические тренировки иили ограничение питания. (список лит-ры 44, 45)
Также мы будем исследовать другие варианты, наблюдать за процессом вы можете в канале телеграм.
Теория №3 Соматические (не передающиеся по наследству) мутации мтДНК.
Как мы выяснили в начале статьи, у митохондрии своя ДНК — мтДНК.
Также, в теории №2 выяснено, что базовые признаки старения появляются из-за нарушения работы митохондрий. Текущая рабочая теория видит одну из причин возникновения этих нарушений в мутациях мтДНК.
В статье 2017 года (из списка литры 55), которую я пока технически не могу купить (не выйти на процесс покупки) в описании красиво и кратко описана эта теория.
Процесс дублирования и починки мтДНК производится полимеразой (Pol γ) которая кодируется “большой” ДНК из основной клетки, внутри которой находится митохондрия. Также в процессе участвуют несколько других протеинов.
Современная теория утверждает, что ошибки этого механизма вызывают мутации мтДНК, которые в свою очередь ведут к дисфункции митохондрии. (список лит-ры 1, 56, 57)
Более того, уже есть первые подтверждения того, что именно ошибки этого механизма ведут к дисфункциям митохондрий, а не повреждения вызванные процессом жизни. (список лит-ры 58)
Как только у ученых появится полное понимание процесса и доказательная база, то сразу станет возможной направленная терапия + разработка направленных лекарств.
Итог
Итак, рассмотрев эти три теории мы можем видеть как постепенно развиваются воззрения о механизмах и причинах старения. Причем, это только одна часть направлений исследований, хотя и одна из основных в настоящее время.
Также мы можем видеть, что по мере подтверждения разных теорий наука может разрабатывать, а мы применять разные способы воздействия на свое тело, которые позволят замедлятьоблегчать старение и уменьшать риск возникновения сопутствующих болезней.
Например, в теории №2 не найдена причина нарушения работы митохондрий, но найдены физические выражения этих нарушений. И воздействуя на них мы можем уменьшать признаки старения и риски связанных болезней.
И тут мы подходим к вопросам №2 и №3 которые были в начале статьи.
Есть ли у нас шанс дожить до того момента, когда появится лекарство позволяющее отменить старость и продлить активную жизнь до 120 и более лет?
Ни в коем случае не хочу что-либо предсказывать и выступать в роли какого-либо аналитика. Просто когда начинаешь изучать старение и лекарства от него, то вопрос “Когда появится чудо таблетка?” возникает самым первым.
Без предсказаний, просто расскажу “вести с полей”.
Весть №1 Скулачев Владимир Петрович, член РАН,
в своей книге “Жизнь без старости” пишет, что уже разработан и прошел испытания на мышах митохондриальный антиоксидант skQ1 — который доставляется прямо в митохондрии.
На его основе выпущены глазные капли, таблеток для продления молодости пока нет, хотя если читать книгу, то там все прямо волшебно.
Сомнения возникают при изучении того, что происходит в реальности:
-
Глазные капли на рынке уже несколько лет (запущены в продажу с 2012 года), но нет исследований на тему того как они работают. Есть частные отзывы и они не очень позитивные.
- На официальном сайте нет новостей и технических данных. Он очень напоминает неудавшийся проект который постепенно умирает и движется по инерции.
В то же время, быть может команда просто не заморочена на новости и полностью погружена в научную работу. Есть свежие публикации по теме за рубежом.
- https://scienceblog.com/492213/scientists-slow-aging-artificial-antioxidant-skq1/
- http://medkoo.com/products/4508
Поэтому тут надо просто подождать, но если все сложится позитивно, то в течение нескольких лет можно ожидать митохондриальный антиоксидант российского производства.
Весть №2 MitoQ Antioxidant
Тем временем, мировая наука тоже не спит и уже выпустила митохондриальный антиоксидант.
ВАЖНО! Прошу, не кидайтесь покупать его и пить, изучите вопрос глубоко или подождите пару-тройку недель, статья на эту тему в пути, будет опубликована на Гиктаймс, а пока свежие новости (кирпичики большой статьи + технические детали) будут в канале телеграм.
Сайт производителя >>> По этой ссылке, если вам не терпится срочно купить, будет скидка 10%, сделал партнерку. Однако повторюсь, подождите. Особенно если вам меньше 40 лет и вы ничем не болеете — не спешите.
MitoQ Antioxidant на Амазоне >>>
Этот препарат, предварительно, вызывает некое доверие:
-
производится в Новой Зеландии, стране хоббитов и победившего эльфизма.
-
первое упоминание про действующее вещество на пабмеде датируется аж 2003 годом https://www.ncbi.nlm.nih.gov/pubmed/12882327, то есть вещество уже успели достаточно изучить
- вещество доставляемое в митохондрии тоже очень хорошо изучено. Это коэнзим q10 и он часто рекомендуется как один из компонентов комплекса добавок для сохранения активного тела и мозга. Подробнее про Q10 читайте в первой статье.
Итог: Итак, как вы можете видеть, шансы на появление общего лекарства, которое может продлить бодрую жизнь и позволит до возраста 90+ быть активным, вполне реальные. Ведутся исследования, причем есть конкуренция между разными действующими веществами, что внушает особенный оптимизм.
Что мне делать прямо сейчас?
Мы подошли к последней части статьи, где теория соприкасается с реальностью и обычно даются обтекаемые формулировки, типа пейте такие то добавки (статья написана производителем или я вставляю партнерские ссылки) и получите защиту от того и сего.
Я не могу сказать точно, что все лекарства не работают и нет волшебной таблетки, однако мой здравый смысл, наблюдения за реальностью и изучение тематики говорит именно это — волшебной таблетки (комплекса таблеток), которые разом все решат — нет. На данный момент существования мы все смертны как случайно (в любой момент), так и на 100% закономерно — от старости.
Однако, проверенные способы продления жизни, энергичности и умственной бодрости доступны прямо сейчас. Про это было две предыдущие статьи — раз и два. Просто выполняя пункты из них вы можете сильно замедлить процесс старения, избежать многих неприятностей и дожить неповрежденным до появления лекарств нового поколения.
В планах на будущее ниже — мы начинаем разработку программы, которая будет анализировать индивидуальные параметры и выдавать рекомендации для долголетия и активности мозга.
Плюс, мы будем публиковать исследования, наблюдения и выводы в виде итоговых статей тут, на Гиктаймс.
Планы на будущее
-
Обещанная статья-исследование про MitoQ
- В ходе исследований придуман интересный психологическо-медитативный лайфхак, который по идее может сильно замедлить старение и даже развернуть его вспять. Есть положительные результаты подобных исследований + этот лайфхак уникален тем, что это будет специальная медитация на 5 минут, три раза в день. Мы будем делать ее один год и замерять раз в три месяца основные показатели возраста нашего организма. И если исследования покажут физическое омоложение, то можно будет рекомендовать методику публично.
Сейчас мы в стадии сбора команды и подготовки документации, однако скоро все будет открыто и полностью доступно в телеграме и на github — проект планируется полностью открытый.
Те кто готов ставить эксперименты на мышах себе — велкам.
- Создание программы для индивидуального подбора того, что надо принимать и делать чтобы продлевать активную фазу жизни. На вход подаются данные человека, на выходе получаем некоторую персонифицированную терапию. Это будущее, но не очень далекое, подготовка уже начата, писаться все будет на Пайтоне, доступно на Гитхабе.
Плюсом такой программы будет то, что при ее развитии туда будут вноситься все новые методики и, если они вам подходят, то вы сразу о них узнаете.
Все свежие новости и исследования будут на канале телеграм
Напоследок цитата из Сократа и всем удачи и до встречи!
А рассудим‑ка еще вот как – велика ли надежда, что смерть есть благо? Умереть, говоря по правде, значит одно из двух: или перестать быть чем бы то ни было, так что умерший не испытывает никакого ощущения от чего бы то ни было, или же это есть для души какой‑то переход, переселение ее отсюда в другое место, если верить тому, что об этом говорят. И если бы это было отсутствием всякого ощущения, все равно что сон, когда спят так, что даже ничего не видят во сне, то смерть была бы удивительным приобретением. Мне думается, в самом деле, что если бы кто‑нибудь должен был взять ту ночь, в которую он спал так, что даже не видел сна, сравнить эту ночь с остальными ночами и днями своей жизни и, подумавши, сказать, сколько дней и ночей прожил он в своей жизни лучше и приятнее, чем ту ночь, то, я думаю, не только всякий простой человек, но и сам Великий царь нашел бы, что сосчитать такие дни и ночи сравнительно с остальными ничего не стоит. Так если смерть такова, я со своей стороны назову ее приобретением, потому что таким‑то образом выходит, что вся жизнь ничем не лучше одной ночи.
Платон Апология Сократа
Поиск по научным ресурсам
https://cse.google.com/cse/publicurl?cx=007884152123107264641:gq-n7tb1kj4
- https://www.jci.org/articles/view/64125 — The role of mitochondria in aging
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5476857/ — Mitochondria and ageing: role in heart, skeletal muscle and adipose tissue
- https://www.jci.org/articles/view/61398/version/1/pdf/render — A mitochondrial bioenergetic etiology of disease
- https://www.jci.org/articles/view/68833/version/1/pdf/render — Coming of age: molecular drivers of aging
- and therapeutic opportunities
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5471566/ — Impact of Aging and Exercise on Mitochondrial Quality Control in Skeletal Muscle
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5506767/ — Mitochondria in oocyte aging: current understanding
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5388543/ — Fasting, circadian rhythms, and time restricted feeding in healthy lifespan
- http://www.cell.com/cell-reports/fulltext/S2211-1247(17)30595-8 — Fatty Acid Oxidation in Zebrafish Adipose Tissue Is Promoted by 1α,25(OH)2D3
- https://www.ncbi.nlm.nih.gov/pubmed/28584055 — Prolonged fasting suppresses mitochondrial NLRP3 inflammasome assembly and activation via SIRT3-mediated activation of superoxide dismutase 2.
- https://www.ncbi.nlm.nih.gov/pubmed/28647176 — Mitochondrial oxidative phosphorylation efficiency is upregulated during fasting in two major oxidative tissues of ducklings.
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5278216/ — Impact of Yoga and Meditation on Cellular Aging in Apparently Healthy Individuals: A Prospective, Open-Label Single-Arm Exploratory Study
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5514379/ — Mitochondria in Cell Senescence: Is Mitophagy the Weakest Link?
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5640889/ — A Trickster in Disguise: Hyaluronan’s Ambivalent Roles in the Matrix
- https://www.ncbi.nlm.nih.gov/pubmed/28889075 — Epigenetic clock analysis in long-term meditators.
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5559171/ — Machine learning for predicting lifespan-extending chemical compounds
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5635266/ — Getting Old through the Blood: Circulating Molecules in Aging and Senescence of Cardiovascular Regenerative Cells
- https://www.jci.org/articles/view/93172 — Syntaphilin controls a mitochondrial rheostat for proliferation-motility decisions in cancer
- http://www.ncbi.nlm.nih.gov/pubmed/8108730 — Orr WC, Sohal RS. Extension of life-span by overexpression of superoxide dismutase and catalase in Drosophila melanogaster. Science.1994;263(5150):1128–1130.
- http://www.ncbi.nlm.nih.gov/pubmed/12521602 — Mockett RJ, Bayne A-CV, Kwong LK, Orr WC, Sohal RS. Ectopic expression of catalase in Drosophila mitochondria increases stress resistance but not longevity. Free Radic Biol Med. 2003;34(2):207–217.
- http://www.ncbi.nlm.nih.gov/pubmed/12743125 — Orr WC, Mockett RJ, Benes JJ, Sohal RS. Effects of overexpression of copper-zinc and manganese superoxide dismutases, catalase, and thioredoxin reductase genes on longevity in Drosophila melanogaster. J Biol Chem. 2003;278(29):26418–26422.
- http://www.ncbi.nlm.nih.gov/pubmed/19776219 — Zhang Y, et al. Mice deficient in both Mn superoxide dismutase and glutathione peroxidase-1 have increased oxidative damage and a greater incidence of pathology but no reduction in longevity. J Gerontol A Biol Sci Med Sci. 2009;64A(12):1212–1220.
- http://www.ncbi.nlm.nih.gov/pubmed/19197346 — Van Raamsdonk JM, Hekimi S. Deletion of the mitochondrial superoxide dismutase sod-2 extends lifespan in Caenorhabditis elegans. PLoS Genet.2009;5(2):e1000361.
- http://www.ncbi.nlm.nih.gov/pubmed/19056880 — Doonan R, et al. Against the oxidative damage theory of aging: superoxide dismutases protect against oxidative stress but have little or no effect on life span in Caenorhabditis elegans. Genes Dev. 2008;22(23):3236–3241.
- http://www.ncbi.nlm.nih.gov/pubmed/11278828 — Kayser EB, Morgan PG, Hoppel CL, Sedensky MM. Mitochondrial expression and function of GAS-1 in Caenorhabditis elegans. J Biol Chem.2001;276(23):20551–20558.
- http://www.ncbi.nlm.nih.gov/pubmed/14704205 — Duttaroy A, Paul A, Kundu M, Belton A. A Sod2 null mutation confers severely reduced adult life span in Drosophila. Genetics. 2003;165(4):2295–2299.
- http://www.ncbi.nlm.nih.gov/pubmed/7493016 — Li Y, et al. Dilated cardiomyopathy and neonatal lethality in mutant mice lacking manganese superoxide dismutase. Nat Genet. 1995;11(4):376–381.
- http://www.ncbi.nlm.nih.gov/pubmed/8790408 — Lebovitz RM, et al. Neurodegeneration, myocardial injury, and perinatal death in mitochondrial superoxide dismutase-deficient mice. Proc Natl Acad Sci U S A. 1996;93(18):9782–9787.
- https://www.ncbi.nlm.nih.gov/pubmed/17054663 — High oxidative damage levels in the longest-living rodent, the naked mole-rat.
- http://www.ncbi.nlm.nih.gov/pubmed/22482728 — Zarse K, et al. Impaired insulin/IGF1 signaling extends life span by promoting mitochondrial L-proline catabolism to induce a transient ROS signal. Cell Metab. 2012;15(4):451–465.
- http://www.ncbi.nlm.nih.gov/pubmed/21824781 — Hekimi S, Lapointe J, Wen Y. Taking a “good” look at free radicals in the aging process. Trends Cell Biol. 2011;21(10):569–576.
- http://www.ncbi.nlm.nih.gov/pubmed/17914900 — Rea SL, Ventura N, Johnson TE. Relationship between mitochondrial electron transport chain dysfunction, development, and life extension in Caenorhabditis elegans. PloS Biol. 2007;5(10):e259.
- https://biomolecula.ru/articles/nutrigerontologiia-pitanie-vs-starenie — Нутригеронтология: питание vs. старение
- http://www.ncbi.nlm.nih.gov/pubmed/2610701 — Yen T-C, Chen Y-S, King K-L, Yeh S-H, Wei Y-H. Liver mitochondrial respiratory functions decline with age. Biochem Biophys Res Commun.1989;165(3):994–1003.
- http://www.ncbi.nlm.nih.gov/pubmed/5723478 — Tauchi H, Sato T. Age changes in size and number of mitochondria of human hepatic cells. J Gerontol. 1968;23(4):454–461.
- http://www.ncbi.nlm.nih.gov/pubmed/838779 — Stocco DM, Cascarano J, Wilson MA. Quantitation of mitochondrial DNA, RNA, and protein in starved and starved-refed rat liver. J Cell Physiol.1977;90(2):295–306.
- http://www.ncbi.nlm.nih.gov/pubmed/15800038 — Short KR, et al. Decline in skeletal muscle mitochondrial function with aging in humans. Proc Natl Acad Sci U S A. 2005;102(15):5618–5623.
- http://www.ncbi.nlm.nih.gov/pubmed/10576606 — Ojaimi J, Masters CL, Opeskin K, McKelvie P, Byrne E. Mitochondrial respiratory chain activity in the human brain as a function of age. Mech Ageing Dev. 1999;111(1):39–47.
- http://www.ncbi.nlm.nih.gov/pubmed/22259067 — Knuever J, et al. Thyrotropin-releasing hormone controls mitochondrial biology in human epidermis. J Clin Endocrinol Metab. 2012;97(3):978–986.
- http://www.ncbi.nlm.nih.gov/pubmed/12552316 — Weitzel J, Iwen K, Seitz H. Regulation of mitochondrial biogenesis by thyroid hormone. Exp Physiol. 2003;88(1):121–128.
- http://www.ncbi.nlm.nih.gov/pubmed/12525861 — Scheller K, Sekeris CE. The effects of steroid hormones on the transcription of genes encoding enzymes of oxidative phosphorylation. Exp Physiol.2003;88(1):129–140.
- http://www.ncbi.nlm.nih.gov/pubmed/19559056 — Chen J-Q, Cammarata PR, Baines CP, Yager JD. Regulation of mitochondrial respiratory chain biogenesis by estrogens/estrogen receptors and physiological, pathological and pharmacological implications. Biochim Biophys Acta. 2009;1793(10):1540–1570.
- http://www.ncbi.nlm.nih.gov/pubmed/18481068 — Fernandez-Vizarra E, Enriquez JA, Pérez-Martos A, Montoya J, Fernandez-Silva P. Mitochondrial gene expression is regulated at multiple levels and differentially in the heart and liver by thyroid hormones. Curr Genet. 2008;54(1):13–22.
- http://www.ncbi.nlm.nih.gov/pubmed/22978553 — Radák Z, Zhao Z, Koltai E, Ohno H, Atalay M. Oxygen consumption and usage during physical exercise: the balance between oxidative stress and ROS-dependent adaptive signaling [published online ahead of print: November 16, 2012]. Antioxid Redox Signal. doi: 10.1089/ars.2011 .4498 .
- http://www.ncbi.nlm.nih.gov/pubmed/16224023 — Nisoli E. Calorie restriction promotes mitochondrial biogenesis by inducing the expression of eNOS. Science. 2005;310(5746):314–317.
- http://www.vechnayamolodost.ru/articles/teorii-stareniya/mitohsvobt51/ — МИТОХОНДРИАЛЬНАЯ СВОБОДНОРАДИКАЛЬНАЯ ТЕОРИЯ СТАРЕНИЯ – НА КАКОМ ЭТАПЕ МЫ НАХОДИМСЯ?
- https://www.mitoq.com/?___store=default&ref=VDhWSWMxaWJpSm89
- https://www.amazon.com/gp/product/B00H4HT0EE/ref=as_li_tl?ie=UTF8&tag=awaik-20&camp=1789&creative=9325&linkCode=as2&creativeASIN=B00H4HT0EE&linkId=5505080d5cf58414674dbbc2f7d0926d
- https://www.amazon.com/gp/product/B00JIAZVN4/ref=as_li_tl?ie=UTF8&tag=awaik-20&camp=1789&creative=9325&linkCode=as2&creativeASIN=B00JIAZVN4&linkId=332853baa6d1dd07a454c01d35e7e74a
- http://www.ncbi.nlm.nih.gov/pubmed/15164064 — Trifunovic A, et al. Premature ageing in mice expressing defective mitochondrial DNA polymerase. Nature. 2004;429(6990):417–423.
- http://www.ncbi.nlm.nih.gov/pubmed/16020738 — Kujoth GC. Mitochondrial DNA mutations, oxidative stress, and apoptosis in mammalian aging. Science. 2005;309(5733):481–484.
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5614328/ — Aging, Metabolism, and Cancer Development: from Peto’s Paradox to the Warburg Effect
- http://www.aginganddisease.org/article/2017/2152-5250/147653 — Recent Progress in Vascular Aging: Mechanisms and Its Role in Age-related Diseases
- http://www.atpsynthase.info/MitoMolBiol/2014/Lecture8-2014-MitoDiseases.pdf — Мутации в мтДНК. Митохондриальные заболевания.
- https://www.ncbi.nlm.nih.gov/pubmed/27143693 — Role of the mitochondrial DNA replication machinery in mitochondrial DNA mutagenesis, aging and age-related diseases.
- http://www.ncbi.nlm.nih.gov/pubmed/18311139 — Vermulst M, et al. DNA deletions and clonal mutations drive premature aging in mitochondrial mutator mice. Nat Genet. 2008;40(4):392–394.
- http://www.ncbi.nlm.nih.gov/pubmed/19656491 — Edgar D, et al. Random point mutations with major effects on protein-coding genes are the driving force behind premature aging in mtDNA mutator mice. Cell Metab. 2009;10(2):131–138.
- http://www.ncbi.nlm.nih.gov/pubmed/19656491 — Ameur A, et al. Ultra-deep sequencing of mouse mitochondrial DNA: mutational patterns and their origins. PLoS Genet. 2011;7(3):e1002028.
Источник


