Организм человека — это сложный, точно настроенный механизм, состоящий из множества таких же сложных систем, отвечающих за множество взаимозависимых процессов. Однако, как подтвердит любой инженер, каким бы сложной ни было устройство, дефекты и поломки неизбежны. Современная медицина в поисках новых методов лечения различных заболеваний все чаще обращается за помощью к современным технологиям, начиная от робототехники и заканчивая искусственными органами. К примеру, ученые из Калифорнийского университета в Сан-Франциско (США) разработали искусственную почку, которая способна выполнять функции природного оригинала, тем самым потенциально нивелируя необходимость в диализе. Из чего сделана кибер-почка, как она работает, и насколько она эффективна? Ответы на эти вопросы мы найдем в докладе ученых.
Основа исследования
Неумолимая и лишенная эмоций статистика говорит, что более 2 миллионов человек на планете каждый год лечатся от терминальной стадии болезни почек (ESRD от endstage renal disease). К сожалению, на этой стадии заболевание не поддается консервативному лечению, а потому единственными вариантами остается либо пересадка органа, либо пожизненный гемодиализ.
Естественно, пересадка является более приоритетным вариантом, особенно учитывая ее отличные результаты — 5-летняя выживаемость реципиентов живых донорских органов составляет >80%. Однако эта процедура связана с пожизненной иммуносупрессией (ослабление иммунитета), которая влечет за собой осложнения здоровья пациента. Также стоит упомянуть и постоянный страх любого трансплантолога и пациента после трансплантации — отторжение.
Более того, спрос на донорские органы намного превышает предложение. К примеру, в США ежегодно проводится чуть более 20000 трансплантаций почек, при этом менее 20% пациентов в очереди на операцию дожидаются ее.
Те, кому не повезло получить донорскую почку, вынуждены проходить гемодиализ. Данная процедура болезненна, занимает много часов, а смертность в течение 5 лет составляет порядка 60%. При этом гемодиализ лишь частично заменяет функцию почек, и у большинства диализных пациентов по-прежнему наблюдаются симптомы и последствия ESRD, включая эндокринную и когнитивную дисфункцию.
Учитывая вышеописанные недостатки диализа, научное сообщество уже давно пытается найти альтернативу. Современные подходы используют клеточные технологии для создания полностью функционального замещающего органа, носимые устройства для диализа искусственной почки или биогибридные устройства, в которых используются как клетки, так и искусственные материалы для повторения функций канальцев и клубочек соответственно.
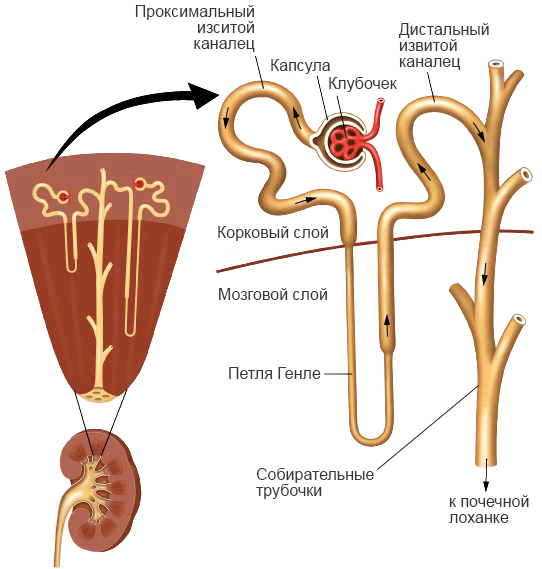
Строение нефрона — структурно-функциональной единицы почки.
Ранее сообщалось об успешном использовании экстракорпорального вспомогательного устройства почечных канальцев (RAD от renal tubule assist device), содержащего человеческие почечные эпителиальные клетки (HREC от human renal epithelial cell). В ходе II фазы клинических исследований добавление RAD к заместительной почечной терапии улучшило выживаемость пациентов, снизив риск смерти на 50%.
Авторы рассматриваемого нами сегодня труда применили биогибридный подход RAD для разработки полностью имплантируемой биоискусственной почки (iBAK от implantable bioartificial kidney). Чтобы имитировать физиологию нефронов человека, ученые создали iBAK, состоящий из кремниевого гемофильтра, воспроизводящего избирательную проницаемость клубочков, в сочетании с иммунозащитным биореактором, содержащим клетки почечных канальцев для реабсорбции растворенных веществ и воды и воссоздания метаболической и эндокринологической функции почечных канальцев.
В предлагаемом iBAK человеческие почечные эпителиальные клетки инкапсулированы внутри биореактора для непрерывной обработки ультрафильтрата из гемофильтра и выборочного возврата ионов натрия и воды обратно в систему кровообращения для обеспечения объемного гомеостаза. Токсины и избыток растворенных веществ концентрируются в оставшейся воде и направляются в мочевой пузырь для выведения.
Используя методы полупроводникового микропроизводства, кремниевые пластины точно спроектированы для воспроизводимого создания тонких (< 1 мкм) биомиметических мембран, которые включают монодисперсные наноразмерные щелевые поры. Эти кремниевые нанопоровые мембраны (SNM от silicon nanoporemembrane) прекрасно подходят для использования в качестве барьера отчуждения благодаря своей высокой молекулярной селективности. Более того, их высокие характеристики массообмена в сочетании со стратегиями модификации поверхности для повышения биосовместимости позволяют осуществлять «безнасосную» фильтрацию крови исключительно с использованием врожденного сердечного перфузионного давления.
В своем труде ученые сосредоточили внимание на биореакторном компоненте iBAK и описали первые шаги в разработке имплантируемого устройства для воспроизведения ключевых функций почечных канальцев, которое в конечном итоге будет функционировать в тандеме с имплантируемым гемофильтром.
Результаты исследования

Изображение №1
В функциональном биореакторе человеческие почечные эпителиальные клетки (HREC) должны быть размещены так, чтобы они получали кислород и питательные вещества, но были защищены от иммунных клеток реципиента. Чтобы подтвердить, может ли SNM обеспечивать потенциально иммунозащитный барьер in vitro, ученые подвергли одну сторону SNM воздействию супрафизиологической концентрации провоспалительного цитокина, фактора некроза опухоли-α (TNF-a). Два монослоя HREC были разделены с помощью SNM, прикрепленного к мембране, суспендированной в 6-луночном планшете для тканевых культур. Монослой клеток на апикальной стороне SNM («апикальный компартмент») выращивали до слияния; аналогичным образом клеточный монослой на базальной стороне SNM («базальный компартмент») выращивали до слияния. TNF-a в клеточной среде добавляли только в апикальный компартменте и инкубировали в течение 6 часов (1a).
Через шесть часов после добавления клеточной среды, содержащей TNF-a, в апикальный компартмент уровни TNF-a в апикальном компартменте оставались близкими к исходной концентрации (300 нг/мл), тогда как уровни TNF-a в базальном компартменте оставались незначительными. Несмотря на наличие клеточного монослоя на апикальной стороне, SNM с порами шириной 10 нм блокировали прохождение TNF-a на базальную сторону (1b). Аналогичным образом, в контрольной установке без клеток, высеянных на SNM, концентрации TNF-a как в апикальном, так и в базальном компартментах не изменились через 6 часов, демонстрируя, что SNM отвечает за ограничение диффузии TNF-a.
После воздействия TNF-a жизнеспособность обоих монослоев HREC определяли количественно с помощью анализа LIVE/DEAD. Все клетки апикального компартмента, непосредственно подвергшиеся воздействию TNF-a, демонстрировали клеточную гибель с менее чем 50% жизнеспособности клеток. Клетки базального компартмента сохраняли высокие показатели жизнеспособности (около 90%) (1c).
Экспрессию Zonula Occludens-1 (ZO-1), белка плотного соединения, расположенного на поверхности цитоплазмы, и ядер клеток визуализировали с помощью иммунофлуоресцентного окрашивания. После воздействия TNF-a экспрессия ZO-1 была ниже в HREC в апикальном компартменте по сравнению с исходной экспрессией ZO-1 апикальных клеток и экспрессией клеток базального компартмента. В отсутствие TNF-a HREC из базального компартмента демонстрировал последовательное и регулярное окрашивание ZO-1 в межклеточных соединениях. Уровни локализации и экспрессии ZO-1 в базальных клетках были сходными в моменты времени 0 и 6 часов (1d).
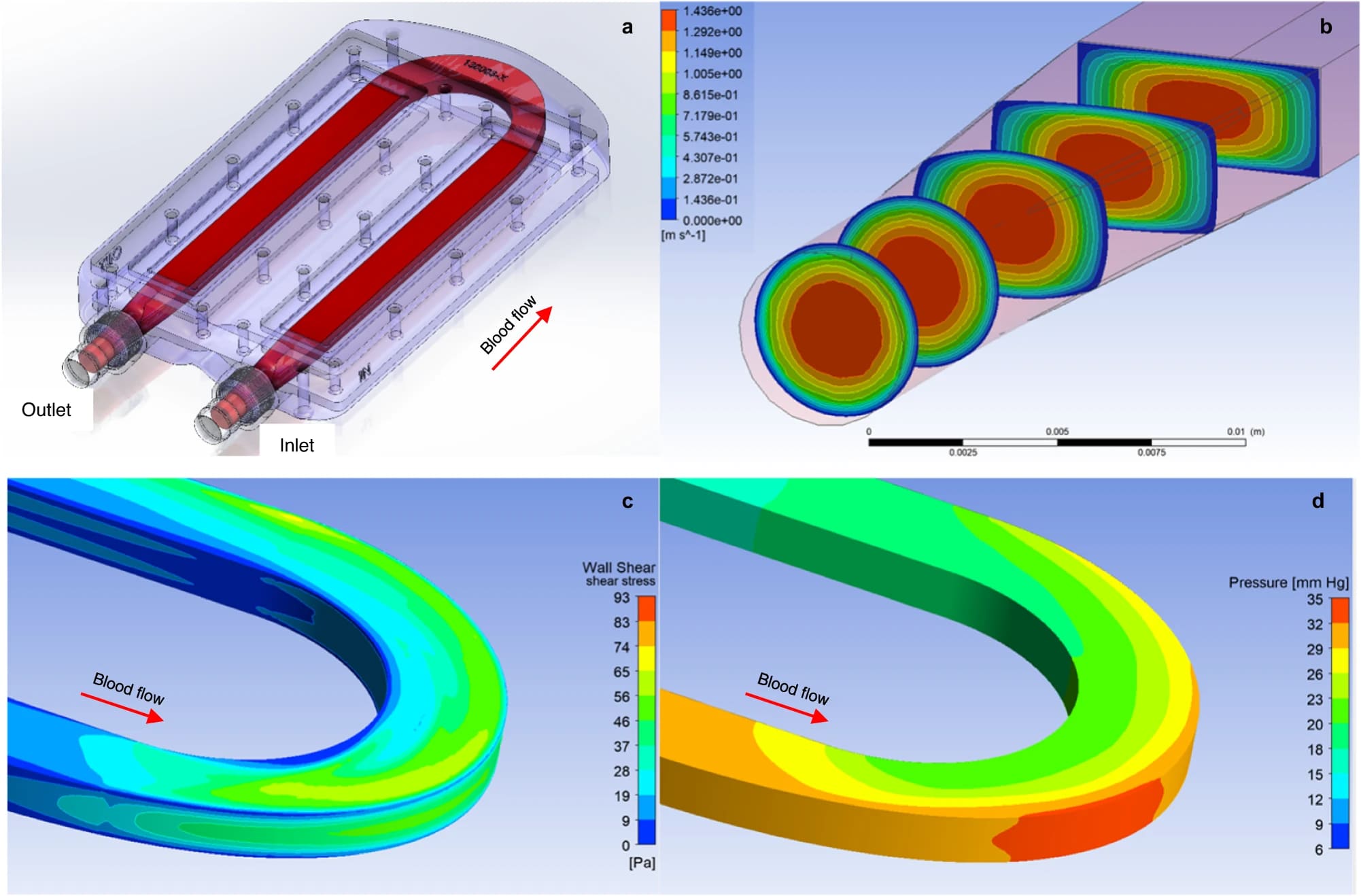
Изображение №2
Области с низким напряжением сдвига стенки (WSS от wall shear stress) были минимизированы за счет оптимизации геометрии кровеносных сосудов in silico (т. е. за счет компьютерного моделирования). Чтобы исключить тромбообразование, вызванное потоком внутри биореактора, ученые использовали вычислительную гидродинамику (CFD от computational fluid dynamics) для оптимизации пульсирующих полей кровотока с двумя основными критериями проектирования.
Во-первых, форма поперечного сечения пути крови должна была перейти от круглых каналов сосудистой сети и соединительных сосудистых трансплантатов к прямоугольному потоку протоков, определяемому расположением параллельных пластин SNM, а затем обратно к сосудистой сети (2a, 2b).
Во-вторых, чтобы облегчить хирургический анастомоз с артерией и веной одинакового размера, была разработана конфигурация, подобная воротам, с притоком и оттоком, антипараллельными и прилегающими друг к другу.
Эти условия были дополнительно ограничены необходимостью избегать застойного или рециркуляционного потока для предотвращения тромбоза. Путем итеративной модификации конструкции и анализа CFD ученые пришли к U-образному пути кровотока высотой 3 мм, который удовлетворял вышеперечисленным критериям (2a). Впускное и выпускное отверстия были разделены на 4 см. Поле кровотока было ламинарным и поддерживало WSS более 1 Па при скоростях потока 1000–1750 мл/мин и перепаде давления 20–35 мм рт. ст. (2c, 2d).
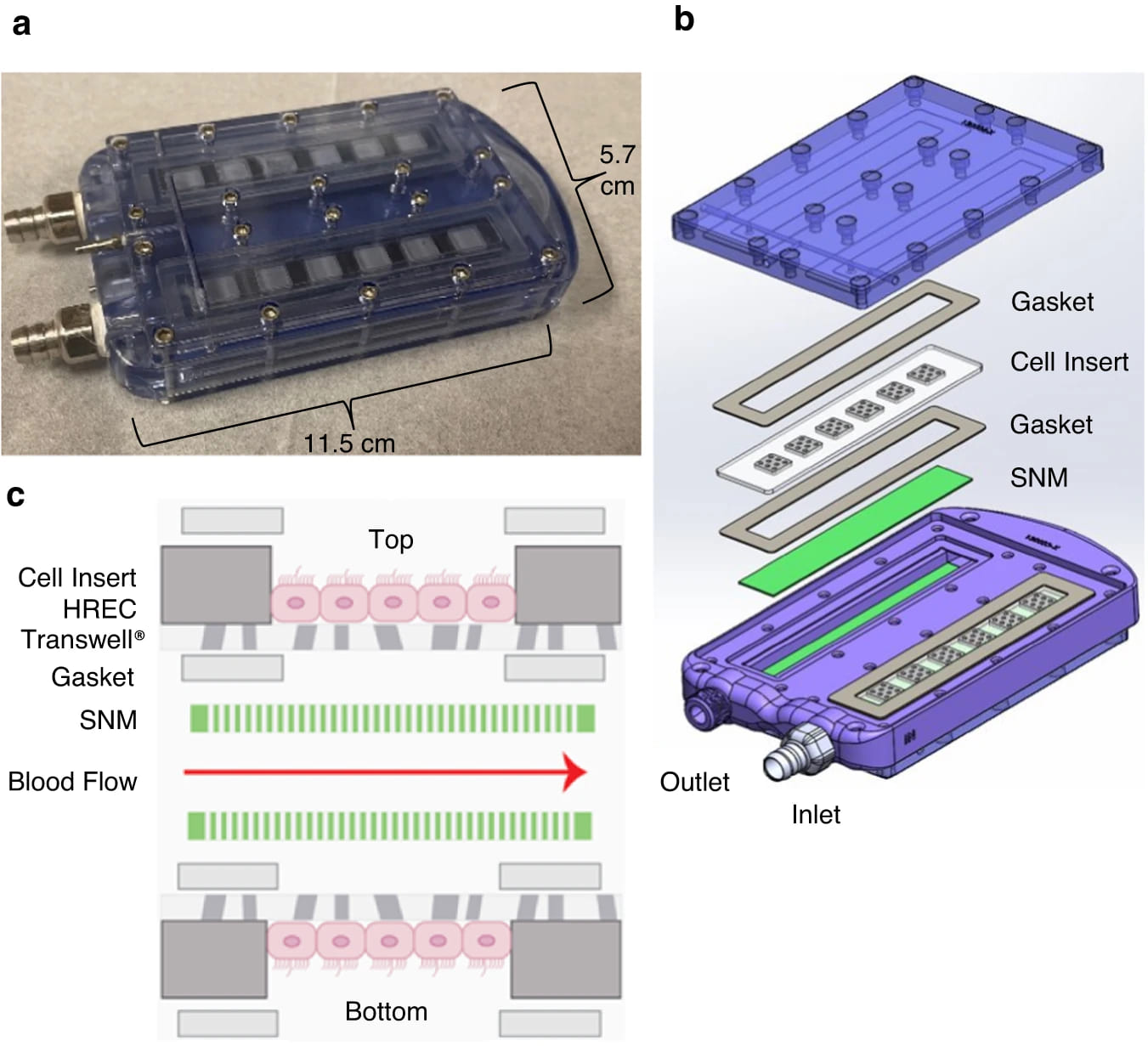
Изображение №3
HREC были инкапсулированы в имплантируемый биореактор, содержащий биосовместимый SNM. Прототипы биореакторов были собраны в стерильных условиях из поликарбонатных механически обработанных деталей с внутренним U-образным каналом кровотока, соединителями из нержавеющей стали, силиконовыми прокладками, акриловыми вставками ячеек и SNM (3a). SNM были покрыты пленками полиэтиленгликоля толщиной 1–2 нм, нанесенными методами самосборки, которые не закрывали поры. Каждый биореактор состоял из четырех SNM внутри поликарбонатного корпуса, расположенных на одной линии с верхней и нижней поверхностями кровеносного канала. На противоположной стороне SNM располагались вставки из акриловых ячеек со сливающимся HREC (3b, 3c). Базальная сторона HREC находилась в прямом контакте, что позволяло осуществлять обмен с ультрафильтратом, вырабатываемым SNM.
После герметизации клеточных вставок и SNM силиконовыми прокладками к поликарбонатному корпусу были прикреплены соединители из нержавеющей стали для перемещения крови между кольцевыми сосудистыми трансплантатами из политетрафторэтилена диаметром 6 мм и параллельными пластинами SNM высотой 3 мм. Поры шириной 10 нм в SNM сделали части стенок кровеносных каналов на основе SNM проницаемыми для питательных веществ и обмена отходов между путем кровотока и инкапсулированными клетками. После сборки устройство заполняли средой для культивирования клеток, закрывали входные и выходные отверстия крышками и устройство помещали в стерильный рукав до имплантации.
Изображение №4
Затем биореактор, содержащий SNM и HREC, был имплантирован свиньям. На протяжении всех 7 дней наблюдений устройство оставалось работоспособным, а тромбы обнаружены не были. Последнее является особенно важным аспектом, так как ни иммуносупрессия, ни терапевтическая системная антикоагуляция не применялись.
После операции не было никаких признаков осложнений, связанных с устройствами или операциями, включая кровотечение, инфекцию или повреждение кожи. Животные оставались здоровыми на протяжении всего эксперимента, признаков острого отторжения не отмечалось. Всего было успешно проведено пять имплантаций.
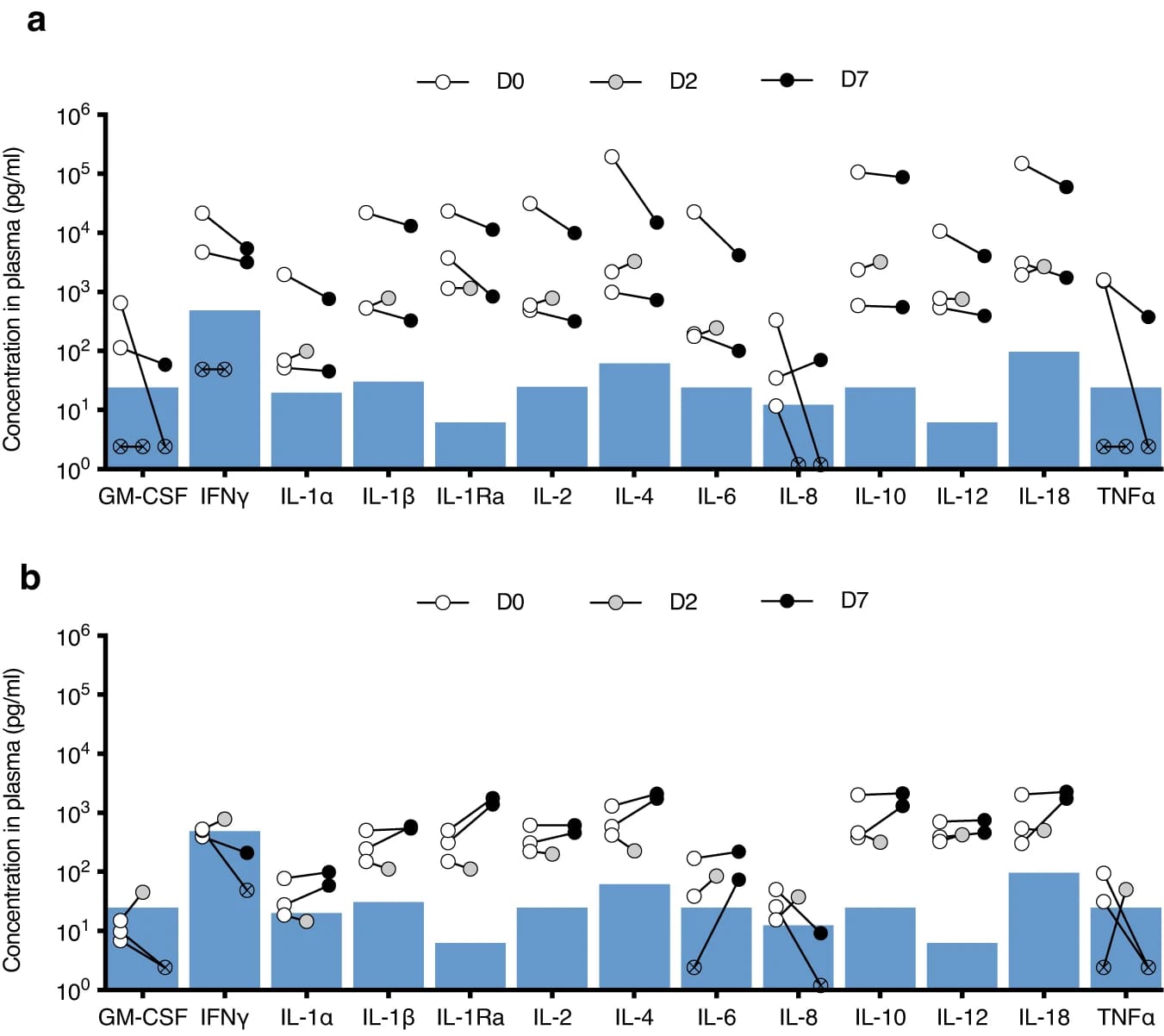
Уровни реципиентных цитокинов не были устойчиво повышены через 7 дней после имплантации. Проводилось отслеживание экспрессии цитокинов реципиента, чтобы оценить, провоцирует ли имплантация устройств с ксеногенными клетками человека или без них иммунную активацию.
Плазму животных собирали в день имплантации в конце процедуры (день 0) и на 2-й и 7-й дни после имплантации, и количественно определяли концентрации цитокинов в плазме. Концентрации цитокинов в 0-й день были повышены по сравнению с нормальными уровнями в плазме человека, вероятно, из-за острой реакции на хирургическую процедуру (4a). Концентрации всех цитокинов оставались прежними или слегка повышенными на 2-й день и снижались на 7-й день. Для сравнения, концентрации цитокинов у реципиентов устройств без клеток были относительно низкими и заметно не менялись на 2-й и 7-й дни (4b).

Изображение №5
Путь кровотока был проходим, а биореактор и SNM при эксплантации остались неповрежденными. Проходимость устройства и сосудистого трансплантата была подтверждена макроскопически (5a) и ангиограммой в день эксплантата. Через 3 или 7 дней in vivo биореактор извлекали из животного и разбирали для оценки.
Общий осмотр показал, что SNM не повреждена, с точечными пузырьками воздуха в обращенных наружу клеточных камерах. Не было обнаружено явных признаков образования тромбов внутри устройства или на SNM, что указывает на отсутствие застоя крови (5b). Сканирующая электронная микроскопия поверхностей SNM, контактирующих с кровью, показала минимальное присутствие остатков клеток крови и тромбоцитов (5c).

Изображение №6
Как через 3, так и через 7 дней инкапсулированные клетки сохраняли жизнеспособность > 90% по сравнению с контрольной группой in vitro (6a). Признаков отслоения клеток не наблюдалось, слияние сохранялось. Целостность монослоя HREC, подтвержденная экспрессией белка ZO-1, указывала на сохранение межклеточных плотных контактов. Клетки, инкапсулированные в биореакторе, демонстрировали экспрессию ZO-1, сравнимую с контрольными клетками in vitro (6b).
Инкапсулированные клетки имели нормальную или повышенную экспрессию функциональных маркеров, специфичных для клеток проксимальных канальцев. Экспрессию гена HREC, собранного из эксплантированного биореактора, измеряли с помощью кПЦР. HREC-специфичные маркеры были выбраны в качестве суррогатов функциональности и сравнены с контрольными клетками in vitro.
Экспрессия натрий-водородного обменника 3 (NHE3), транспортера на апикальной поверхности клетки, ответственного за баланс натрия и, опосредованно, pH крови, а также 25-гидроксивитамина D3 1-∝-гидроксилазы (1a-гидроксилазы), которая катализирует гидроксилирование витамина D и поддерживает гомеостаз кальция, были значительно повышены в инкапсулированных клетках. Экспрессия аквапорина 1 (AQP1), молекулярного белка водных каналов, присутствующего на апикальной и базальной поверхностях почечных клеток, была сопоставима с контрольными клетками in vitro через 3 дня (6c).
Уровни биомаркеров повреждения почек не повышались в инкапсулированном HREC, имплантированном свиньям. HREC, инкапсулированный в биореакторе, демонстрировал низкие уровни активности N-ацетил-β-d-глюкозаминидазы (NAG), чувствительного маркера повреждения клеток почек. Активность NAG в инкапсулированных клетках была сопоставима с контрольными клетками in vitro и составляла менее 10% от стандартного положительного контроля. Уровни активности гаммаглутамилтранспептидазы, биомаркера ишемического повреждения, а также отторжения трансплантата, также были сопоставимы с контролем in vitro (6d).
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых.
Эпилог
В рассмотренном нами сегодня труде ученые продемонстрировали свою разработку — искусственную почку, способную выполнять те же функции, что и ее природный прародитель.
Искусственная почка, представляющая собой биореактор с клетками почки внутри, работает в фоновом режиме и не вызывает ответной реакции иммунной системы реципиента. Биореактор напрямую подключается к кровеносным сосудам пациента, обеспечивая прямой перенос питательных веществ и кислорода. При этом кремниевые мембраны устройства защищают клетки почек внутри реактора от потенциальных атак со стороны иммунных клеток.
В ходе практических испытаний устройство было имплантировано свиньям и показало отличную работу без каких-либо сбоев или образования тромбов в течение всех 7 дней наблюдений. Важно отметить, что отсутствие тромбов обеспечивалось исключительно работой устройства, т. е. без применения каких-либо иммунодепрессантов.
Данное устройство еще нуждается в доработке, но уже сейчас можно сказать, что оно станет революционным в области лечения терминальной стадии болезни почек. Пациенты с таким заболеванием нуждаются либо в пересадке донорской почки, которой они банально могут не дождаться, либо в мучительном и весьма вредном диализе. Искусственная почка, описанная в данном труде, нивелирует необходимость в обоих этих подходах, тем самым избавляя пациентов от множества рисков для здоровья, которые связаны с пересадкой или диализом.
Немного рекламы
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99, уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5-2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Maincubes Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?

