
При превышении определённой температуры клетка приходит в негодность и умирает. Одно из простейших объяснений такой непереносимости жары состоит в том, что необходимые для жизни белки – те, что извлекают энергию из еды или солнечного света, обороняются от вторжений, уничтожают отходы и т.п. – часто обладают удивительно точной формой. Начинаясь как длинные нити, они затем скручиваются в виде спиралей, «заколок для волос» и других форм, диктуемых последовательностью их составных частей. И эти формы играют огромную роль в их деятельности. Но когда температура начинает расти, связи, удерживающие белковые структуры, нарушаются: сначала самые слабые, а затем и сильные. Логично, что распространяющаяся потеря белковой структуры должна быть летальной, но до последнего времени детали того, как именно это убивает перегретые клетки, были неясны.
Теперь же биофизики из Швейцарской высшей технической школы Цюриха изучили поведение каждого белка в клетках четырёх различных организмов при повышении температуры. Это исследование и богатый набор собранных данных, опубликованный в журнале Science, показали, что при температуре, достаточной для смерти клетки – человеческой, или же клетки кишечной палочки Escherichia coli – разрушаются лишь несколько ключевых белков. Более того, обилие белков в клетках оказалось неожиданным образом связанным с их стабильностью. Исследования позволили учёным бегло ознакомиться с фундаментальными правилами, по которым выстроена работа белков и их упорядочивание, и последствия которых, как стало понятно, простираются гораздо дальше простой смерти от жары.
Паола Пикотти, биофизик, руководивший работой, объяснила, что эксперименты отталкивались от старых и нерешённых вопросов: почему некоторые клетки выживают при высоких температурах, а другие – умирают? Бактерия Thermus thermophilus счастливо живёт в горячих источниках и в домашних нагревателях [при оптимальной температуре в 65 °C – прим. перев.], тогда как клетки E. coli чахнут при температурах выше 40 °C. Убедительные доказательства говорят о том, что дело тут в разной стабильности белков этих организмов. Но следить за белком, находящимся в живой клетке, что было бы идеальным методом изучения, очень неудобно. Изолирование белка в пробирке не даёт всех ответов, поскольку внутри организма белки сбиваются вместе и влияют на химию друг друга, или же поддерживают друг друга в необходимой форме. Чтобы понять, что именно и почему разваливается, необходимо наблюдать за белками в то время, когда они всё ещё влияют друг на друга.
Как тепло уничтожает белки
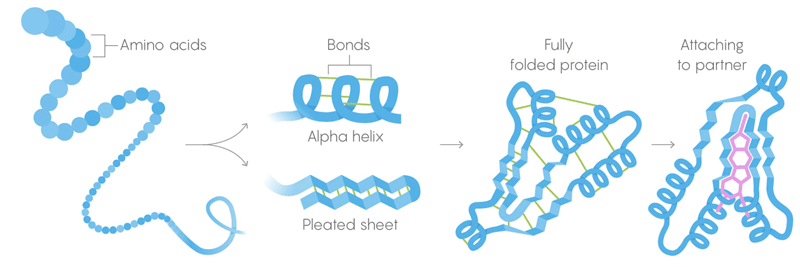
1) Первичная структура белков – это длинные цепочки аминокислот, объединённые в заданные генами последовательности.
2) Вторичная структура – это аминокислота, которая также свёртывается в конфигурации, удерживаемые слабыми межмолекулярными связями.
3) Третичная структура – слабые связи, стабилизирующие расположение прямых и скрученных участков трёхмерной структуры белка. Их расположение позволяет белку соединяться с нужными молекулами.
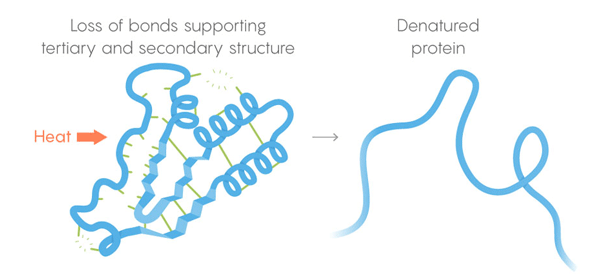
Тепловая смерть. Слабые связи теряют способность удерживать третичную и вторичную структуры, и белок денатурирует, то есть разворачивается. Но не все белки разворачиваются при одной температуре – окружение белка в клетке может придавать ему дополнительную стабилизацию.
Чтобы решить поставленную задачу, команда разработала автоматизированную процедуру наблюдения. Они разрезали клетки и нагревали их содержимое поэтапно, выпуская на каждом этапе ферменты, разделявшие белки. Эти ферменты особенно хорошо разрезают развернувшиеся белки, поэтому исследователи на основе остатков разрезанных белков могли судить о том, какие белки развалились при заданной температуре. Таким образом им удалось построить денатурационные кривые для каждого из тысяч изученных белков. Дуги кривых идут от нетронутой структуры белка при комфортабельной для него температуре до полностью развёрнутого состояния при высокой температуре. Для поиска различий между кривыми разных видов живых существ, были проведены эксперименты над клетками людей, E. coli, T. thermophilus и дрожжей. «Исследование было прекрасным», – сказал Алан Драммонд [Allan Drummond], билог из Чикагского университета, имея в виду как масштаб, так и точность процесса.
Во время наблюдений было ясно видно, что белки всех живых существ не разворачиваются все сразу при повышении температуры. «Мы увидели, что лишь небольшое подмножество белков разрушилось на самых ранних стадиях, – сказала Пикотти, – и это были ключевые белки». На диаграмме с переплетениями межбелковых связей самые хрупкие белки из этого небольшого подмножества часто обладали большим количеством связей, что означает, что они влияют на множество процессов, происходящих в клетках. «Без этих белков клетки не могут работать, – сказала Пикотти. – Когда они пропадают, вся сеть разрушается». И вместе с ней, очевидно, останавливается и жизнь клетки.
Этот парадокс – самые важные белки оказываются самыми хрупкими – может быть отражением того, как эволюция создала их для выполнения соответствующих задач. Если у белка есть множество ролей, его нестабильность и склонность к разворачиванию и повторному сворачиванию может стать преимуществом, поскольку она может позволить ему принимать разные формы, подходящие к разным задачам. «Многие из этих ключевых белков обладают большой гибкостью, что и делает их менее стабильными», но при этом наделяет их способностью связываться с различными целевыми молекулами в клетке, пояснила Пикотти. «Скорее всего, именно так они справляются со своими функциями. Это некий компромисс».
Тщательнее изучив E. coli, для которой собранные данные получились наиболее качественными, исследователи обнаружили и связь между обилием белка – количеством его копий в клетке – и его стабильностью. Чем больше копий белка делает клетка, тем больше температура требуется для его уничтожения. При этом оказывается, что большое количество копий не коррелирует с критичностью белка для выживания. Некоторые ключевые белки встречаются очень редко. Эта связь между обилием и надёжностью подтверждает идею, выдвинутую Драммонд ещё лет десять назад – у клеточной системы, изготавливающей белки, есть тенденция к тому, чтобы периодически допускать ошибки. Ошибка обычно дестабилизирует белок. Если этот белок оказывается распространённым, и такой белок в клетке появляется сотню или тысячу раз в день, тогда неправильно свернувшиеся копии, произведённые в больших количествах, могут засорить клетку. Таким образом организму выгодно было бы эволюционировать так, чтобы наиболее распространённые белки были бы и наиболее стабильными, что подтверждают полученные командой Пикотти данные.
Чтобы понять, какие качества белка делают его стабильным, исследователи сравнили данные E. coli и T. Thermophilus. Белки E. coli начали разваливаться при 40 °C, и практически полностью деградировали при 70 °C. Но при этой температуре белки T. thermophilus только начинали испытывать дискомфорт – некоторые из них держали форму и при 90 °C. Команда обнаружила, что у T. thermophilus белки обычно были короче, и некоторые типы форм и компонентов белка чаще встречались в самых стабильных из них.
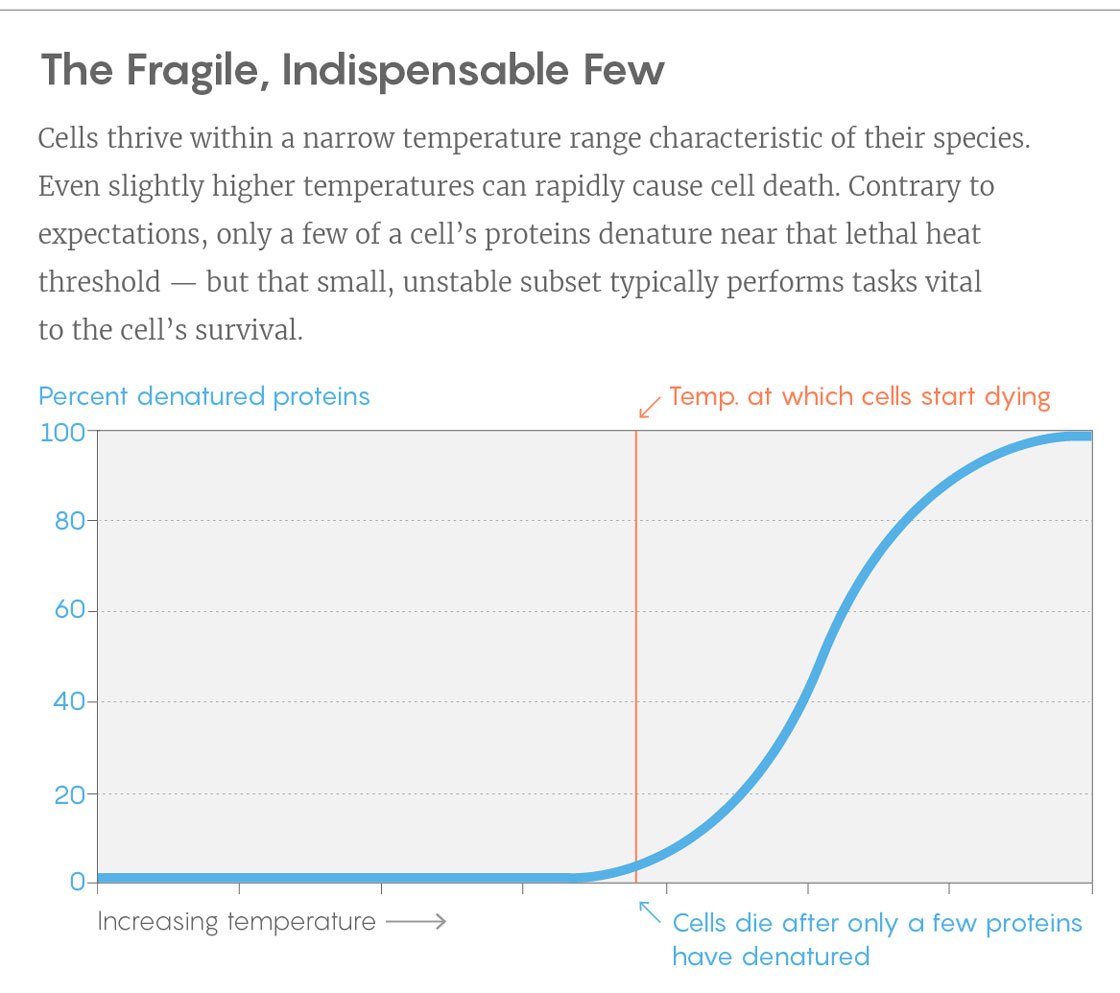
Пример кривой из эксперимента. По вертикали – процент развернувшихся белков, по горизонтали – температура. Вертикальная черта – температура, при которой клетки начинают умирать. Для этого нужно развернуться всего нескольким ключевым белкам.
Открытия могут помочь исследователям разработать белки, чья стабильность подстроена под их задачи. Во многих промышленных процессах, где используются бактерии, повышение температуры повышает и отдачу – но довольно скоро бактерии начинают умирать от жары. Было бы интересно узнать, сможем ли мы стабилизировать бактерии, сделав ключевые белки более устойчивыми к температуре – сказала Пикотти.
Обилие информации по поводу того, насколько легко разворачиваются определённые белки, сильно порадовало некоторых биологов. От стабильности белка напрямую зависит вероятность его агрегации: появления комков неразвернувшихся белков, прилипающих друг к другу. Агрегаты белков могут обернуться кошмаром для клеток и мешать выполнению главных задач. К примеру, их обвиняют в появлении некоторых серьёзных неврологических проблем, таких, как болезнь Альцгеймера, при которой бляшки развернувшихся белков засоряют мозг.

Паола Пикотти
Но это не значит, что агрегация происходит только у организмов, страдающих определёнными заболеваниями. Наоборот, исследователи поняли, что возможно, она происходит постоянно, и что у здоровых клеток есть методы, при помощи которых они справляются с нею. «Я думаю, что всё чаще это явление признаётся очень распространённым», – сказал Микель Вендрусколо [Michele Vendruscolo], биохимик из Кембриджского университета. «Большинство белков неправильно сворачиваются и агрегируют внутри клеток. Самое важное, что установила команда Пикотти, это тот отрезок времени, в котором какой-либо выбранный белок находится в развёрнутом состоянии. Это время определяет степень возможной агрегации белка». Некоторые белки почти никогда не разворачиваются и не агрегируют, другие ведут себя так в определённых условиях, а иные делают так постоянно. По словам биохимика, детальное описание белков в новой работе сильно облегчит изучение и понимание этих различий между белками. Некоторые из денатурационных кривых говорят о том, что их белки агрегируют после того, как развернулись. «У них получилось отследить оба этапа – как развёртывание, так и последующую агрегацию, – сказал Вендрусколо. – В этом вся прелесть этого исследования».
И хотя многие учёные интересуются агрегатами из-за наносимого ими ущерба, некоторые смотрят на это явление с другой точки зрения. Драммонд говорит, что становится ясным, что некоторые агрегаты – это не просто кусочки мусора, болтающиеся в клетке. Они содержат активные белки, продолжающие выполнять свои функции.
Представьте, что вы издалека видите дым, поднимающийся из какого-либо здания, говорит Драммонд. Вокруг здания вы видите некие фигуры, и вы представляете себе, что это тела, извлечённые из руин. Но если вы подойдёте ближе, вы можете обнаружить, что это живые люди, спасшиеся из горящего здания, ждущие, пока происшествие закончится. Так получается с исследованием агрегатов, говорит Драммонд: исследователи обнаруживают, что белки в агрегатах оказываются не жертвами, а выжившими. «Сейчас вообще появляется новая область науки, растущая взрывными темпами», – говорит он.
Комкование белков может оказаться не признаком повреждений, а способом для белка сохранять свои функции в сложной ситуации. Оно может, к примеру, защищать их от окружающей среды. А когда условия улучшаются, белки могут покидать агрегаты и сворачиваться заново. «Их форма меняется в зависимости от температуры таким образом, что на первый взгляд это кажется неправильным сворачиванием, – говорит Драммонд. – Но в этом есть какой-то иной смысл». В статье в журнале Cell от 2015 года он с коллегами определил 177 белков дрожжей, сохранивших свои функции уже после попадания в агрегаты. В работе, вышедшей в марте, эта команда описала, что если изменить один из белков так, чтобы он не смог агрегировать, то это приводит к серьёзным проблемам в функционировании клетки.
В общем и целом, работа утверждает, что белки – удивительно динамичные структуры. Сначала они могут показаться жёсткими машинами, работающими над зафиксированными задачами, для которых подходит одна определённая форма. Но на самом деле белки могут принимать несколько различных форм во время своей нормальной работы. И в нужное время их форма может меняться так сильно, что может показаться, будто они портятся, хотя на самом деле они наоборот укрепляются. На молекулярном уровне жизнь может представлять собой постоянные соединения и разъединения связей.
Источник


