Неверие в квантово-механические представления о строении электронных оболочек атомов и молекул принято считать ересью, не заслуживающей серьёзного внимания. Тем не менее, регулярно появляются еретики, пытающиеся при построении своих теорий обойтись без принципа неопределённости, орбиталей, волновых функций и прочих постулатов квантовой механики. В основе большинства таких теорий лежит представление о кольцевом (или тороидальном) строении электрона («магнетона»), предложенное ещё в 1915 году Альфредом Парсоном. У авторов более современной теории струн электроны считаются кольцевыми струнами, но Вселенной приписывается не менее десяти измерений, из которых только четыре доступны человеческому восприятию. К последователям А.Парсона с менее буйной фантазией относятся A.Канарёв, А.Кушелев, З.Огжевальский, S.Allen, D.Bergman, P.Ošmera, K.Snelson, P.Vesly и многие другие авторы и сторонники теорий кольцевого (тороидального, вихревого, фрактального и т.п.) электрона.
Электронные оболочки из кольцевых электронов можно построить как для атомов и простейших молекул, так и для биополимеров (https://habr.com/ru/post/374003/). Химикам этого вполне достаточно, но физикам требуется теория, объясняющая ещё и известные физические свойства атомов. Прежде всего — спектральные свойства атома водорода. Поэтому простую кольцевую форму электрона физики пытаются трансформировать в более витиеватые тороидальные, спиральные, вихревые или фрактальные структуры.
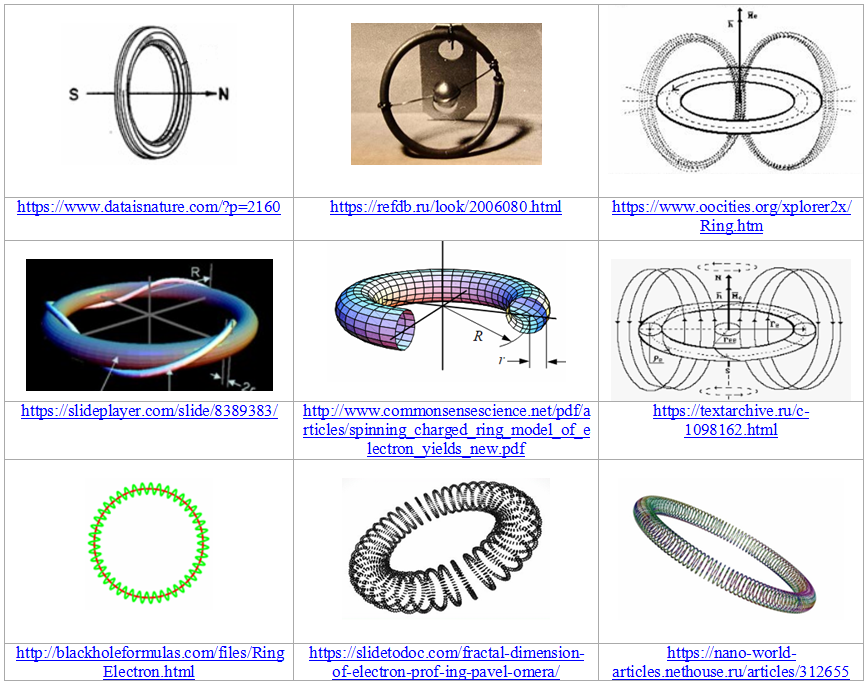
Один из возможных вариантов такой трансформации – дробление одного кольца, соответствующего верхнему (нулевому) энергетическому уровню электрона в атоме водорода, на пары мелких колечек. При этом количество таких пар (от 1 до 6) соответствует дискретным энергетическим состояниям электрона.
(https://habr.com/ru/post/410709/)
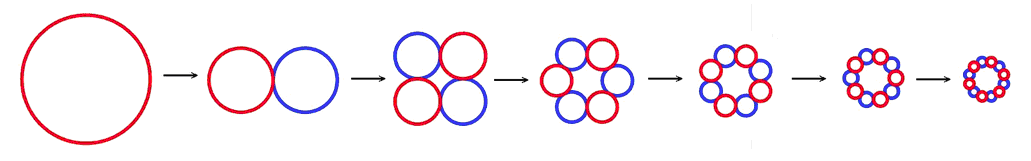
Такая схема формирования дискретных энергетических уровней электрона позволяет объяснить существование спектральных серий и линий излучения атомарного водорода.
(https://habr.com/ru/post/410709/)
Если электроны действительно являются не просто кольцевыми, а многокольцевыми, то этим определяется строение внешних электронных оболочек всех элементов таблицы Менделеева. И их электроны должны состоять из шести пар колец – как у атомарного водорода в невозбуждённом состоянии. Для подтверждения данной гипотезы необходимо построить модели различных оболочек из замкнутых 12-звенных электронов, и при помощи таких моделей попытаться объяснить физические и химические свойства соответствующих им атомов и молекул.
При построении моделей электронных оболочек элементов, относящихся к различным группам и периодам таблицы Менделеева, эту таблицу желательно иметь перед глазами. И ориентироваться не только на общее количество внешних электронов, но и на их чётность, а также на возможное влияние нижележащих оболочек на характер сборки внешних оболочек и, соответственно, на свойства атомов.
Многокольцевые электроны могут иметь несколько вариантов укладки составляющих их звеньев, отличающихся количеством контактных точек и плотностью распределения заряда. Можно предположить, что наиболее стабильные оболочки атомов и молекул состоят из электронов с симметричным расположением составляющих их одинаковых звеньев (колечек).
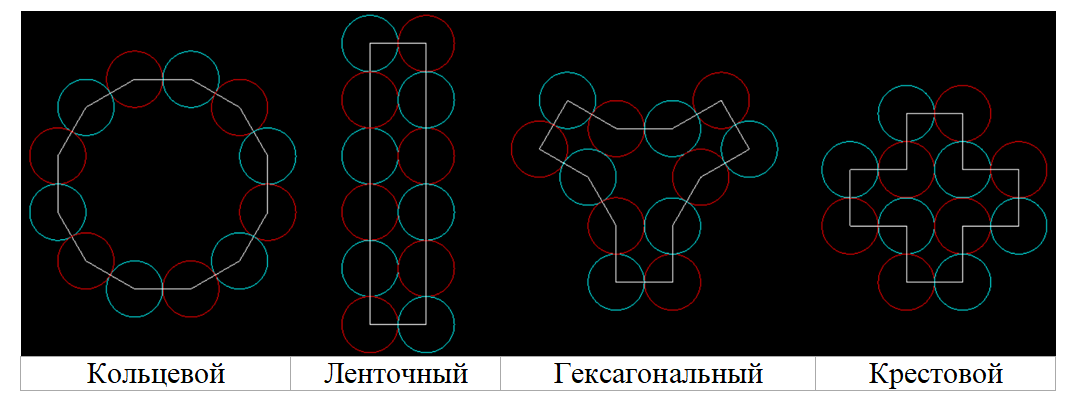
В трёхмерной модели атома водорода с электроном в основном (невозбуждённом) состоянии составляющие его звенья (с ленточной укладкой) могут располагаться на поверхности сферы с центральным атомным ядром (протоном). Такая электронная сфера обладает минимальным объёмом (и диаметром) и максимальным количеством точек соприкосновения звеньев с противоположной ориентацией магнитного поля.

(https://p3d.in/Jzm8l)
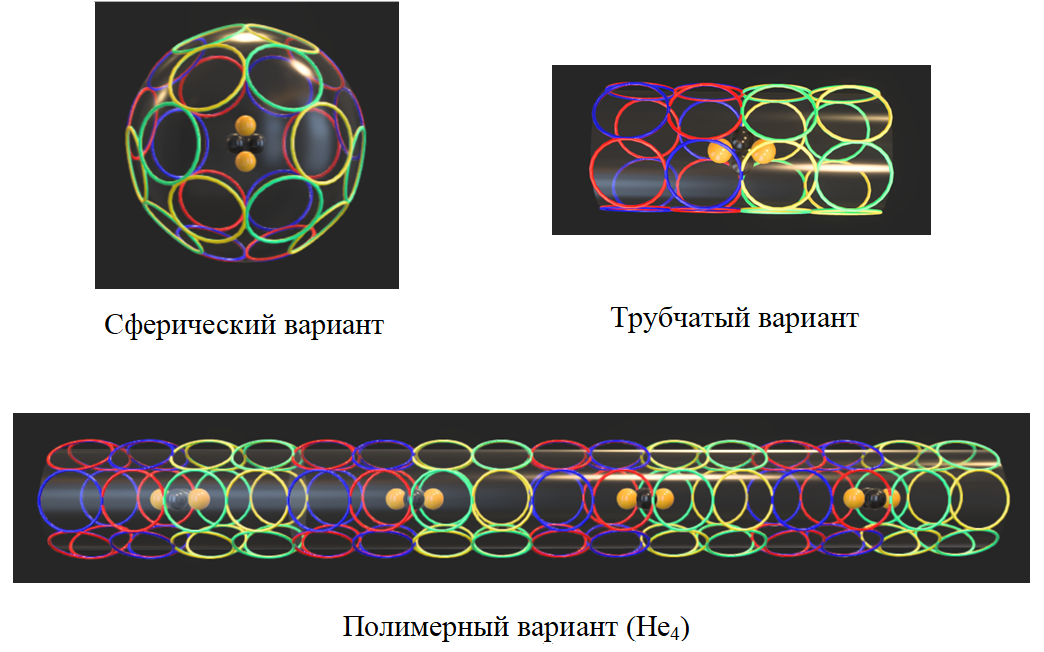
Для двух электронов атома гелия возможны по крайней мере два варианта укладки составляющих их 24 (12х2) звеньев. Сферический может соответствовать гелию-I – химически инертному, с экстремально низкой температурой кипения (4,2°K). Трубчатый вариант должен легко полимеризоваться и подходит для гелия-II, образующегося при температуре <2,17°K и отличающегося сверхтекучестью.
Для остальных благородных газов, завершающих как малые (Ne, Ar), так и большие периоды таблицы Менделеева (Kr, Xe, Rn), можно предложить по крайней мере два варианта их восьмиэлектронных оболочек – монослойный, состоящий из гексагональных электронов, и двухслойный, у которого внешний четырёхэлектронный слой (https://p3d.in/INNOE) соединяется с внутренним слоем (https://p3d.in/3k6Db) радиальными шестичленными венчиками.

Немаловажным преимуществом двухслойной оболочки является простота построения её производных, у которых нехватка электронов во внешнем слое компенсируется атомами водорода – с протонами, расположенными в соединительных шестизвенных колодцах (венчиках) на максимальном удалении друг от друга. Для второго периода таблицы Менделеева такими производными являются метан (СН4), аммиак (NH3), вода (H2O) и фтороводород (HF). Причём в оболочке воды возможно не только угловое (мета-), но и прямое (орто-) расположение протонов.

достроенными атомами водорода
Для атомов щелочных металлов (Li, Na, K, Rb, Cs, Fr) можно предложить несколько вариантов моделей их электронных оболочек, но для компенсации магнитных полей электронов они должны быть димерными, причём склонными к полимеризации. Димерная природа щелочных металлов редко упоминается в учебниках, но хорошо известна специалистам.
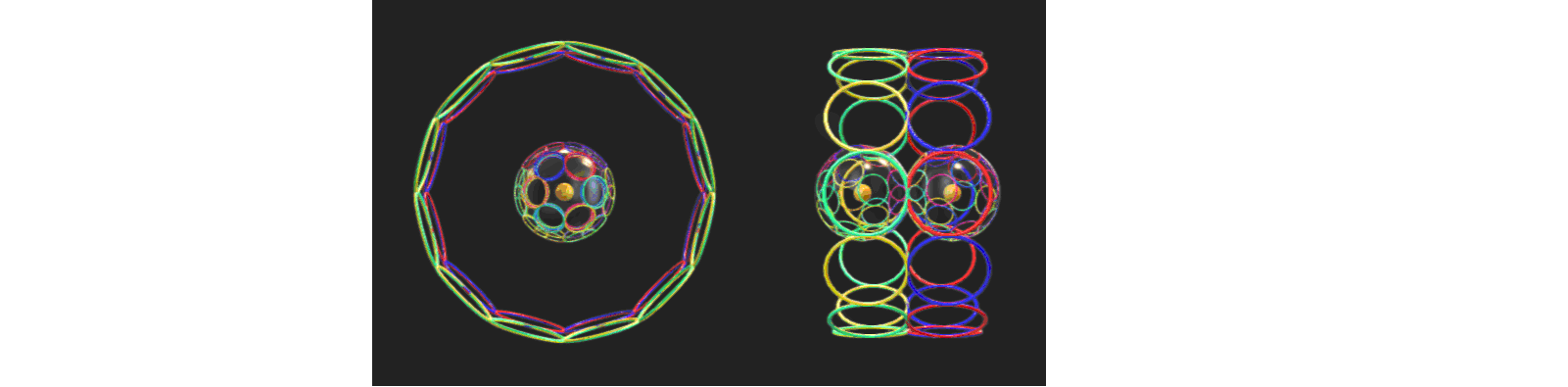
(https://p3d.in/V0gGf)
Полимеризацией двухэлектронной оболочки может объясняться и прочность металлического бериллия. А полимеризация трёхэлектронных оболочек способна определять сверхпрочность конструкционных волокон бора, получаемых его осаждением на тонкую нить или проволоку.

Полимерные трёхэлектронные оболочки трубчатого типа подходят также для металлов третьей группы, легкоплавкость которых (галлий — 29,76°C, индий — 156,6°C, таллий — 304°C) может объясняться лёгкостью перестроения полимерной формы в сферическую.

Неуравновешенность магнитных полей у таких трёхэлектронных сфер (нечётность количества их электронов) может определять и нелетучесть, и сравнительно высокие температуры кипения расплавов этих металлов (Ga – 2477°C; In – 2072°C; Tl — 1746°C).
Внешняя оболочка атома углерода содержит 4 электрона, из которых при соединении двух кольцевых и двух крестовых электронов можно построить очень компактную сферу. Но обладающие такой сферической оболочкой элементы должны быть если не газообразными, то хотя бы легкоплавкими, что для углерода явно не характерно. Его свойства проще объяснить формированием трубчатой оболочки из четырёх кольцевых электронов, которое может быть обусловлено нестабильностью крестовой структуры электрона, отличающейся высокой плотностью отрицательного заряда.

Атомы углерода с трубчатыми четырёхэлектронными оболочками должны легко димеризоваться. А димеры – полимеризоваться, образуя при линейной полимеризации карбин, при двухмерной – графен, а при объёмной – фуллерен, нанотрубки и их многочисленные производные.

Восьмиэлектронные оболочки благородных газов при завершении четвёртого и пятого периодов таблицы Менделеева должны располагаться поверх 10-электронных, которые могут быть максимально компактными только при двухслойной структуре – при соединении двух сферических 4-электронных оболочек (https://p3d.in/XB0nW) двумя кольцевыми электронами с радиально расположенными звеньями.

Для объяснения строения внутренних 10-электронных оболочек данный вариант вполне подходит, но элементы с внешней оболочкой такого типа должны быть если не летучими, то хотя бы легкоплавкими. А это явно не соответствует свойствам ковких и пластичных металлов — никеля и палладия. Им больше подходит полимерная оболочка, мономеры которой могут получаться трансформацией торцевых крестовых электронов в соединительные электронные кольца.

Вероятно, компактные крестовые электроны внешних оболочек перестраиваются в менее компактные кольцевые из-за взаимного отталкивания составляющих их отрицательно заряженных звеньев. Во внутренних оболочках такое отталкивание может компенсироваться притяжением атомного ядра.
Аналогичные варианты полимеризации электронных оболочек можно приписать и другим металлам, имеющим незавершённые внешние электронные оболочки. Или их сплавам, причём состоящим не только из близких по размерам атомов. Например, 8-электронная оболочка железа при таком строении может сочетаться с трубчатыми оболочками атомов углерода, образуя многочисленные карбиды (Fe3C, Fe2C, Fe3C4, FeC, FeC2) и содержащие их чугун и сталь.

Отдельного рассмотрения заслуживают электронные оболочки элементов шестого периода (от цезия до радона), включающего 14 лантаноидов. Для объяснения газообразности радона вполне подходит двухслойная 8-электронная оболочка. Свойства платины ассоциируются с двухслойной (полимерной) 10-электронной оболочкой никеля/палладия, но под ней должны находиться дополнительные внутренние слои, содержащие 14 лантаноидных электронов. И внутренние слои должны содержать ещё одну двухслойную 10-электронную оболочку и одну 4-электронную сферу. Хотя в этом периоде более вероятно внутреннее расположение двух 10-электронных оболочек, при котором четырёхэлектронная оболочка будет внешней.
За платиной в таблице Менделеева следует золото, полимерная оболочка которого может отличаться от платиновой присутствием одного внутреннего крестового электрона.

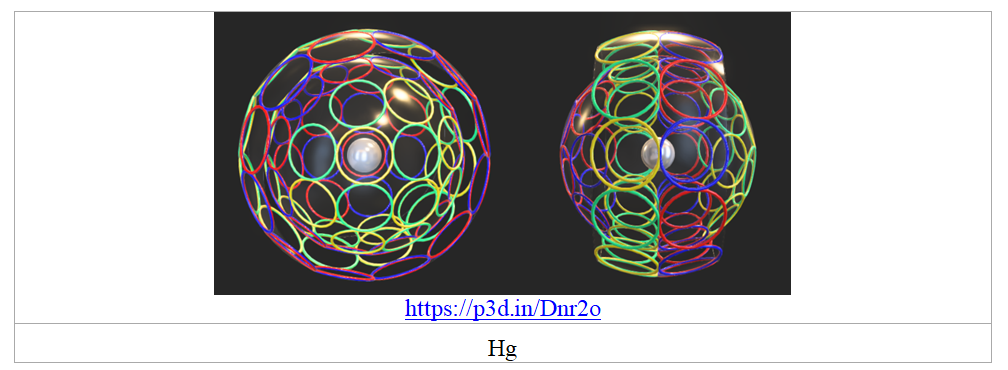
Уникальные свойства следующей за золотом ртути могут быть обусловлены соотношением размеров её внешнего двухэлектронного пояса и внутренней 4-электронной сферы, которая выступает по бокам и препятствует характерной для металлов полимеризации внешних электронных оболочек.
Если оболочки атомов действительно состоят из 12-звенных электронов (что очень похоже на правду), то построить подобные модели можно и для всех молекул. Но для таких построений лучше использовать не трудоёмкое 3D-моделирование, а специально разработанные программы. Ещё лучше – компьютерные игры, позволяющие легко и просто собирать виртуальные электронные оболочки атомов и молекул любой сложности из готовых элементов, которых может быть совсем не много. Например, для моделирования структуры алмаза достаточно электронов всего одного типа.

Неплохо строятся из 12-звенных электронов и оболочки молекул, но их лучше рассматривать в отдельной статье. Да и конструировать не при помощи 3D-рисования, а менее трудоёмкими способами. Поэтому в заключение хочу выразить глубочайшую благодарность Тимофею (https://kwork.ru/user/3dkiwi), который построил все описанные выше 3D-модели. Сам-то я в 3D-рисовании ничего (или почти ничего) не понимаю.
Ещё я ничего (вообще ничего!) не понимаю в UE5, Unity3D, Godot Engine и прочих платформах и программах для геймдева. Поэтому буду признателен за любые идеи, предложения и соображения по их использованию для молекулярного макетирования..


