Так вот для таких случаев была предложена идея электрической стимуляции сетчатки или зрительной коры, создание протеза, который по механизму действия имитирует настоящие процессы передачи электрических сигналов.

Вариантов электронных имплантов несколько, каждый год появляются новые идеи, но термин и сам «Бионический глаз» (Bionic Eye) разработан Дэниелом Паланкером, сотрудником Стэнфордского университета и его научной группой «Биомедицинской физики и офтальмологических технологий».
Имплантация модели бионического глаза Argus II (кстати, единственной модели, имеющей ЕС марку, но не сертифицированной в России) была выполнена в России в июле 2017 года одному пациенту. И со всех источников телевещания мы услышали – теперь человек сможет увидеть мир как раньше. Сотни людей просят поставить бионический глаз, а некоторые вдобавок просят «вживить» чипы для суперзрения.
Так что же мы на сегодняшний день имеем и может ли стать явью мечта увидеть мир после того, как потерял зрение?
БИОЛОГИЧЕСКИЕ АСПЕКТЫ ПРОТЕЗИРОВАНИЯ СЕТЧАТКИ
Бионическими называют протезы и имплантируемые элементы частей организма человека, которые подобны по внешнему виду и функциям на настоящие органы или конечности. На сегодняшний день людям успешно помогают в полноценной жизни бионические руки, ноги, сердца, а также органы слуха. Цель создания электронного глаза — помочь слабовидящим с проблемами сетчатки или зрительного нерва. Имплантируемые вместо поврежденной сетчатки устройства должны заменить миллионы клеток фоторецепторов глаза, пусть не на все 100%.
Технология для глаз похожа на ту, которая используется в слуховых протезах, помогающим глухим людям слышать. Благодаря ей пациенты имеют меньше шансов потерять остаточное зрение, а утратившие зрение — видеть свет и иметь хоть какую-то способность ориентироваться в пространстве самостоятельно.

ТЕХНОЛОГИЧЕСКИЕ АСПЕКТЫ
Общий принцип действия электронного глаза следующий: в специальные очки встраивается миниатюрная камера, с нее информация об изображении передается в девайс, который преобразует картинку в электронный сигнал и отсылает его на специальный передатчик, который в свою очередь посылает электронный сигнал на имплантированный в глаз или в мозг приёмник, или информация передается через крошечный проводок на электроды, присоединенные к сетчатке глаза, они стимулируют оставшиеся нервы сетчатки, посылая электрические импульсы в головной мозг через оптические нервы. Устройство призвано компенсировать утраченные зрительные ощущения при полной или неполной потере зрения.
Главные условия успешной работы системы:
- Наличие в глазу и мозгу пациента части живых нервных клеток.
- Пациентами должны быть люди, которые когда-то нормально видели, так как тот, кто слепой от рождения, пользоваться такими устройствами не сможет. Подходят люди, долгое время видевшие и имеющие богатый зрительный опыт. В результате они мало видят, но имеют представления о предметах и догадываются что это за предмет. Короче, должна быть развита кора головного мозга и обладание достаточным интеллектом.
- И, понятно, чем больше пикселей будет в чипе, тем четче будет полученное изображение.

- Длительный срок эксплуатации – пока срок использования этих устройств никто не знает. Первая имплантация бионических глаз в Германии закончилась тем, что их через год всем пациентам удалили. Даже тем, кто что-то видел. Об этом даже в прессе Германии писали.
- Технологичный способ подзарядки. Сейчас они работают по принципу индукции, не на батарейках. Заряжаются как электрическая зубная щетка.
- Попутно должен решаться вопрос окисления, нагрева и т.п. Например, дырчатая конструкция после имплантации может позволить нервным клеткам сетчатки автоматически перетекать с верхней и нижней поверхностей фотодатчика через полости и соединяться, а также уменьшить нагрев пикселей и увеличить их количество.
МИКРОХИРУРГИЧЕСКИЕ АСПЕКТЫ ПРОТЕЗИРОВАНИЯ
Это обширнейшие операции. Если описать, например, имплантацию субретинального (расположенного под сетчаткой) бионического глаза – нужно полностью сетчатку поднять, потом сделать обширную ретинэктомию (обрезать часть сетчатки), потом под сетчатку установить этот чип, затем сетчатку пришить ретинальными гвоздями, приклеить сетчатку лазеркоагуляцией и залить силиконовым маслом. Силиконовая тампонада необходима, иначе моментально появится ПВР (пролиферативная витреоретинопатия) и возникнет отслойка. Да, еще и хрусталика собственного не должно быть или он должен быть предварительно заменен на искусственную линзу.
Для операции нужны особые инструменты с щадящими силиконовыми наконечниками. Это совершенно непростая операция, кроме того еще нужен оро-фациальный хирург или ЛОР – они через кожу выводят электроды наружу. И получается такое устройство – чип внутри глаза, а в руках такой приборчик величиной с мобильный телефон, которым ты можешь изменять интенсивность сигнала, он соединяется с подкожными электродами. Одного офтальмолога-хирурга при операции недостаточно – нужна помощь других дисциплин, операция длится долгих 6 часов.
ЭКОНОМИЧЕСКИЕ АСПЕКТЫ ПРОТЕЗИРОВАНИЯ
- Во-первых, это дорого. Только прибор стоит порядка 150 тыс. долларов, то есть почти 8,5 миллионов рублей. А все лечение одного такого пациента может достигать 10 миллионов рублей. Речь идет о модели Argus II. На сегодняшний день в некоторых странах, например, в Германии эта операция оплачивается за счет страховок.
- Фирмы, занимающиеся разработкой и производством, во всем мире живут на государственных дотациях, на грантах. Это здорово — такие вещи должны поддерживаться, иначе никакого развития не будет.
- Сертификата в России нет ни на какое из нижеперечисленных устройств.
МЕДИЦИНСКИЕ АСПЕКТЫ ПРОТЕЗИРОВАНИЯ
1. Результаты довольно скромные – после операции таких людей нельзя назвать зрячими, они видят на уровне 0,05 максимум, т.е. могут видеть контуры и определять направление движения тени, цветов вообще не различают, предметы могут различаться только те, которые помнятся из прежней «зрячей» жизни, например: «ага – это, наверное, банан, так как что-то полукруглое». Видят, что что-то на них движется, могут догадаться, что это человек, но лицо его не различают.
2. При каких заболеваниях может быть полезен бионический глаз?
Первые пациенты – это пациенты с пигментным ретинитом (retinitis pigmentoza) – заболеванием с первичным исчезновением фоторецепторов и вторичной атрофией зрительного нерва. В России таких пациентов 20-30 тысяч человек, в Германии – всего несколько тысяч.
Следующими на очереди стоят пациенты с географической атрофической макулярной дегенерацией. Это чрезвычайно распространенная возрастная патология глаза.
Третьими будут, больные глаукомой. Глаукомой пока не занимались, так как атрофия зрительного нерва в этом случае первичная, поэтому способ передачи должен быть другой – в обход зрительного нерва.
Диабет – это самая сложно решаемая проблема. Один из методов лечения диабетических изменений на сетчатке – лазеркоагуляция по всей поверхности. После такой процедуры технически невозможно поднять сетчатку из-за лазеркоагулятов — это получается «решето». А если не сделано лазером – ситуация не лучше: обычно глаз настолько поврежден, что имплантация в этом случае бесполезна.
3. К сожалению, нынешний прототип бионического глаза не позволяет людям видеть окружающий мир так, как видим его мы. Их цель — перемещаться самостоятельно без посторонней помощи. До массового использования этой технологии еще далеко, однако ученые подарят надежду людям, потерявшим зрение.
ТЕКУЩИЕ ПРОЕКТЫ «БИОНИЧЕСКИХ ГЛАЗ»
В последние несколько десятков лет ученые разных стран работают над идеями бионических электронных глаз. С каждым разом технологии совершенствуются, однако на рынок для массового использования свое изделие еще никто не представил.
1. Argus retinal prosthesis
Ретинальный протез Argus – это американский проект, довольно хорошо коммерциализированный. В первой модели разрабатывался командой исследователей в начале 1990-х годов: пакистанского происхождения офтальмологом Марком Хамейуном (Mark Humayun, кстати, профессор Секундо с ним знаком по Johns Hopkins University – в то время он был резидентом 2-го года, Вальтер — студентом), Евгеном Дейаном, инженером Ховардом Филлипсом, биоинженером Вентай Лью и Робертом Гринбергом. Первая модель, выпущенная в конце 1990-х, компанией Second Sight имела всего 16 электродов.
«Полевые испытания» первой версии бионической сетчатки были проведены Марком Хамейуном шести пациентам с потерей зрения в результате заболевания retinitis pigmentosa в промежутке с 2002 по 2004 год. Retinitis pigmentosa — неизлечимая болезнь, при которой человек теряет зрение. Наблюдается примерно в одном случае на каждые три с половиной тысячи человек.

Вид внешнего блока Argus II
Пациенты, которым был вживлен бионический глаз, показали способность не только различать свет и движение, но и определять предметы размером с кружку для чая или даже ножа.
Устройство для испытаний было усовершенствовано — вместо шестнадцати светочувствительных электродов в него было вмонтировано шестьдесят электродов и названо Argus II. В 2007 году начато мультицентровое исследование в 10 центрах 4-х стран США и Европы – всего 30 пациентов. В 2012 году Argus II получил разрешение для коммерческого использования в Европе, годом позже в 2013 году – в США. В России разрешения нет.
По сей день эти исследования субсидируются государственными фондами, в США их три — National Eye Institute, Department of Energy, and National Science Foundation, а также рядом исследовательских лабораторий.
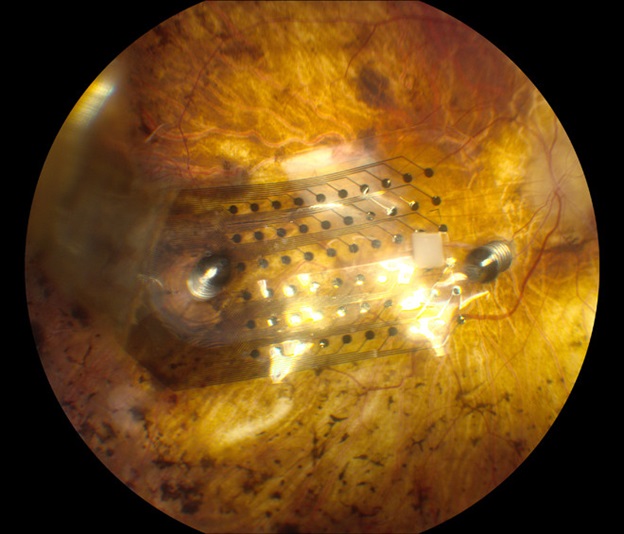
Так выглядит чип на поверхности сетчатки
2. Microsystem-based visual prosthesis (MIVP)
Модель протеза спроектирована Клодом Вераартом (Claude Veraart) в университете Лувена в виде спиральной манжеты электродов вокруг зрительного нерва в задней части глаза. Она коннектится со стимулятором, имплантированным в небольшую ямку в черепе. Стимулятор получает сигналы от внешней камеры, которые переводятся в электрические сигналы, стимулирующие непосредственно зрительный нерв.
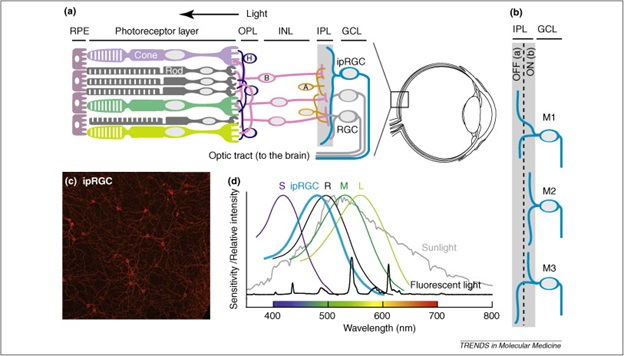
Схема MIVP
3. Implantable miniature telescope
На самом деле это устройство нельзя назвать «протезом сетчатки», поскольку этот телескоп имплантируется в заднюю камеру глаза и работает как лупа, увеличивающая ретинальное изображение в 2.2 или 2.7 раз, что позволяет уменьшить влияние на зрение скотом (слепых зон) в центральной части поля зрения. Имплантируется только в один глаз, поскольку наличие телескопа ухудшает периферическое зрение. Второй глаз работает для периферии. Имплантируется через довольно большой разрез роговицы.
Кстати, похожий принцип используется в добавочных интраокулярных линзах Шариотта. У меня самый большой опыт имплантации этих линз в России и результатами пациенты довольны. В этом случае вначале предварительно проводится факоэмульсификация катаракты. Хотя это, конечно, не 100% бионический глаз.
Подробнее об этом в предыдущих постах:
- Катаракта: это ждёт лично вас (если доживёте, конечно)
- Имплантируем искусственный хрусталик (вам это понадобится лет после 60)
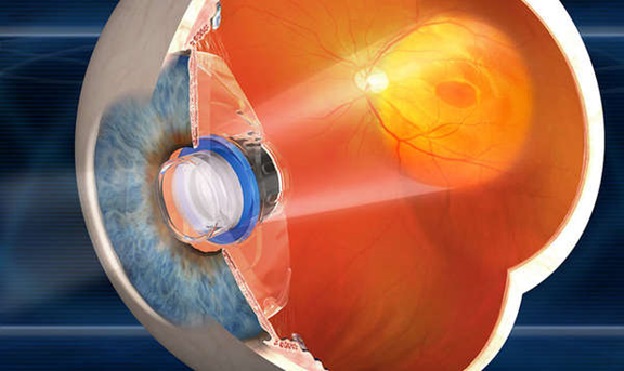

Телескопическая система для задней камеры глаза
4. Tübingen MPDA Project Alpha IMS
В 1995 году в Университетской глазной клинике Тюбингена началась разработка субретинальных протезов сетчатки. Под сетчатку укладывался чип с микрофотодиодами, который воспринимал свет и трансформировал в электрические сигналы, стимулирующие ганглионарные клетки наподобие естественного процесса в фоторецепторах неповрежденной сетчатки.
Конечно, фоторецепторы во много крат чувствительнее искусственных фотодиодов, поэтому они требовали специального усиления.
Первые эксперименты на микросвинках и кроликах были начаты в 2000 году, и только в 2009 году импланты были вживлены 11 пациентам в рамках клинического пилотного исследования. Первые результаты были обнадеживающими – большинство пациентов смогли отличать день от ночи, некоторые даже могли распознавать предметы – чашку, ложку, следить за перемещением крупных предметов. Кстати, дальнейшая участь этих пациентов была печальна – всем участникам эксперимента, даже тем, кто что-то увидел, согласно подписанному соглашению были удалены «бионические глаза» и они вернулись в исходное состояние.
На сегодняшний день Alpha IMS, производства Retina Implant AG Germany имеет 1500 электродов, размер 3×3 мм, толщиной 70 микрон. После установки под сетчатку это позволяет почти всем пациентам получить некоторую степень восстановления светоощущения.
Технически эту сложную операцию в Германии делают только в трех центрах: в Аахене, в Тюбингене и Лейпциге. В итоге это делают хирурги так называемой Кельнской школы, ученики профессора витреоретинального хирурга Хайнеманна, к сожалению, довольно рано скончавшегося от лейкемии, но все его ученики стали руководителями кафедр в Тюбингене, Лейпциге и в Аахене.
Эта группа ученых обменивается опытом, ведет совместные научные разработки, у этих хирургов (в Аахене – профессор Вальтер (это его фамилия), в Тюбингене – профессор Барц-Шмиц) самый большой опыт работы с бионическими глазами, потому как в этом случае 7-8-10 имплантаций считается большим опытом.
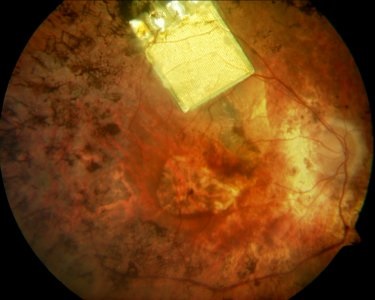
Alpha IMS на глазном дне
5. Harvard/MIT Retinal Implant
Джозеф Риццо и Джон Уайетт из Массачусета начали исследовать возможность создания протеза сетчатки в 1989 году, и провели испытания стимуляции на слепых добровольцах в период между 1998 и 2000 годами. На сегодняшний день это идея устройства минимально инвазивного беспроводного субретинального нейростимулятора, состоящего из массы электродов, который помещается под сетчатку в субретинальном пространстве и получает сигналы изображения от камеры, установленной на паре очков. Чип-стимулятор декодирует данные изображения из камеры и стимулирует соответственно ганглиозные клетки сетчатки. Протез второго поколения собирает данные и передает их имплантату через радиочастотные поля из катушки передатчиков, установленных на очках. Вторичная катушка приемника зашита вокруг радужки.

Модель MIT Retinal Implant
6. Artificial silicon retina (ASR)
Братьями Аланом Чоу и Винсентом Чоу был разработан микрочип, содержащий 3500 фотодиодов, которые обнаруживают свет и преобразуют его в электрические импульсы, стимулирующие здоровые ганглионарные клетки сетчатки. «Искусственная силиконовая сетчатка» не требует использования внешних устройств. Микрочип ASR — это кремниевый чип диаметром 2 мм (та же концепция, что и в компьютерных чипах), 25 микрон толщиной, содержащий ~5000 микроскопических солнечных элементов под названием «микрофотодиоды», каждый из которых имеет свой собственный стимулирующий электрод.
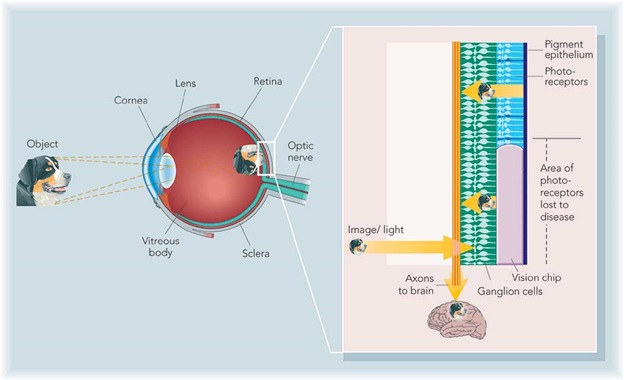
Схема ASR
7. Photovoltaic retinal prosthesis
Даниэль Palanker и его группа в Стэнфордском университете разработали фотоэлектрическую систему, она же и есть «бионический глаз». Система включает в себя субретинальной фотодиод и инфракрасную проекционную систему изображения, установленную на видеоочки.
Информация с видеокамеры обрабатывается в девайсе и отображается в импульсном инфракрасном (850-915 нм) видеоизображении. ИК-изображение проецируется на сетчатку через естественную оптику глаза и активирует фотодиоды в субретинальном имплантате, которые преобразуют свет в импульсный бифазный электрический ток в каждом пикселе.
Интенсивность сигнала может быть дополнительно увеличена с помощью увеличения общего напряжения, обеспечиваемого радиочастотным приводом имплантируемого источника питания.
Схожесть между электродами и нейронными клетками, необходимая для стимуляции высокого разрешения, может быть достигнута с использованием эффекта миграции сетчатки.
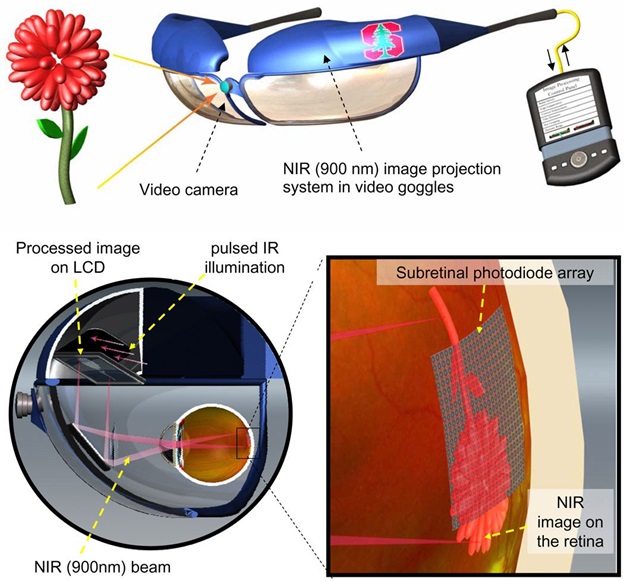
Модель Паланкера
8. Bionic Vision Australia
Австралийская команда во главе с профессором Энтони Буркиттом разрабатывает два протеза сетчатки.
Устройство Wide-View сочетает в себе новые технологии с материалами, которые были успешно использованы для других клинических имплантатов. Этот подход включает в себя микрочип с 98 стимулирующими электродами и направлен на повышение мобильности пациентов, чтобы помочь им безопасно перемещаться в своей среде. Этот имплантат будет помещен в супрахориоидальное пространство. Первые тесты пациентов с этим устройством начаты в 2013 году.
Bionic Vision Australia — это микрочип-имплантат с 1024 электродами. Этот имплантат помещается в супрахориоидальное пространство. Каждый прототип состоит из камеры, прикрепленной к паре очков, которая посылает сигнал на имплантированный микрочип, где преобразуется в электрические импульсы для стимуляции оставшихся здоровых нейронов сетчатки. Затем эта информация передается зрительному нерву и центрам обработки зрения головного мозга.
Австралийский исследовательский совет присудил Bionic Vision Australia грант в размере 42 миллионов долларов США в декабре 2009 года, и консорциум был официально запущен в марте 2010 года. Bionic Vision Australia объединяет многопрофильную команду, многие из которых имеют большой опыт разработки медицинских устройств, таких как «бионическое ухо».
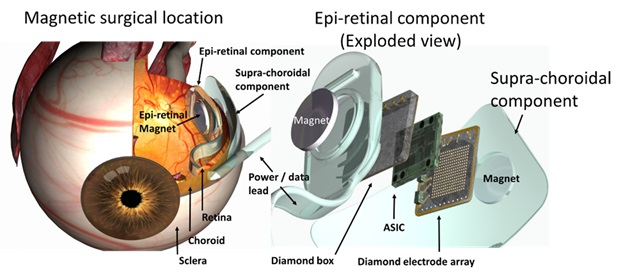
Модель Bionic Vision Australia
Благодаря исследователям из Института бионики (Мельбурн, Австралия) и компании evok3d, трудящихся над «бионическим глазом», люди, страдающие пигментной дистрофией сетчатки и возрастной молекулярной дегенерацией, в перспективе смогут восстановить зрение. Для проведения процедур восстановления необходимы оставшиеся у пациента ганглионарные клетки, здоровый зрительный нерв и здоровая зрительная зона коры головного мозга. В этом случае у человека есть возможность вновь обрести зрение.
Для изготовления прототипа глаза, а также формы для его отливки, ученые из Института бионики обратились за помощью к специалистам компании evok3d, специализирующейся на 3D-услугах и для печати «искусственного глаза» использовали 3D-принтер ProJet 1200.
Понадобилось всего четыре часа, чтобы напечатать прототип на ProJet 1200, до появления 3D-печати на его изготовление тратили недели или даже месяцы. Вот так 3D-печать ускорила научно-исследовательский и производственный процесс.
Бионическая зрительная система включает в себя камеру, передающую радиосигналы микрочипу, расположенному в задней части глаза. Эти сигналы превращаются в электрические импульсы, стимулирующие клетки в сетчатке и зрительный нерв. Потом они передаются в зрительные зоны коры мозга и преобразуются в изображение, которое видит пациент.
9. Dobelle Eye
Аналогично по функции устройству Гарвард/МИТ (6), кроме стимуляторной микросхемы, которая имплантируется прямо в мозг в первичную зрительную кору, а не на сетчатку глаза. Первые впечатления от имплантата были неплохие. Еще в стадии развития, после смерти Добеля, было решено превратить этот проект из коммерческого в проект, финансируемый государством.
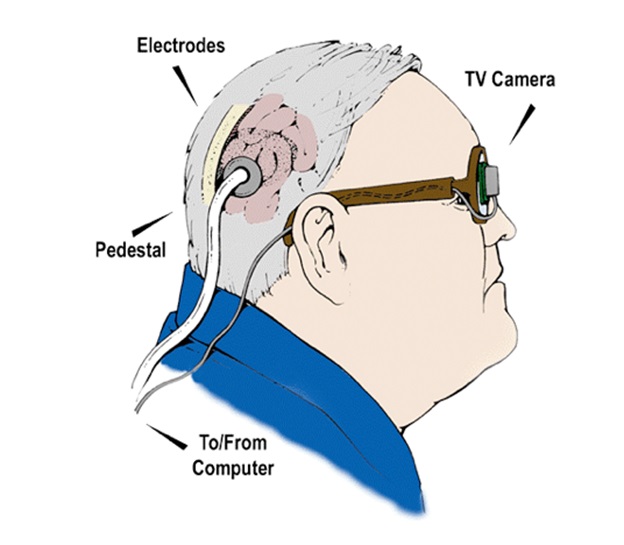
Схема Dobelle Eye
10. Intracortical visual prosthesis
Лаборатория нейронных протезов из Иллинойского технологического института в Чикаго, разрабатывает визуальный протез, используя внутрикорковые электроды. В принципе, аналогично системе Добеля, применение внутрикорковых электродов позволяет значительно увеличить пространственное разрешение в сигналах стимуляции (больше электродов на единицу площади). Кроме того, разрабатывается система беспроводной телеметрии для устранения необходимости в транскраниальных (внутричерепных) проводах. Электроды, покрытые слоем активированной пленки оксида иридия (AIROF), будут имплантированы в зрительной коре, расположенной в затылочной доле мозга. Наружный блок будет захватывать картинку, обрабатывать ее и генерировать инструкции, которые затем будут передаваться в имплантированные модули по телеметрическому линку. Схема декодирует инструкции и стимулирует электроды, в свою очередь стимулируя зрительную кору. Группа разрабатывает датчики внешней системы захвата и обработки изображений для сопровождения специализированных имплантируемых модулей, встроенных в систему. В настоящее время проводятся исследования на животных и психофизические исследования человека для проверки целесообразности имплантации добровольцам.

Чип на фоне монеты
ИТОГ
Сейчас все в стадии пусть не первичной, но такой вторичной разработки, что о массовой эксплуатации и решении всех проблем вообще пока речи не идет. Слишком мало людей прооперировано и никак нельзя говорить о массовом производстве. В настоящее время все это еще стадия разработки.
Первые работы начались более 20 лет назад. В 2000-2001 году что-то начало получаться на мышах. В настоящее время мы получили первые результаты на людях. То есть вот такая скорость.
Пока будет что-то серьезное, еще двадцать лет может пройти. Мы находимся на очень-очень ранней стадии, на которой есть первый положительный эффект – распознавание контуров, света, и не у всех – пока не могут предсказать кому это поможет, а кому нет.
Хирургов, которые занимаются этими экспериментами – по пальцам пересчитать.
Имплантировать один протез – это только с рекламной целью. Этими работами должны заниматься люди, у которых есть возможность делать 100-200 операций в год в рамках одной проектной группы, чтобы появилась критическая масса. Тогда появится понимание в каких случаях можно ожидать эффекта. Такие программы должны субсидироваться бюджетом или специализированными фондами.
Хотя еще нет совершенной модели, все существующие требует доработки, ученые полагают, что в будущем электронный глаз может заменить функцию клеток сетчатки и помочь людям обрести хоть малейшую способность видеть с такими заболеваниями, как пигментный ретинит, дегенерация желтого пятна, старческая слепота и глаукома.
Если у вас есть свои идеи, как еще можно с помощью технологий вернуть зрение людям (пусть пока еще и труднореализуемыми способами) – предлагаем их обсудить ниже.
А история с бионическими контактными линзами, потенциале редактирования генома, о том, как можно слышать цвета посредством кое-чего, вживленного в мозг – в следующих постах.
Источник

