
Универсального лечения от онкологических заболеваний не существует до сих пор, однако биоинформатики работают с колоссальным объемом данных, чтобы в том числе разрабатывать новые методы лечения и диагностики рака.
Но есть одна незадача: рак – это общий термин, обозначающий большую группу сложных многофакторных заболеваний, на развитие которых влияет и окружающая среда и генетика. Он может проявиться у любого человека в любой момент жизни. И да, привязанности к органам или тканям нет: в потенциальной опасности любая часть тела – от мозга до костей.
Большие надежды на борьбу с раком мировая медицина связывает с развитием биоинформатики. С её помощью исследователи смотрят на жизнь не через микроскоп, а с точки зрения огромных массивов данных. Это некая оцифровка биологии, делающая работу исследователей похожей на работу программистов.
Содержание:
Биоинформатика: слияние дисциплин

Если говорить о современных представлениях, то биоинформатика – это междисциплинарная область, изучающая молекулярно-биологические данные. Сюда могут входить структуры белков и их взаимодействие с окружением, или последовательности геномов, а также их работа или, напротив, бездействие.
В общем, данных более чем достаточно, и всё это нужно хранить, структурировать, визуализировать и анализировать, а после делать доступные выводы, которые помогают в работе традиционным биологам, химикам, математикам, врачам и другим специалистам.
Примеры тем, которые затрагиваются:
-
Как развивается эмбрион на ранних стадиях;
-
Как работает конкретный вид белка;
-
Как активируется конкретный ген, и что регулирует его работу;
-
Как устроена клеточная организация в мышечных тканях;
-
Как ведёт себя популяция клеток с течением времени на примере компьютерной модели;
-
Как быстро делятся раковые клетки у конкретного человека.
Если сильно увлечься, то список может выйти размером с “Полную историю Средиземья” Толкина. И это будет лишь малой частью прикладной биоинформатики.

Первое использование термина “биоинформатика” можно датировать 1970 годом. Бен Хеспер и Полина Хогевег собирались провести исследование по изучению информационных процессов в биотических системах.

Учёные предположили, что важнейшее свойство жизни – это хранение, обработка и передача генетической информации.
А чтобы работать с огромными массивами биологических данных необходимы компьютеры. Всё как в IT. Сложно представить жизнь, которая не накапливала бы информацию в процессе эволюции, не передавала бы её своим потомкам, чтобы те успешно адаптировались к постоянно меняющимся условиям. Изучением этих процессов занимается эволюционная биология, которая тесно связана с биоинформатикой. Чем прогрессивнее методы изучения генетической информации, тем глубже в историю можно заглянуть. Так, реконструируя последовательности ДНК и РНК, в 2010 году удалось доказать предположение Дарвина, что всё живое на планете произошло от последнего универсального общего предка (LUCA).
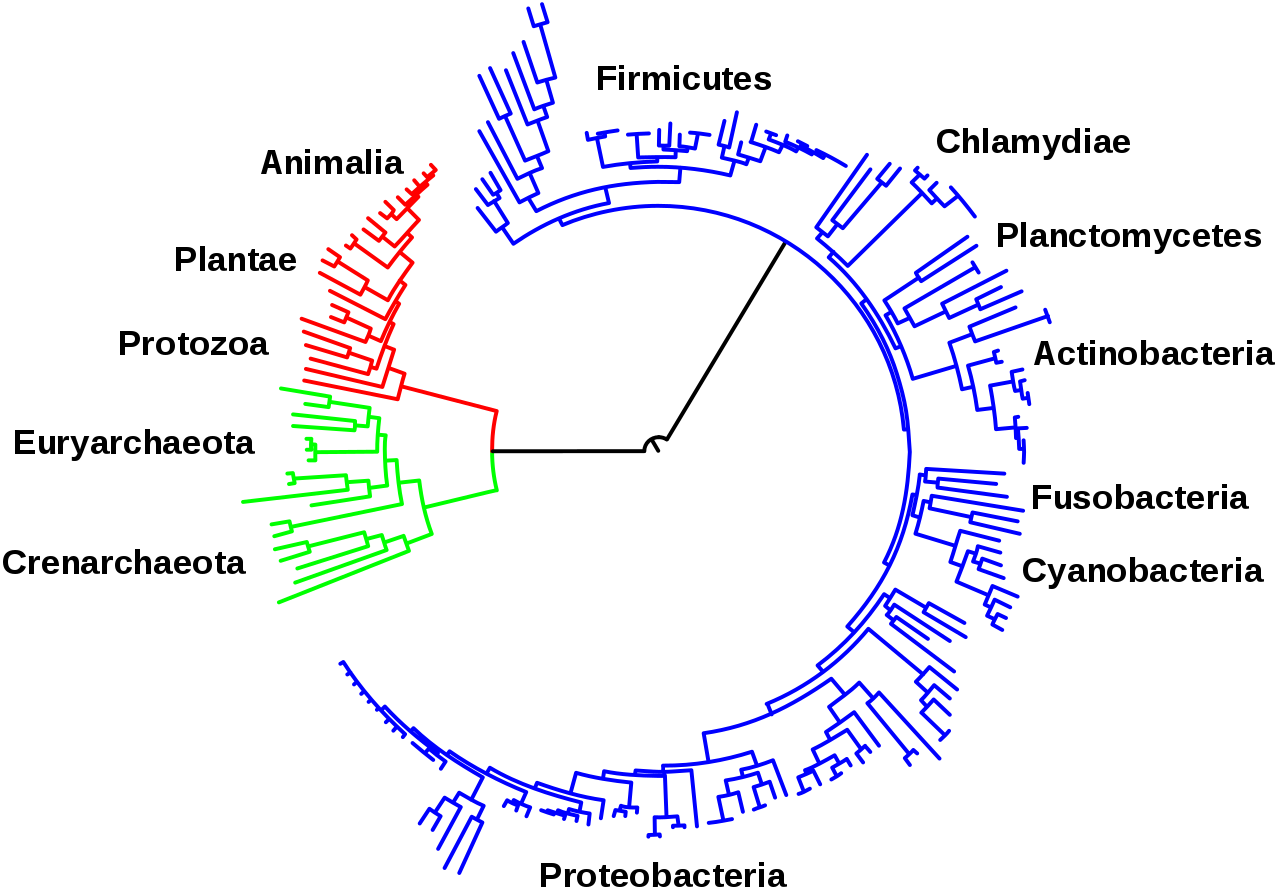
Чтобы определить, какие гены можно отнести к древнейшим – тем, что были у общего предка ещё до расхождения доменов, – биоинформатикам потребовалось обработать огромные массивы данных.
Например, чтобы найти гены, встречающиеся как минимум у двух крупных групп бактерий, и двух – архей, учёным пришлось проанализировать более 6,1 млн кодирующих белков генов из ДНК 1847 современных видов бактерий и 134 архей, объединив их в 258,5 тыс. семейств. Около 11 тыс. из них обнаруживаются у представителей обоих доменов жизни, однако лишь 355 демонстрируют структурную гомологию и имеются более чем у двух видов бактерий и архей.
Подобные расчёты (а также множество сопутствующих) возможны только на мощных вычислительных серверах и специальном софте.
Пример инфраструктуры для генетических исследований
Медицинская школа Стэнфордского университета создала Genetics Bioinformatics Service Center (GBSC) – это центр, созданный для облегчения крупномасштабной геномики.
Некоторые возможности и характеристики GBSC:
-
Локальный вычислительный кластер: 2800+ ядер и 7+ петабайт высокопроизводительного хранилища;
-
Установлено и готово к использованию более 700 пакетов программного обеспечения для биоинформатики;
-
«Биоинформатика как услуга (BaaS)»: консультации для получения практической помощи;
-
Анализ популярных типов данных NGS, таких как RNASeq, ChIPSeq, MethylSeq, Whole Genome / Whole Exome Seq, CancerSeq и Microbiome, а также анализ новых типов данных, таких как Hi-C и ATAC-Seq;
-
Google Cloud Gateway: для масштабируемых вычислений;
-
Локальный и облачный шлюз поддерживают передовые методы безопасности NIH dbGaP;
-
Локальная инфраструктура размещается в ЦОДах Стэнфорда, что обеспечивает аптайм > 99%.
И это даже не вершина айсберга. Впечатляет?
Как исследование генов помогает в борьбе с раком?
Чтобы понять, как бороться с раком, для начала нужно его изучить. Как пишет ВОЗ, рак – это общий термин для большой группы заболеваний. Поэтому универсальной таблетки от всех его видов ждать не стоит. На данный момент в лечении онкологических заболеваний делают упор на химиотерапию, гормональную терапию, иммунотерапию и прицельную (таргетную) терапию.
Наиболее перспективным методом кажется иммунотерапия, которая способна подтолкнуть естественные биологические процессы в нужное русло. Наш организм уже имеет механизмы для борьбы с раком, ему нужно лишь указать, где находится враг, и как не дать себя обмануть.
На таргетную терапию также возлагают большие надежды, так как она преимущественно нацелена на конкретные белки или ферменты, несущие мутации и другие генетические изменения. Это точечная борьба с раковыми клетками, чтобы минимизировать вред для здоровых клеток.
Интересный факт.
Первый таргетный препарат тамоксифен был создан в 1962 году британскими учёными под руководством биолога Артура Уолпола и химика Доры Ричардс. Тогда ещё не существовало понятия “таргетная терапия”. Изначально планировалось использовать тамоксифен для контроля над рождаемостью, однако в качестве контрацептива он оказался бесполезен. Зато и по сей день отлично помогает в лечении эстрогенально чувствительных форм рака молочной железы. Его эффективность достигает 70-80%.

– *Рак вышел из чата*.
Без биоинформатики невозможно представить создание баз данных ДНК отдельных людей. Помимо хранения и передачи информации её также необходимо обрабатывать, сравнивать и интерпретировать, чтобы использовать в терапии. И если многие заболевания можно изучить, а после применять отработанные методики в лечении, то рак нестабилен и больше напоминает синергетические системы.
Биоинформатика не только помогает в изучении ДНК, но и изучает механизмы белковых взаимодействий, используется в разработке препаратов, а также изучает онкогенез (зарождение рака) и многое другое.
Нейросети для работы с рентгеновскими снимками

Когда дело доходит до нейросетей, Big Data и других мегапопулярных словечек в масс-медиа, хочется закатить глаза и сказать: “Вы серьёзно?” Слишком много “белого” шума. Но, как ни странно, в последние годы получилось достигнуть реальных результатов с помощью биоинформатических методов работы с данными, например, софт Care Mentor AI. Это работающая сервисная платформа лучевой диагностики, использующая Data Mining и PACS (Picture Archiving and Communication System).
Data Mining – это методы поиска новых полезных знаний в массиве данных для практического применения.

PACS – это технология передачи и архивации DICOM изображений, использующая напрямую серверы, которые дают доступ к информации пользователям DICOM сети.
Если по-простому: человеку сделали МРТ, данные с томографа по протоколу DICOM передаются на PACS-серверы для хранения, передачи и дальнейшей обработки данных на других устройствах.

Компания Care Mentor AI в 2021 году зарегистрировала два медицинских IT-продукта с ИИ в Росздравнадзоре. Сейчас они совместно со “СберМедИИ” занимаются диджитализацией российского здравоохранения. Уже в этом году в России будут интегрироваться прогрессивные программные методы лучевой диагностики на базе ИИ.

Что это даёт на практике врачам и пациентам?
-
Значительно повышает эффективность лучевой диагностики в части расшифровки рентгенологических исследований флюорограмм и применяется для автоматизации диспансеризаций и повышенной нагрузки на специалистов.
-
Ускоряет анализ КТ-исследований, визуализируя патологически измененные области легких на аксиальных срезах нативного КТ-исследования, и c высокой точностью определяет процент и степень поражения легких.
-
Технологии быстро и точно диагностируют не только COVID-19 или злокачественные опухоли, но и туберкулёз, пневмонию, и другие патологии.
Оба продукта Care Mentor AI уже сейчас интегрированы в Московский Единый радиологический информационный сервис (ЕРИС) и работают с 400 медучреждениями в Москве. При этом существуют и развиваются программные продукты от других разработчиков, например, “Третье мнение” или решения от Botkin.AI.
На чём вся эта радость работает?

Поскольку биомедицинские данные обладают огромной размерностью, нужны вычислительные мощности с параллелизацией процессов. Поэтому компания Care Monitor AI для своих целей выбрала петафлопсный суперкомпьютер ZHORES.
В “Жоресе” информация между узлами передается через оптоволокно и полупроводниковые лазеры (на полупроводниковых гетероструктурах). Их открыл российский учёный Жорес Алфёров, за что получил в 2000 году Нобелевскую премию.
Некоторые характеристики суперкомпьютера ZHORES c сайта Skoltech на 27.05.2022:
-
Общее описание
Платформа: гибридного кластера;
Общее назначение: для исследований, требующих большого количества; гибридных вычислительных ресурсов: GPU и CPU;
-
Вычислительная часть
Вычислительные блейды:
Узлы CPU – 48;
Узлов MEM – 10;
Узлов GPU – 26;
Узлов виртуализации – 6;
Пиковая производительность – 1 Петафлопс;
104 графических процессора (Tesla V100-SXM2) с 16 ГБ памяти; -
Сеть
Сеть передачи данных: InfiniBand EDR (100 Гбит/с);
Сети обслуживания и управления: 1GbE; -
Система хранения данных
Параллельная файловая система хранения данных: GPFS 416T;
Домашний каталог: BeeGFS;
100T CephFS; -
ОС
CentOS Linux версии 7.9 (ядро 5.4.15); -
Менеджер рабочей нагрузки
Slurm 20;
Таким образом биоинформатика увеличивает точность и скорость диагностики, уменьшает влияние человеческого фактора, а также позволяет увеличить выживаемость пациентов благодаря раннему обнаружению опухолевых патологий.
Мы рассмотрели один из современных способов диагностировать рак с помощью ИИ, но как биоинформатика помогает бороться с обнаруженными онкологическими новообразованиями?
Борьба с раком – гонка вооружений

Прежде чем мы начнём говорить о новых методах в лечении рака, разработанных с помощью биоинформатики, давайте посмотрим, что там по цифрам на сайте ВОЗ.
Рак является одной из основных причин смерти в мире. Так, в 2020 г. от этого заболевания умерли почти 10 миллионов человек. В 2020 г. наиболее распространенными видами рака (с точки зрения количества новых случаев рака) были следующие:
-
Рак молочной железы (2,26 миллиона случаев);
-
Рак легких (2,21 миллиона случаев);
-
Рак толстой и прямой кишки (1,93 миллиона случаев);
-
Рак предстательной железы (1,41 миллиона случаев);
-
Рак кожи (немеланомный) (1,20 миллиона случаев);
-
Рак желудка (1,09 миллиона случаев).
Наиболее часто в 2020 г. смерть наступала от следующих видов рака:
-
Рак легких (1,80 миллиона случаев смерти);
-
Рак толстой и прямой кишки (935 000 случаев смерти);
-
Рак печени (830 000 случаев смерти);
-
Рак желудка (769 000 случаев смерти);
-
Рак молочной железы (685 000 случаев смерти).
Ну а теперь пристёгиваем ремни и отправляемся в путешествие.
Биологический блицкриг — рак атакует
Первый молниеносный ход в этом противостоянии делает рак. Он поражает некогда нормальную клетку поэтапно. Первопричина – это сбой в генах из-за мутации. Клетка начинает неконтролируемо делиться, а механизмы (апоптоз), которые должны сработать и уничтожить клетку, блокируются.
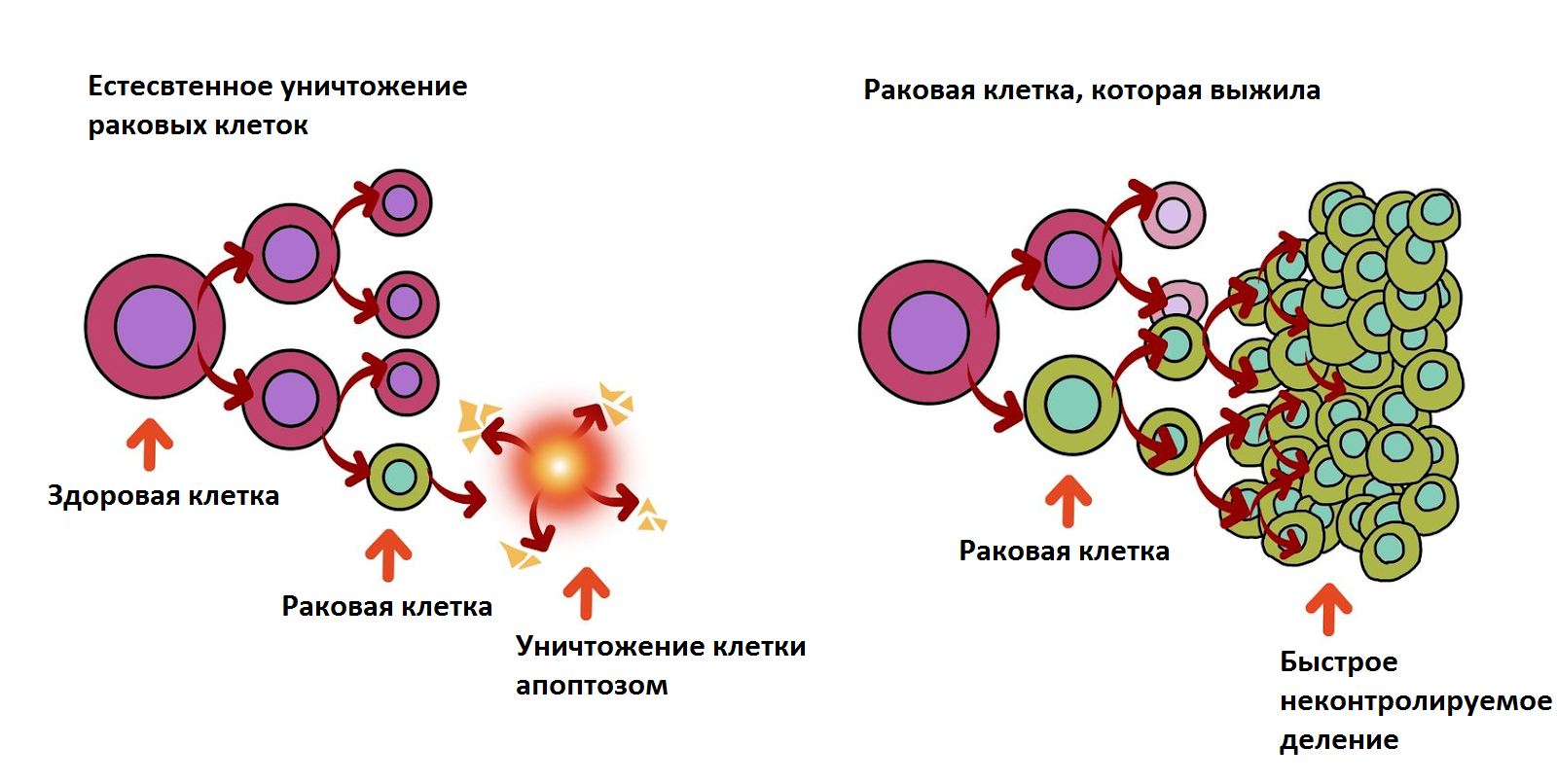
Иммунной системе раковые клетки подают сигналы, что у них на вечеринке всё отлично: “Мы тут не пытаемся вырасти в чудовище – никакого неконтролируемого роста, просто заживляем ранку”.
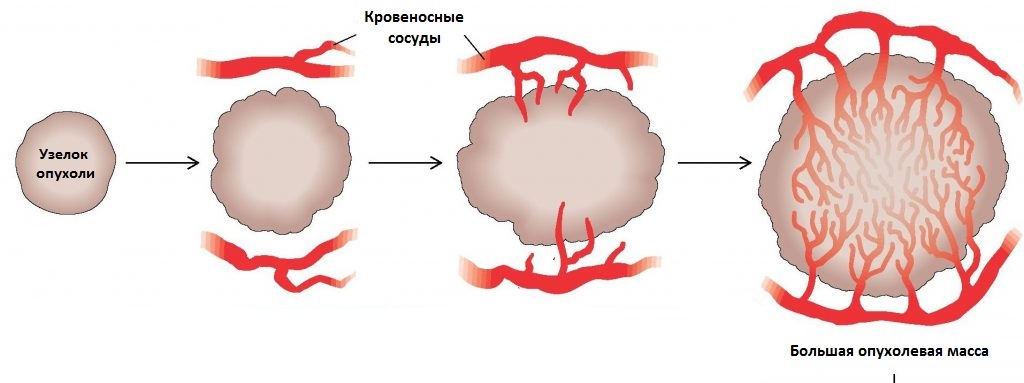
Поскольку рост протекает стремительно, опухоли требуется много питательных веществ и она эксплуатирует ангиогенез по максимуму. “Подключившись” к кровеносной системе, опухоль потребляет очень много питательных веществ, забирая еду у здоровых тканей.
Еще одна хитрость, к которой прибегает большинство раковых клеток – это удлинение теломер с помощью теломеразы. Нормальная клетка каждый раз после деления укорачивает концевые участки хромосом – так она состаривается и в конце теряет способность делиться. Среднестатистическая клетка делится около 50-70 раз, прежде чем умирает. Но раковая клетка этот механизм обходит и становится бессмертной (например, HeLa).

И вот у нас есть клетки, которые обхитрили иммунную систему, быстро, неконтролируемо и бесконечно делятся, кушают много и вкусно, а также не умирают от апоптоза. Что ещё нужно для счастья? Конечно же путешествия.
По новым кровеносным каналам, которые создала опухоль, раковые клетки начинают метастазировать. Словно подростки, окончившие школу, они хотят повидать мир организм и перестают воспринимать клеточное окружение как постоянную среду своего обитания. Поэтому они отрываются от родительской опухоли и колесят по кровеносной системе, порождая новые очаги рака. Как утверждает ВОЗ, именно метастазы являются основной причиной смерти от рака.

Лучшая защита – нападение: некоторые приёмы медицины и биоинформатики
Не хочешь умирать? Заставим!
Большинство клеток не живёт в течение всей жизни многоклеточного организма. Да, есть нейроны, которые формируются в младенчестве, а потом теряют способность делиться, и многие из них доживают с нами до конца. Однако остальные клетки запрограммированы умереть намного раньше. Сам процесс смерти очень сложен и упорядочен, так как клетка должна умереть “интеллигентно”: не просто уничтожиться и распасться, а сделать это так, чтобы продукты распада не навредили окружающим клеткам. Поэтому в организме существуют специальные белки, с помощью которых клетка сама себя аккуратно убивает.

Этот процесс называется программируемой клеточной гибелью. Например, апоптоз.
Классическим примером апоптоза считается исчезновение хвоста у головастика. Он не испаряется в никуда. Клетки, образующие хвост, начинают в нужный момент массово умирать.

– Молодой человек, у вас ещё хвост не рассосался.
Другой вариант смерти клетки – некроз, при котором клетка набухает, лопается, ферменты разрушают окружение, начинается воспаление. Зрелищно, но жутко вредно для организма.
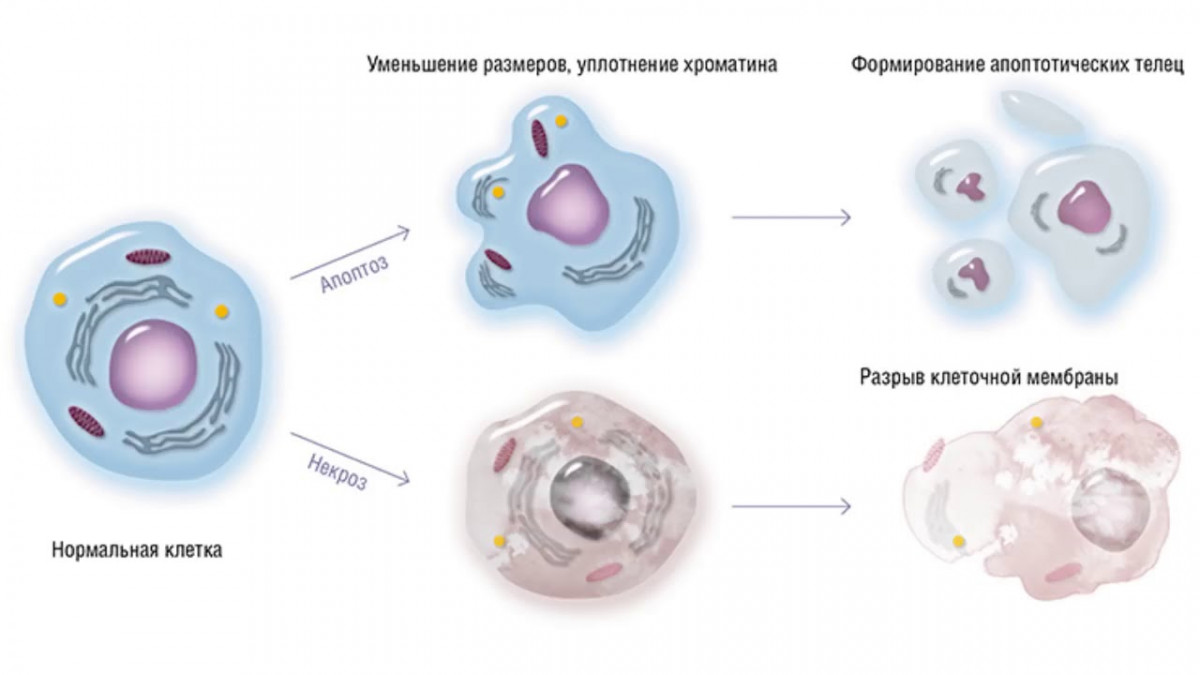
Сильно упрощенное описание апоптоза:
-
Сигнальная фаза.
Клетка получает сигнал (внешний или внутренний), что необходимо запустить самоуничтожение.
-
Эффекторная фаза.
Это активный процесс, когда сигнал переходит в действие. В ядре происходит компактизация хроматина, после чего клетка уменьшается в размере и внутри неё всё разрушается на фрагменты.
-
Деградационная фаза
На последнем этапе апоптоза клетка разделяется на отдельные тельца со своей оболочкой, которые приблизительно за полтора часа захватываются и перевариваются макрофагами или другими клетками. Тихо, аккуратно и без воспалений.
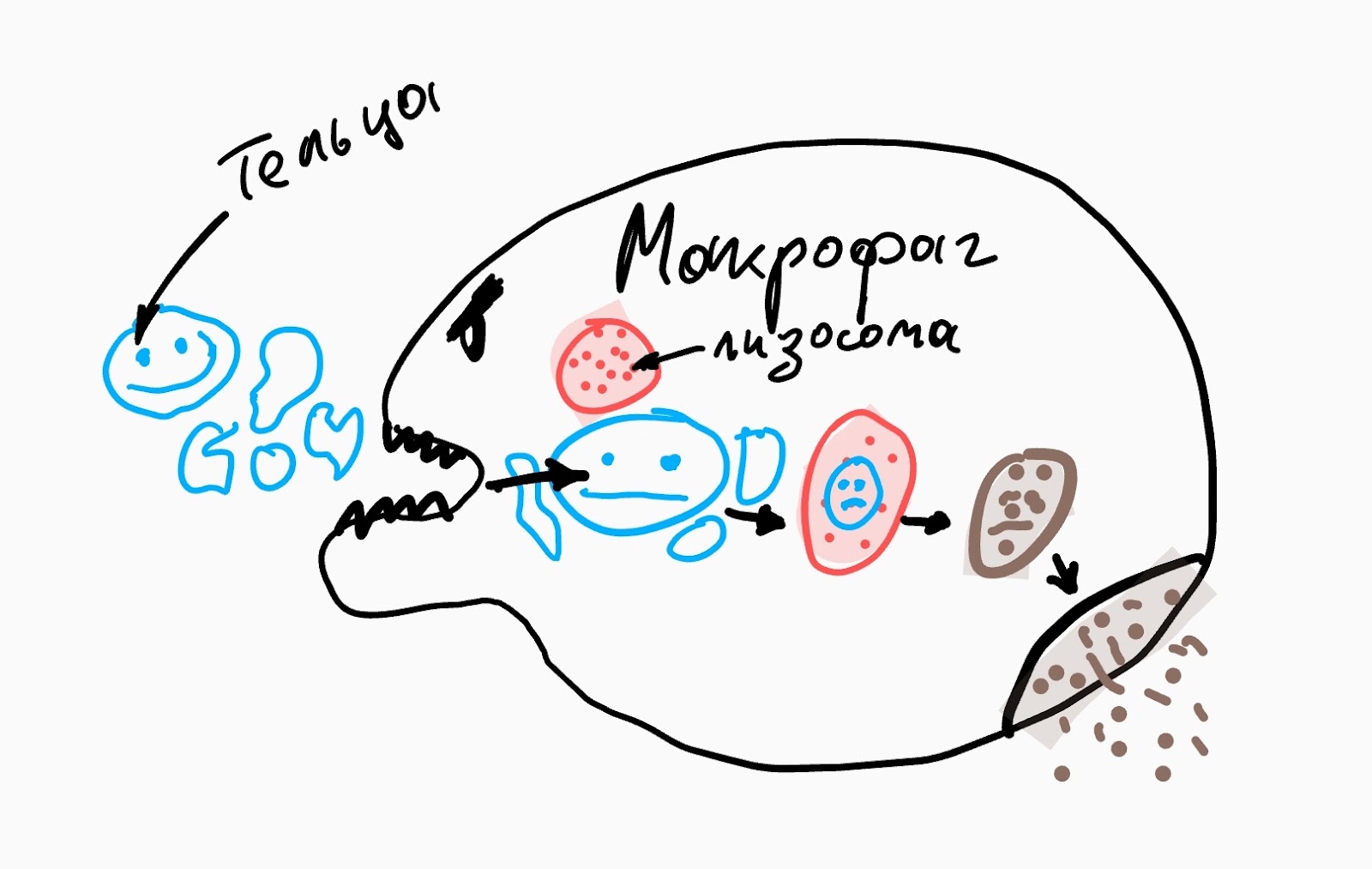
Как правило, от начала сигнальной фазы до окончательной фрагментации клеток требуется несколько часов. Однако необходимое время зависит от типа клетки, стимула и пути апоптоза.
Почему апоптоз важен для клетки?
Иногда клетка состаривается и приходит её время, а иногда в клетке происходят нежелательные процессы, например, проник вирус. Тогда клетка стремится умереть сама. Вирус же пытается сломать механизм апоптоза, чтобы не умереть в ней, а размножиться и распространиться на другие клетки. Поэтому, когда мы болеем простудой – это в том числе результат неудавшегося апоптоза.
Популярное представление о раке – это сломавшийся механизм деления клеток. Да, при онкологии у клеток действительно наблюдается избыточное деление, что приводит к быстрому росту опухолей, однако другая сторона медали – это неработающий апоптоз. Именно поломка генов, отвечающих за программируемую клеточную гибель, является одной из основных причин онкологических заболеваний.
Активация апоптоза

Очевидно, что запуск апоптоза – это идеальный сценарий разрушения опухоли. Так как раковая клетка произошла от обычной клетки, то механизм апоптоза в ней изначально заложен, а потому существуют противораковые препараты, способные его запустить.
К сожалению, раковые клетки эффективно подавляют апоптоз. Так, дефекты гена-супрессора опухолей р53 (ген для профилактики мутации клетки в раковую) связаны с более чем 50% раковых заболеваний человека. Но исследования в этой области продолжаются. Новые стратегии лечения, направленные на апоптоз, осуществимы и могут быть использованы при лечении различных типов рака. Некоторые из этих открытий носят доклинический характер, а другие уже прошли клинические испытания.
Основная проблема – активация апоптоза исключительно в раковых клетках, не затрагивая нормальные. Для этого необходимы научно обоснованные долгосрочные наблюдения за пациентами. Чем больше информации собирают исследователи апоптоза, тем больше работы у биоинформатиков. Они воспроизводят опыты и работают с данными, которые невозможно обработать вручную, ускоряя и удешевляя разработку препаратов. Например, во многих фармакологических компаниях есть целые отделы биоинформатиков – департаменты вычислительной биологии.

Эффективность в цифрах (на примере использования пембролизумаба в качестве адъювантной терапии меланомы III стадии после хирургического лечения):

-
Согласно результатам наблюдения на протяжении 3,5 лет, адъювантная терапия пембролизумабом обеспечивает снижение риска развития отдалённых метастазов или смерти на 40 % по сравнению с плацебо;
-
Выживаемость без отдаленных метастазов через 3,5 года составила 65,3 %;
-
Безрецидивной выживаемость (БРВ) – 59,8%.

С точки зрения маскировки раковая клетка – это волк в овечьей шкуре. Все считают его своим парнем, знают его родственников, некоторые даже общаются с ним. Однако это не более чем удачный обман. Чтобы эффективно скрываться, раковые клетки пытаются скрыть молекулы-антигены, по которым иммунная система может вычислить чужаков.
Как это происходит? Когда в клетках возникают нежелательные мутации, она приносит себя в жертву, активируя апоптоз. Однако, как мы выяснили, активация апоптоза в раковых клетках нарушена. Поэтому, активно разрастаясь, опухоль накапливает в себе множество других мутаций, некоторые из них маскируют раковые клетки от иммунитета и препаратов. Чтобы решить эту проблему, разработали адоптивную иммунотерапию (не путать с адаптивной).
Адоптивная иммунотерапия – школа для биологических киллеров
У каждого из нас есть лимфоциты – ключевые ребята в работе иммунитета. Они бывают нескольких видов: B-клетки, NK-клетки и T-клетки, они же T-киллеры.

Суть адоптивной иммунотерапии (от англ. adoptive — приёмный) заключается в обучении Т-лимфоцитов убивать раковые клетки. В целом в нашем организме уже есть Т-клетки, которые борются с раком, однако рак зачастую очень хитёр и находится в другой весовой категории.
Сложности возникают из-за разнообразия белков в организме человека – их десятки тысяч. Если выбирать жертву недостаточно тщательно, то T-киллеры могут убить нормальные клетки. Если сместить баланс в другую сторону, то болезни с радостью организуют вечеринку в городе без полиции. Поэтому есть механизмы идентификации врагов – некие триггерные системы проверки из белков.
Когда лимфоциты выбирают, кого убивать, раковые клетки для них максимально похожи на здоровые, так как мутировали из них и успешно маскируются. Если цель обозначить неправильно, то организм покалечит или убьет сам себя. Так происходит с аутоиммунными заболеваниями, когда лимфоциты начинают воевать не в ту сторону.
Ключевые преимущества адоптивной иммунотерапии:
-
Приводит к улучшению качества жизни онкологического пациента;
-
Может быть сопроводительным лечением и дополнять стандартную или комбинированную терапию, но может применяться и как самостоятельное лечение;
-
Позволяет улучшить переносимость стандартной химиотерапии и повышает ее эффективность;
-
До хирургического лечения может способствовать более гладкому течению послеоперационного периода;
-
После радикального хирургического лечения улучшает переносимость химиолучевой терапии;
-
Возможно на всех этапах лечения онкологического пациента при любой форме рака;
-
Эффективна даже в случае диссеминированного процесса (метастатическая болезнь, 3-4 стадии заболевания);
-
Не имеет противопоказаний и может применяться в параллели со стандартным лечением.
В основе адоптивной иммунотерапии лежит обучение клеток способам отличать раковые клетки от нормальных и атаковать их. На изображении ниже показана учебка для Т-киллеров.

Другой подход – адоптивный перенос естественных Т-киллеров от здорового донора. Преимущество такого подхода — отсутствие реакции «трансплантат против хозяина». Недостаток — нарушение работы трансплантированных клеток.
Рассмотрим фазы адоптивной иммунотерапии на примере CAR-T-19:
-
Аферез.
Во время пребывания пациента в стационаре с помощью системы экстракции (лейкаферез) из крови извлекают белые кровяные шарики, в том числе T-клетки. Эти клетки направляются на модификацию и последующую криоконсервацию.
-
Клеточное перепрограммирование.
Клетки (T-лимфоциты) проходят генетическую модификацию с целью распознавания раковых клеток, а также других клеток, экспрессирующих специфический антиген, который нужно разрушить. Этот процесс осуществляется в Барселоне, других центрах Европы и США.
-
Размножение.
Модифицированные T-клетки размножаются, замораживаются и отправляются в госпиталь, где находится пациент, после прохождения строгого процесса контроля качества.
-
Подготовка пациента.
Пациенту проводится предварительная химиотерапия, чтобы предупредить возможное отторжение организмом и способствовать сохранению и пролиферации CAR-T-клеток. Конечная цель заключается в помощи организму принять перепрограммированные CAR-T-клетки.
-
Инфузия.
Модифицированные T-клетки вводятся посредством внутривенной инфузии, подобно переливанию крови.
-
Атака клеток.
Если лечение работает так, как запланировано, после попадания в кровь пациента концентрат CAR-T-клеток атакует B-клетки и начинает уничтожение раковых антигенов.
-
Мониторинг
У 30-40% пациентов, получивших данное лечение, возможны нежелательные эффекты. В некоторых случаях они не являются тяжелыми, но иногда требуют наблюдения в отделении интенсивной терапии, где есть все условия для лечения специфических симптомов.
-
Наблюдение и результаты.
Результаты, уже опубликованные в научных журналах, свидетельствуют о том, что более чем у 80% детей и подростков, получивших эту новую терапию, наступила фаза ремиссии в первые три месяца после лечения.
Эффективность в цифрах (по данным работающего педиатрического госпиталя Сант Жуан де Деу Барселона):
-
Ответ на лечение методом CAR-T-19 был получен в 80% случаев.
-
Выздоровление более чем у 50% пациентов за полтора года лечения.
Также за исследования в этой области 70-летний Джеймс Эллисон (США) и 76-летний Тасуку Хондзё (Япония) получили Нобелевскую премию по медицине в 2018.
Клеточная мембрана – коллаборационист
В течение миллиардов лет клетки эволюционировали, чтобы защитить себя от враждебной окружающей среды. Так появилась мембрана – некий щит из белков и двойного слоя липидов, который обеспечивает целостность клетки. Однако клетке нужно не только защищаться от окружающей среды, но и питаться из неё, а также выкидывать продукты обмена. Для этого на мембране есть белки-переносчики.
Если проводить аналогию с квартирой, то мембрана – это пол, потолок и стены, а белки-переносчики – это дверь, через которую мы заносим продукты, а потом выносим мусор. Если у вас не жилой дом, а большой склад, то нужно много дверей, чтобы обеспечить отправку и приём товаров без простоев. Поэтому, когда развивается опухоль (склад), ей требуется как можно больше белков-переносчиков (дверей), чтобы удовлетворить свой ненасытный аппетит.
Во многих опухолях наблюдается увеличение белков-переносчиков глюкозы GLUT1, так как глюкоза – отличное питание для клеток. Все любят тортики. Казалось бы, почему просто не заблокировать GLUT1, чтобы опухоль погибла от голода?

Представьте, что организм – это многоквартирный дом, органы – это парадные, а клетки – это квартиры. Допустим, в квартире №300’000’000’042 (столько в среднем клеток в человеческой печени) круглосуточно происходят вечеринки. Играет Nirvana, на лестничной клетке то и дело ведутся разговоры о высоком, курьеры доставляют пиццу и напитки. Всё хорошо, но соседям не очень нравится. Тогда недовольной бабуле приходит идея перекрыть дверь в парадную, чтобы прекратить это безобразие.
Вечеринка быстро заканчивается вместе с едой и выпивкой, однако и добропорядочные жильцы больше не получают продукты. Дверь-то общая. Курьер с едой (глюкоза) будет пытаться доставить еду, но безуспешно. Тоже самое случится и с клетками: помимо раковых без питания пострадают и здоровые. А они лишними не будут.
Адресная доставка

Клеточная мембрана надёжно защищает клетку от внешней среды, но так как раковая клетка произошла от обычной, она унаследовала не только защиту, но и механизмы питания.
Чтобы уменьшить вред для здоровых клеток и воздействовать преимущественно на раковые, были разработаны методы доставки лекарств напрямую к опухолевым тканям и клеткам. Так, белки-переносчики превращаются в надёжных союзников. Например, белок SLC22A1 переносит через клеточную мембрану противоопухолевый препарат иматиниб, который вызывает апоптоз, что значительно увеличивает эффективность лечения миелоидного лейкоза.
Возвращаясь к аналогии с домом. Когда соседи регулярно шумят по ночам, то лучше вызвать полицию. Если у соседей прорвало трубу, то аварийную службу, если случился пожар, то пожарную бригаду и т.д.
Поэтому исследователи ищут способ, как использовать белки-переносчики для своих нужд, а не оставлять радиоактивный пепел после лечения. Например, в 2020 году адресный препарат от рака печени по этому принципу разработали учёные МГУ.
Что об этом сказала доктор химических наук, профессор кафедры органической химии в МГУ Елена Белоглазкина: “«Помощник» доставляет противоопухолевые препараты прямо к клеткам печени через псиалогликопротеиновый рецептор – одну из наиболее удобных мишеней для адресной доставки лекарственных агентов в клетку. Тем самым он позволяет существенно уменьшить вводимую пациенту дозу токсичного противоракового препарата, за счет того, что лекарство попадает только в опухолевые клетки, минуя здоровые”.
Эффективность в цифрах (на примере иматиниба):
-
Высокая биодоступность препарата при приёме внутрь – 98%. Этот параметр показывает, сколько лекарственного вещества дошло до места его действия в организме.
-
Терапия иматинибом обеспечивает высокую общую пятилетнюю выживаемость больных в поздней хронической фазе – 90,6%.
А как было до появления компьютеров и биоинформатики?

О существовании рака знали ещё до нашей эры. В древнеегипетском папирусе (ок. 1600 г. до н. э.) описаны случаи опухолей молочной железы, а также говорится, что вылечиться от этой болезни нельзя.
Попытки удаления опухоли хирургическим методом приводили к возвращению опухоли, так как раковые ткани при повреждении попадали в кровоток и метастазировали.
Так продолжалось вплоть до XIX-XX веков, пока хирургия не сделала скачок. Помимо самой опухоли стали удалять ткань вокруг, чтобы не допустить метастазирование рака.
Дальнейшим толчком для развития послужило изучение клеток с помощью новейших микроскопов. Только в 1950-х годах Сидни Фарбер разработал первые химиотерапевтические методы лечения некоторых видов рака.

В следующие десятилетия появился доксорубицин – антибиотик, нарушающий работу ДНК клеток, а также молекулярные лекарства, действующие на определённые типы рака. Но токсичность этих препаратов вызывала серьезные осложнения у пациентов.
Если подытожить, хирургический метод лечения был основным. В наши дни его также используют, но врачи пытаются не только избавиться от опухоли, но и сохранить как можно больше ткани. Поэтому биоинформатика нацелена в первую очередь на изучение первопричин рака, и только потом на борьбу с его последствиями.
Будущее биоинформатики в лечении рака и выводы

В 2000 году Билл Клинтон и Тони Блэр объявили, что глобальный научно-исследовательский проект по расшифровке генома человека выходит на финишную прямую и уже готовы черновые результаты. С этого момента в науке началась так называемая “постгеномная эра”. Полный геном был опубликован в 2003 году, но некоторые участки ДНК требуют дополнительного анализа и сегодня.
На сегодняшний день, интерпретирование полученных данных находится де-факто на начальной стадии. Достоверно удалось установить, что ДНК определяет, как клетка будет жить и функционировать. Поэтому исследования в этой области уже меняют подходы медицины в лечении людей. Врач, изучая определённую форму рака, может зайти в базы данных человеческого генома и досконально исследовать конкретный ген.

Если посмотреть на результаты, которых удалось достичь c 2003 года, то получается, что исследователи и врачи узнали, не меньше, чем за все предыдущие годы. Чтобы сделать полногеномное секвенирование в 2022 году не требуется объединения ученых со всего мира и миллиардов долларов. В России этот анализ можно сделать приблизительно за 100 тысяч рублей вместе с биоинформатической обработкой и заключением врача-генетика.

Если посмотреть на скорость развития вычислительной техники и софта, тенденции и методы секвенирования нового поколения, то можно утверждать, что секвенирование будет и дальше удешевляться и ускоряться. Возможно, в относительно недалёком будущем анализ станет доступен всем и будет проходить мгновенно на приёме у врача или в домашних условиях. Всё это позволит проводить диагностику и индивидуальную лекарственную терапию онкобольных в кратчайшие сроки и за доступные деньги.
Но до полного понимания рака и уверенного лечения всех его видов с высокой 5-летней выживаемостью ещё очень далеко. Медицине предстоит долгий путь, а на передовой будет биоинформатика — в этом нет никаких сомнений.


