Некоторое время назад, когда «все переквалифицировались в вирусологов» и костерили вакцину «Спутник-V», на Хабре всплыла острая тема «этичности» и «поспешности» клинических исследований в медицине. Тогда же в довольно интересных статьях, например, здесь и здесь, всплывала тень талидомида – одного из самых жутких фармацевтических просчётов XX века. Тем не менее, подробной статьи о талидомиде на Хабре я пока не нашёл (возможно, потому, что статьи на Хабре принято иллюстрировать). Сегодня хотелось бы кратко рассказать об этом препарате, а также – о его трудном и грозном возрождении, случившемся в последние 10 лет.
К середине XX века в развитых странах разразилась настоящая эпидемия злоупотребления барбитуратами. Барбитураты применялись в качестве успокоительных и снотворных, при этом быстро вызывали привыкание. Наиболее известный препарат такого класса, веронал, был назван в честь Вероны (города, в котором разворачивается трагедия Ромео и Джульетты). Веронал не составляло труда приобрести в аптеке. Cреди известных жертв веронала – Акутагава Рюноскэ (1927) и Стефан Цвейг с женой (1942). Широко известна также зависимость от барбитуратов (барбитуризм), приводящая к отмиранию нейронов головного мозга и умственной деградации. К началу 1950-х активные поиски безвредного снотворного и успокоительного привели немецких фармацевтов из компании Хеми-Грюненталь к созданию талидомида, синтезированного в 1954 году. В 1956 году он был лицензирован в ФРГ, а позже в Великобритании в качестве безрецептурного седативного и транквилизатора. Но препарат оказался настолько модным, что его также назначали при пневмонии, простуде и гриппе. Также выяснилось, что талидомид облегчает симптомы токсикоза на ранних сроках беременности.
Под катом всё-таки не обойтись без иллюстраций. Спойлеров не будет.
Преступление
Талидомид оказался крайне тератогенным и губительным для эмбриона на самых ранних сроках беременности. Нельзя сказать, что в «Грюненталь-Хеми» пренебрегли токсикологическими исследованиями – их исправно провели на мышах и ничего подозрительного не выявили. В 1955 году пробные партии были бесплатно распространены в медицинских учреждениях ФРГ и Швейцарии, а в октябре 1957 года талидомид поступил в продажу в ФРГ. Уже к 1959 году талидомид под разными торговыми марками продавался в 46 странах. В период с 1957 по 1959 год поступали жалобы на то, что талидомид вызывает периферическую нейропатию, а также парестезию (ощущение покалывания иголками). Но эти сообщения продолжали игнорироваться. Позже применение талидомида начали связывать с невынашиваемостью плода, но систематически эти подозрения не проверялись. Более того, талидомид (в Великобритании – Distaval, в ФРГ — Contergan) воспринимали как панацею от общего недомогания. В 1958 году компания-производитель заявила, что «талидомид – лучшее успокоительное для беременных и кормящих матерей».
Но наряду со сведениями о невынашиваемости и мертворождениях накапливался корпус ещё более жутких фактов, явственно свидетельствующих, что препарат, вероятно, вызывает уродства плода.
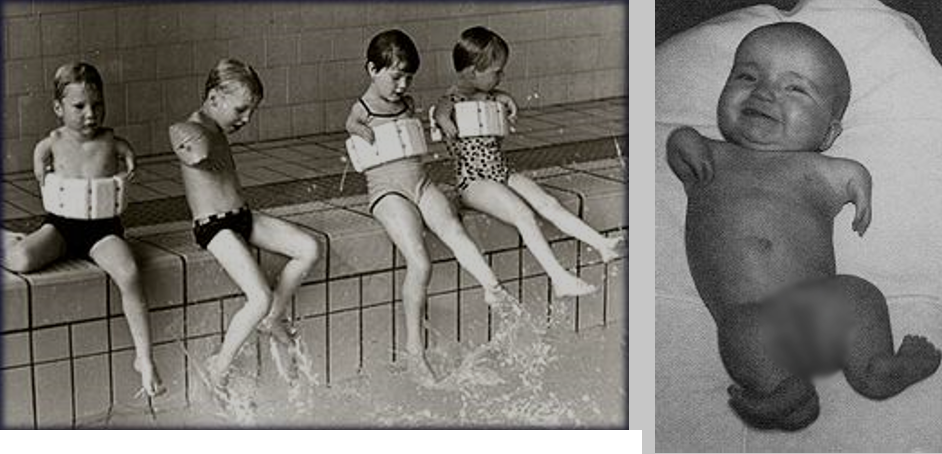
У детей, испытавших влияние талидомида на ранних стадиях эмбрионального развития, не развивались конечности, а также возникали тяжёлые поражения мозга, могли не сформироваться глаза или уши. Производитель препятствовал расследованию накапливающихся случаев и продолжал раздавать талидомид бесплатно в качестве пробных партий. В 1960 году его пытались лицензировать в США. Выгодополучателем в данном случае выступала компания «William S. Merrell Company», представителям которой было известно, что в 1959-1960 годах среди американских врачей бесплатно распространили 2,5 миллиона доз талидомида. Эти таблетки были назначены примерно 20 000 пациентам, среди которых было более 200 беременных женщин. В США не обошлось без талидомидных уродств – известно 17 американских младенцев, родившихся с такими патологиями. Лицензировать препарат не позволила чиновник Френсис Келси, только в 1960 году поступившая на работу в FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов). .

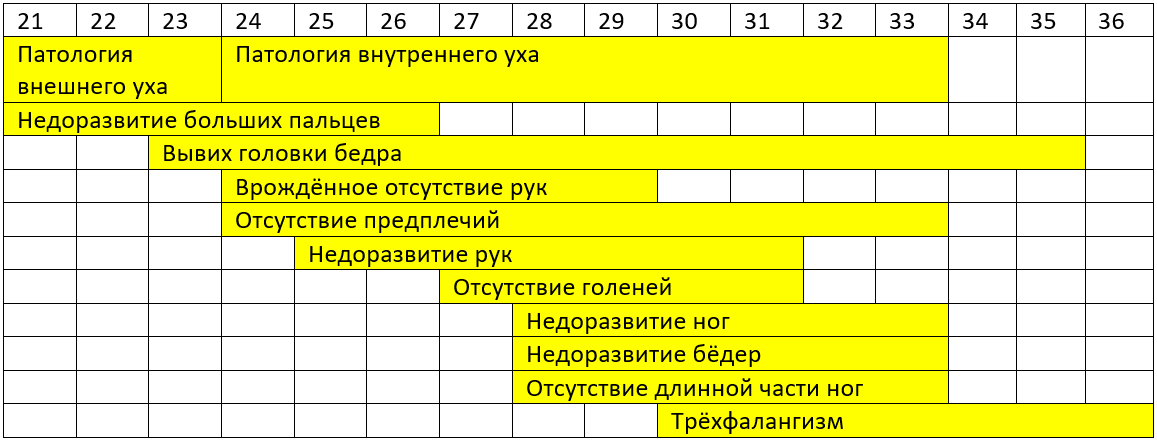
С 1942 года она участвовала в разработке синтетического препарата от малярии и именно тогда узнала, что некоторые лекарства могут проникать сквозь плаценту. Проект по лицензированию талидомида был её первым серьёзным проектом в агентстве FDA, но она проявила принципиальность и до начала 1961 года тянула с выдачей лицензии. Тем временем она собирала сведения о тератологии новорождённых и настояла на проведении дополнительных клинических исследований. Эти исследования показали, что тяжёлые уродства наблюдаются примерно у каждого пятого младенца, чьи матери принимали талидомид на ранних сроках беременности (20-36 дней после зачатия). Сегодня уже известна точная хронология возникновения костно-мышечных и хрящевых патологий:
В конце 1961 года в Ахене началось судебное разбирательство против производителя талидомида, а в 1962 году препарат был повсеместно запрещён. Только в 1968 году вина «Грюненталь-Хеми» была полностью доказана, и компания отделалась компенсацией в 100 миллионов немецких марок, перечисленных детям, оставшимся инвалидами из-за талидомида. В период с 1957 по 1962 год в Европе родилось около 10 000 таких детей (пессимистичная оценка – 12 000), а также более 300 детей в Японии.
Впрочем, на этом история талидомида не закончилась. Но, чтобы полнее осознать вторую часть этой истории, давайте подробно остановимся на химическом составе талидомида и механизме его воздействия.
Химия


Талидомид – белый кристаллический порошок, плохо растворимый в воде. Существует в виде двух показанных вариантов (энантиомеров), которые легко преобразуются друг в друга при уровне pH, свойственном человеческому организму. Левый вариант оказывает седативное воздействие, а правый – тератогенное..
Сегодня тератогенное воздействие талидомида не вызывает никаких сомнений; оно проверено и подтверждено на обезьянах, кроликах, броненосцах, шпорцевых лягушках, сумчатых, хомяках, курах, аквариумных и морских рыбах, кишечнополостных. По-видимому, в вышеприведённое окно достаточно всего 50 мг талидомида, чтобы вызвать пороки развития у 50% эмбрионов.
Итак, молекула талидомида состоит из двух слабо связанных частей – двойного фталимидного кольца и одиночного глутаримидного кольца. Углеродные связи в талидомиде резко отличаются по свойствам в зависимости от хиральности. Превращение энантиомеров талидомида друг в друга происходит спонтанно, поэтому невозможно добиться, чтобы в организме существовали только безвредные молекулы талидомида. Период полувыведения талидомида, по-видимому, составляет 8-12 часов, а продукты его распада являются тератогенными, как и базовая молекула.
Принцип действия большинства препаратов заключается в специфичном связывании препарата с активным сайтом целевого белка. Однако топография многих белков слишком сложна, и активный сайт (через который белок можно деактивировать или перенастроить) сложно даже найти, не то, что связаться с ним. Среди белков с таким сложным рельефом много таких, деактивация которых представляет большой терапевтический интерес, поскольку тормозит развитие рака и других тяжёлых заболеваний.
Выяснилось, что талидомид принципиально отличается от большинства лекарств по принципу действия. Он представляет собой первое известное вещество из числа «молекулярных клеев» — склеивает вместе два белка, которые в обычных условиях не стали бы взаимодействовать. В результате обе белковые молекулы выходят из строя. Так, талидомид провоцирует слипание белка-лигазы цереблона (CRBN) с белками из семейства IKAROS, относящимися к так называемым цинковым пальцам (координирующим и скрепляющим белкам). Белки IKAROS являются факторами транскрипции другого белка, FGF8, дефицит которого вызывает именно те пороки развития, которые характерны для талидомидных детей. Более того, талидомид катализирует другой патологический процесс – обрастание белков IKAROS убиквитиновыми цепочками, а эти цепочки служат маркером для протеаз – ферментов, разлагающих белки. Поэтому содержание белков IKAROS у эмбриона падает ещё сильнее.
Разрушительное действие талидомида тормозит рост тканей (и органов), а также не даёт разрастаться и ветвиться кровеносным сосудам. Но нормальное образование кровеносных сосудов (ангиогенез) – важнейший фактор нормального эмбрионального развития. В эмбриогенезе кровеносные сосуды постоянно ветвятся и проникают во все области растущего тела, а уже вдоль сосудов вырастает гладкая мускулатура и более плотные ткани, обволакивающие и стабилизирующие сосуды. Обратная сторона этого процесса, вероятно, уже очевидна, но я подробнее вернусь к ней ниже.
Талидомид оказался первым веществом из целого класса молекулярных клеев. Поэтому доработка талидомида могла бы привести к созданию более эффективных и менее тератогенных аналогов. Как ни странно, возвращение талидомида в медицинскую практику произошло ещё до окончания судебного процесса над «Хеми-Грюненталь», а именно в 1964 году.
Возрождение: проказа и миелома
После 1962 года в медицинских учреждениях капиталистического мира остались большие запасы талидомида, который, по-видимому, не уничтожали. Седативное и обезболивающее воздействие талидомида бесспорно, и в 1964 году именно в качестве успокоительного талидомид применил Яков Шескин из больницы «Хадасса» в Иерусалиме. Он дал талидомид в качестве снотворного и успокоительного больному проказой – и человек, мучившийся от боли, смог заснуть. Шескин с удивлением обнаружил, что язвы от проказы у этого пациента начали заживать, и вылечил его талидомидом.
Проказа остаётся распространённой в Южной Америке. Шескин выбил разрешение на клиническое исследование талидомида в Венесуэле. В 1968 году он провёл такое исследование на 173 больных проказой, и 92% из них полностью излечились. В настоящее время талидомид остаётся основным средством лечения проказы в Южной Америке и имеется там в свободном доступе. Это ожидаемо привело к появлению нового поколения талидомидных младенцев в 2005-2013 годах.

Проказа требует срочного лечения, и молодые женщины, заразившиеся проказой и получающие талидомид, зачастую даже не знают, что в этот момент уже беременны. Лечение попадает на критический период с 21 до 36 дня. В Бразилии фиксируется до 30 000 случаев проказы в год. При этом, по оценке Федерального университета Риу-Гранде ду Сул в Порту-Алегри, в период с 2005 по 2012 год в Бразилии родилось порядка 100 талидомидных детей. В Бразилии применение талидомида воспринимается как адекватная мера и необходимость. В 1998 году талидомид одобрен и в США (на уровне FDA) как средство от проказы.
Проникновение талидомида в онкологическую практику началось значительно позже. В 1992-1994 годах профессор Гарвардского университета Роберто д’Амато (офтальмолог по специальности) впервые предположил, что талидомид может препятствовать росту кровеносных сосудов. Он проводил опыты на цыплятах и кроликах, добившись не самых убедительных результатов. Но его разработки в 1997 году заинтересовали онколога Барта Бартолджи из Университета штата Арканзас. Он назначил талидомид пациентам с тяжёлой формой множественной миеломы, которым не помогала пересадка костного мозга. В 1999 году он испытал лекарство на 84 пациентах (впоследствии их общее количество увеличилось до 169). Активность раковых клеток хорошо прослеживается по выделяемым ими белкам. У восьмерых больных из первой группы уровень онкологических белков упал более чем на 90%, двое из них вообще перешли в ремиссию. Сбить активность миеломы на 50 и более процентов удалось у 24 человек из этой группы. Медианная выживаемость с тяжёлой формой миеломы составляет 15 месяцев, но талидомид в сочетании с иной химиотерапией позволил половине представителей первой группе прожить 18 и более месяцев после начала исследования.
Здесь приводится расширенный обзор заболеваний, при которых в настоящее время может назначаться талидомид. Новейшие исследования показали, что он тормозит не только образование кровеносных сосудов (ангиогенез), но и синтез факторов крови, благодаря чему оказывается полезен и при аутоиммунных заболеваниях, и при СПИДе. Впрочем, именно иммунологические свойства талидомида объясняют его эффективность при борьбе с проказой.
Заключение
Сочетание факторов, приведших к возникновению, запрету и возрождению талидомида, кажется мне одним из самых гротескных примеров, описываемых известным мемом «это не баг, это фича», а также иллюстрацией подлинного размаха «недокументированных возможностей» и власти фармакологических корпораций. Талидомид не оказался на свалке истории потому, что его успели выпустить и продать в колоссальных объёмах, а также потому, что вызванные им уродства были слишком страшны, чтобы остаться без подробного изучения. Ренессанс талидомида в Южной Америке заставляет согласиться, что слезинка ребёнка вполне поддаётся взвешиванию и оценке, так как для борьбы с проказой хороши любые средства. После талидомидного процесса компания «Грюненталь» откупилась настолько успешно, что никто из её сотрудников не подвергался уголовному преследованию. К 1979 году она полностью восстановила деловое реноме и сейчас является преуспевающим предприятием.
Френсис Келси прожила 101 год (1914-2015), последние годы провела в Канаде в доме у дочери. Скончалась менее чем через сутки после того, как лейтенант-губернатор провинции Онтарио вручила ей Орден Канады за заслуги в борьбе с талидомидом.


