Что такое биомаркер старения и зачем он нужен?
Все мы знаем кого-то, кто “прекрасно сохранился” для своего возраста, и кого-то, кто “стар не по годам”:

Собственно, биомаркеры старения нам как раз и нужны для того, чтобы можно было объективно сказать: да, вам 50, но здоровье у вас на уровне 35-летней. А вот вам, молодой человек, стоило бы повнимательней отнестись к своему здоровью — ваш биологический возраст на 10 лет превышает хронологический, а это чревато 48%-ым повышением риска смерти.
При чём тут старение и вероятность смерти? А при том, что у людей, как и у большинства млекопитающих, старение сопровождается экспоненциальным риском смертности:

И если в 30 лет годовая вероятность умереть у вас составляет 1 шанс на тысячу, то к 80 она повышается в 100 раз. Именно это возрастное повышение вероятности умереть геронтологи и называют старением. И нет, стареет далеко не “всё живое”. Есть виды, которые с возрастом наоборот “молодеют” — их вероятность смерти падает, а плодовитость повышается:

Так вот, цель борьбы со старением — научиться откатывать биологический возраст на уровень сегодняшнего здорового 25-летнего человека, и зафиксировать его там. А задача биомаркера старения — отделить биологический возраст от хронологического (паспортного). То есть достоверно показывать, где именно на этой кривой вы находитесь:
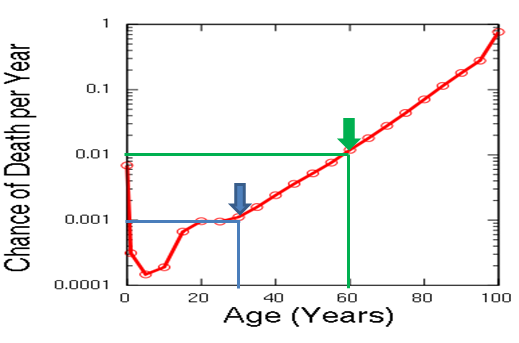
Поэтому хороший биомаркер должен высоко коррелировать со смертностью, чтобы с его помощью можно было определить биологический возраст. Например, если биомаркер показывает, что ваша текущая годовая вероятность смерти составляет 1/1000, то вам биологически 30, а если 1/100, то 60. Вне зависимости от того, что говорит ваш паспорт. Потому что умираем мы не по паспорту, а по здоровью.
И конечно же, нам важно видеть и обратную динамику у биомаркеров старения: “оздоровили” организм какой-либо доказанной омолаживающей терапией (например, мышей тем же голоданием или рапамицином) и увидели снижение биологического возраста.
Что такое эпигенетика?
Эпигенетика — это “надстройка” над (эпи- = над) генетикой, механизм управления генами. Вернее, таких механизмов несколько: метилирование самих генов, ацетилирование или метилирование гистонов, на которые эти гены “намотаны”, и много чего другого, что попадает под определение эпигенетического контроля.
Почему гены вообще нужно контролировать? Во-первых, потому что ДНК у организма одинаковая во всех типах клеток, а в клетке мозга и клетке кожи должны быть активны различные наборы генов. А еще потому что за разные стадии развития организма отвечают разные гены — у гусеницы и у бабочки весьма различный профиль активности этих самых генов. Как и у нас, собственно: в утробе матери активны одни гены, в детстве — другие, в старости — третьи.
И, как оказывается, с возрастом профиль вкл./выкл. различных генов меняется у всех людей практически одинаково. А что еще интересней, меняется он схожим образом и у мышей, и у других животных. То есть эпигенетическое старение мышки похоже на эпигенетическое старение человека, только ускоренное в 40 раз:
Мы наблюдали тканеспецифические возрастные изменения в метилировании ДНК [мышей], вектор направленности которых совпадал с наблюдаемыми изменениями у людей. Эти результаты дополнительно подтверждают мнение о том, что изменения метилирования ДНК связаны с хронологическим возрастом и свидетельствуют о том, что эти процессы схожи в различных тканях, а также между видами млекопитающих.
При этом у нас с мышами есть даже общие “шестеренки” в этих часах старения — одни и те же гены, входящие в их состав:
Дифференцированно метилированные области у мышей имеют высокое сходство в нуклеотидной последовательности с людьми, и характер их метилирования также в значительной степени схож между двумя видами.
Что же такое эпигенетические часы?
По сути, “часы метилирования” — это просто некий набор параметров вкл/выкл, который лучше всего коррелирует с возрастом. С каким именно возрастом — хронологическим или биологическим?
Изначально, и с тем, и с другим — ведь у животных в диких условиях и хронологический, и биологический практически идентичны. Они не пьют и не курят, и в Макдональдсе не питаются. Поэтому исходно часы метилирования выставляются (калибруются) по хронологическому возрасту каждого вида, а уже потом тестируются различные способы их ускорить или замедлить, чтобы проверить — действительно ли те воздействия, которые продлевают жизнь, заодно замедляют эти часы, а те воздействия, что жизнь укорачивают, эти часы ускоряют?
И таки да! У курильщиков, диабетиков, больных СПИДом или людей с синдромом Дауна (которые гораздо быстрее стареют) действительно биологический возраст оказался выше их возраста хронологического. А у мышей, получавших различную омоложивающую терапию, снижался и биологический возраст.
Но подробнее об этом чуть позже. Пока лишь упомяну, что высокую корреляцию между часами метилирования и возрастом помимо людей установили для целого ряда животных: для коловраток, мышей, шимпанзе, и даже для китов:

И что же такого особенного в этих самых часах?
Особенное в часах метилирования то, что они высоко коррелируют со смертностью. Например, вот в этом масштабном исследовании Хорвата на тринадцати тысячах людей было установлено, что на каждый год опережения часами метилирования хронологического возраста (то есть, если вам 45, а часы показывают 46) приходится от 2% до 4% повышения риска смертности.
Причем это наблюдение работало в обе стороны и имело кумулятивный эффект: у тех, у кого биологические часы обгоняли возраст на 10 лет, рис смерти повышался аж на 48% (1.0410=1.48), а те, кто был на 5 лет “моложе” своего возраста были на 18% меньше подвержены риску смерти.
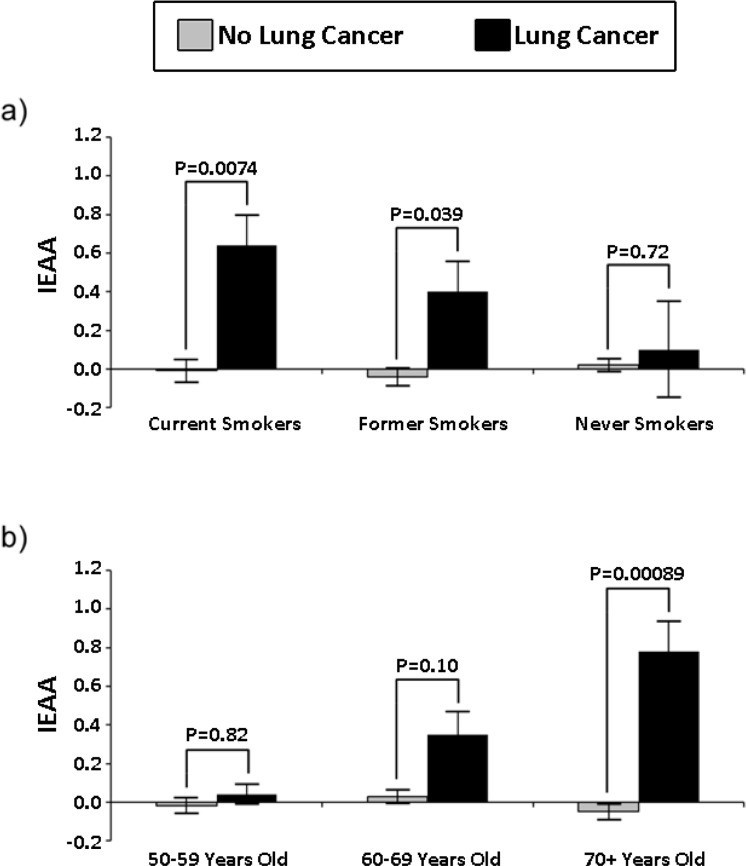
В другом исследовании показали высокую корреляцию часов метилирования и риска возникновения рака легких у курильщиков. Причем и риск, и коэффициент достоверности корреляции возрастал с возрастом:
Мы также показали, что способность IEAA прогнозировать рак легких является наиболее высокой среди людей в возрасте 70 лет и старше. Повышение IEAA на одну единицу было связано с 2,5-кратным увеличением рака легких среди подгруппы людей в возрасте 70+, в то время как для всей когорты возрастом 50+ лет оно увеличивало риск лишь на 50%.
В этом исследовании были выявлены лишь 10 сайтов метилирования (для сравнения, в “часах Хорвата”, упомянутых выше, таких сайтов было 353), аномальное метилирование хотя бы шести из которых повышало риск смертности в разы — как от любых причин, так и от рака или сердечно-сосудистых заболеваний:

А в этом исследовании японцы показали вообще убийственные факты для митохондриальной теории старения: дефекты в митохондриальном дыхании вызваны не накоплением поломок, а эпигенетическими (запрограммированными) изменениями. И при эпигенетическом откате таких старых клеток с помощью факторов Яманаки, все дефекты митохондриального дыхания исчезают:
Мы перепрограммировали линии фибробластов человека, генерируя iPSC, и показали, что перепрограммирование фибробластов, полученных от пожилых людей, восстанавливает связанные с возрастом дефекты митохондриального дыхания. Поэтому эти связанные с возрастом фенотипы, обнаруженные у пожилых фибробластов, регулируются обратимо и аналогичны фенотипам дифференциации, поскольку оба они контролируются эпигенетической регуляцией, а не мутациями в ядерной или мтДНК. Учитывая, что старение человека можно рассматривать как следствие запрограммированного явления, возможно, что эпигенетическая регуляция также контролирует старение человека.
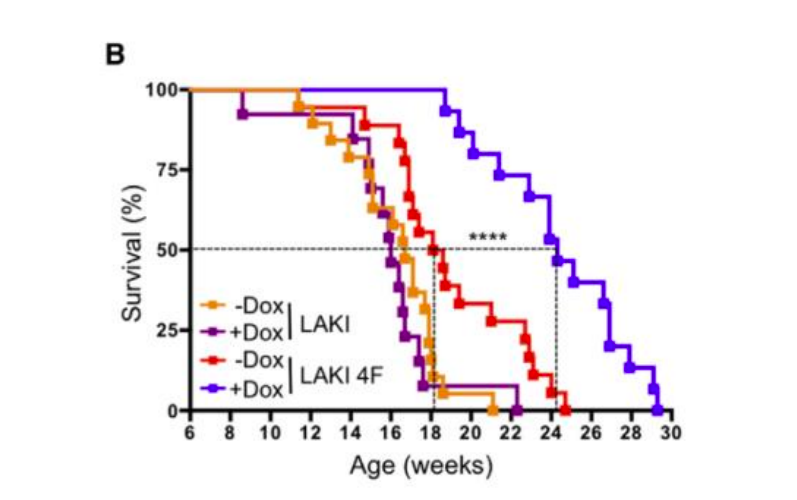
Японцы дело говорят. А самый большой подарок человечеству японцы преподнесли в виде тех самых факторов Яманаки. Ведь они не только обнуляют эпигенетические часы (и у людей, и у мышей), но и значительно продлевают жизнь животным:
Так как помолодеть?
Главный смысл биомаркеров старения в том, чтобы с их помощью искать наиболее эффективные пути борьбы с ним. Поэтому сразу же после того как часы метилирования зарекомендовали себя как такой потенциальный биомаркер, ученые кинулись исследовать их на предмет того, отражают ли они эффективность различных омолаживающих воздействий. И действительно, такая взаимосвязь начинает проявляться. Вот резюме последнего исследования уже пару раз упомянутого Хорвата, который является одним из ведущих специалистов в этом направлении (синие стрелочки снижают часы метилирования, а красные повышают):
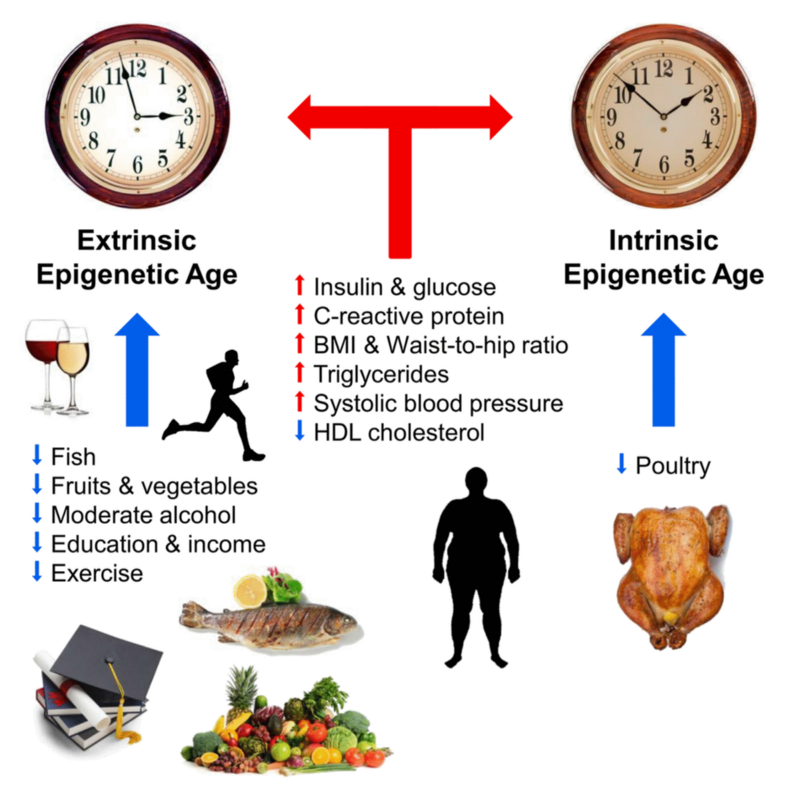
Многое из вышеприведенного ожидаемо. Пара сюрпризов для меня было в том, что и умеренное потребления алкоголя, и “хороший” холестерин снижают часы метилирования. Ну что ж, будет повод выпить за здоровье Хорвата.
Уже гораздо более прицельное исследование на мышах по оценке воздействия на часы метилирования рапамицина, ограничения калорий и генетических мутаций, продлевающих жизнь, было опубликовано не так давно. И оно тоже подтвердило, что все эти интервенции оказывают омолаживающее действие и на часы метилирования:
Мы сформулировали модель эпигенетического старения у мышей и использовали ее, чтобы найти доказательства того, что известные интервенции по продлению жизни замедляют эпигенетические часы в печени мышей.
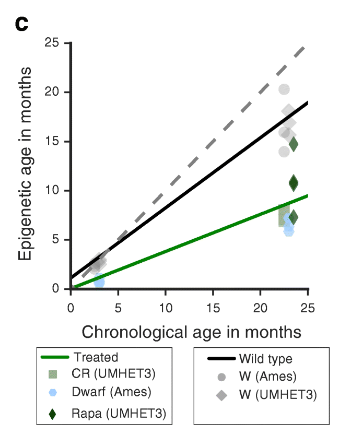
Кстати, эти же исследователи выпустили параллельную статью, где попытались выявить какие именно области генома подвержены возрастным изменениям в метилировании. Проанализировав 42 миллиона (!) сайтов метилирования, авторы пришли к выводу, что основными объектами возрастных изменений являются промотеры и энхансеры высокоэкспрессированных генов.
Что для меня подтверждает гипотезу запрограммированного старения — похоже, что ключевым возрастным изменением является изменение профиля экспрессии всего нескольких ключевых генных регуляторов, находящихся на вершине иерархии контроля за гомеостазом, и это каскадом влечет за собой уже все остальные возрастные изменения.
Весьма схожие находки, свидетельствующие о нескольких ключевых генах описывает и Вадим Гладышев с коллегами в своей последней работе:
Значимость различных сайтов метилирования была распределена неравномерно в часах метилирования. Сайты образовали несколько различных кластеров, связанных с генами Hsf4, Kcns2, Map10, Tns2, Wnt3a и Zscan2. Мы обнаружили, что 17 из 18 сайтов CpG, общих для подмножеств часов метилирования 1 и 2, также присутствовали среди 90 CpG-сайтов часов mDNAm. Большинство из этих 17 сайтов CpG были расположены внутри интронов Ciita, Cd200r4, Rasgef1c, Wnt3a и Zscan2, а некоторые были сгруппированы.
Замедление часов метилирования с помощью различных замедляющих старение интервенций было показано и в этой красивейшей работе:
Важно отметить, что мы обнаружили, что биологические вмешательства влияют на часы метилирования мышей, и поэтому мы предполагаем, что предсказания часов отражает не только хронологический, но и биологический возраст.
Мне в ней очень понравился этот график возрастных изменений уровня метилирования 329 сайтов в разных тканях:

На нём видно, как некоторые гены с возрастом активируются, другие — наоборот, а третьи остаются неизменными.
Кстати, результаты исследования на близнецах подтверждают корреляцию часов метилирования со смертностью. Чем выше биологический возраст одного из близнецов, тем выше вероятность того, что он умрет первым:
Эта гипотеза была подтверждена классическим анализом выживаемости, показывающим повышение риска смертности на 35% (4-77%) для каждого 5-летнего превышения возраста по часам метилирования над хронологическим возрастом. Кроме того, парный анализ близнецов выявил более чем двойной риск смертности для близнеца с большим возрастом по часам метилирования, а также дозозависимость вероятности смерти, которая повышалась в 3,2 (1,05-10,1) раза на каждые 5 лет разницы возраста по часам метилирования между близнецами, тем самым демонстрируя более сильную связь часов метилирования с вероятностью смерти у людей старшего возраста, с учетом семейных факторов. В заключение, наши результаты подтверждают, что часы метилирования могут считаться биомаркером старения.
Резюмируя эту часть, не могу не сказать, что я считаю, что для того чтобы помолодеть радикально, нужно научиться откатывать эпигенетические часы напрямую. Пока мы только начинаем понимать как это делать: благодаря результатам группы Бельмонте, мы научились легонько стучать по этим часам “молотком” в виде факторов Яманаки. Но в идеале хотелось бы подобрать к нашим часам ключик.
Какие ещё есть биомаркеры старения?
Среди других биомаркеров старения хочу отметить локомоторную активность, на основании которой российская компания Gero недавно выпустила крутое приложение, определяющее биологический возраст по паттерну двигательной активности с вашего ФитБита.
Также неплохим предиктором смертности является толщина артериального комплекса интима-медиа. По поводу ИФР-1 всё сложно (1, 2, 3, 4, 5, но 6, 7, 8), поэтому с ним я буду разбираться в отдельном посте. Ну а дедушкой всех биомаркеров является frailty index, над однозначным переводом которого до сих пор бьются геронтологи: “индекс дряхлости” звучит обидно, а “индекс хрупкости” или “индекс уязвимости” не полностью передаёт изначальный смысл.
Кстати, не так давно я видел новость о свежей статье, смело утверждавшей, что разработанный её авторами новый вариант этого индекса отражает биологический возраст даже лучше, чем “часы метилирования”. По крайней мере, заголовок у неё был весьма амбициозен: “The frailty index outperforms DNA methylation age and its derivatives as an indicator of biological age”.
Но после её прочтения я понял, что смелость заявлений авторов необоснованна. Мало того, что их гипотеза, мягко говоря, сомнительна, но сама же их статья эту гипотезу и опровергает. Для начала их new and improved индекс представляет из себя простой опросник из 34 пунктов. Который, при этом отводит равную роль инфаркту и циститу:

А громкие заявления не подтверждаются их же данными. Вот таблица результатов их анализа:
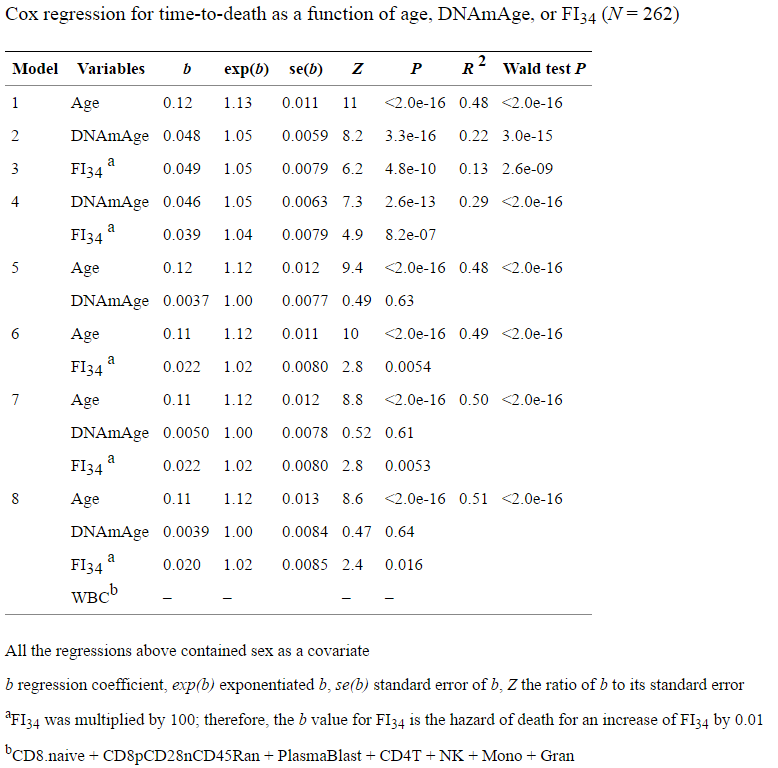
Из неё мы видим, что регрессия по часам метилирования (модель №2) имеет более высокий R2, чем регрессия по их индексу дряхлости (модель №3) — причем почти в 2 раза (0,22 против 0,13). При этом обычный хронологический возраст (модель №1) имеет R2 почти в 4 раза выше, чем их индекс, и в 2 раза выше, чем часы метилирования. Я даже не говорю о том, что R2 у всех их моделей чрезвычайно низок.
Чем же авторы обосновывают свои громкие заявления, что их FI лучше подходит на роль биологических часов, нежели DNAmAge? А вот чем — более низким p-value в модели №7, да еще и ограниченной по возрасту только восьмидесятилетними:
Во всех моделях регрессии Кокса на всей исследуемой когорте, которая включает в себя возрастные категории от 60 до 103, хронологический возраст был лучшим предиктором смертности (рис. 3а). Когда регрессия Кокса была ограничена только 80-летними, FI34 был лучшим предиктором смертности, чем хронологический возраст (P=0,035 против P=0,054, соответственно, рис.3b). Это указывает на то, что FI34 является лучшим показателем биологического возраста в более поздние годы, когда накопление дефицита здоровья ускоряется у самых старых.
То есть более низкий p-value у них означает лучшую предсказательную мощь. Типичное заблуждение плохо понимающих статистику:
Заблуждение №13: Статистическая значимость является свойством изучаемого явления, и, таким образом, статистические тесты обнаруживают значимость.
Нет! Это неправильное толкование продвигается, когда исследователи утверждают, что они нашли или не нашли «доказательства» статистически значимого эффекта. Исследуемый эффект либо существует, либо не существует. «Статистическая значимость» представляет собой дихотомическое описание значения Р (что ниже выбранного отсечения) и, следовательно, является свойством результата статистического теста, но она не является свойством эффекта или изучаемой популяции.
Причем для своего ключевого вывода авторы взяли за основу модель №7, где оба рассматриваемых параметра (FI и DNAmAge) представлены одновременно, да еще и вместе с хронологическим возрастом, с которым они оба коррелируют (то есть, скорее всего, не являются независимыми, нарушая одно из условий регрессии). Да еще и сузили выборку только до 80-летних — то есть до весьма узкого сегмента того параметра (хронологический возраст), который лучше всего объясняет вариацию всего массива данных (так как у модели №1 R2 в разы выше других моделей), а потом с радостью отрапортовали, что у возраста на таком узком возрастном сегменте низкий p-value.
Про то, что у модели их индекса дряхлости R2 почти в 2 раза ниже модели DNAmAge, я уже упоминал (0,13 против 0,22). А то, что добавление в модель к уже имеющемуся хронологическому возрасту дополнительных параметров бессмысленно, видно по тому, что R2 таких моделей (0,48–0,50) практически идентичен исходному (0,48 модели №1).
Ну и в заключение стоит отметить, что ценность самой концепции индекса дряхлости, предложенной авторами, близка к нулю. Биомаркер ценен тем, что он может меняться в обе стороны, ведь терапия старения призвана биологический возраст снижать. А предложенный индекс дряхлости в основном основывается на исторических параметрах (был ли у вас инсульт/инфаркт/и т.п.). Поэтому, даже если терапия старения омолодит ваше сердце, мозг и почки, на историческом индексе дряхлости это практически не отразится. А на часах метилирования или локомоторике — вполне.
Так что поздравляю нас всех с новыми биомаркерами старения, и желаю нам счастья, здоровья, и очень долгих лет жизни!

Источник


