
Проблема
Митохондрии генерируют энергию в каждой клетке человека. Мутации в митохондриальной ДНК, наследуемые или приобретённые в течение жизни, приводят к метаболическим, нейродегенеративным и сердечно-сосудистым проявлениям старения.
SENS Research Foundation разработал семь практических стратегий «ремонта» главных факторов старения. В то время как некоторые из этих стратегий в настоящее время широко изучаются научным сообществом, стратегия MitoSENS по борьбе с повреждением митохондрий является одной из самых новых. Наша теория заключается в том, что при помощи «аллотопической экспрессии», то есть путем помещения функциональных копий критических генов митохондриальной ДНК (мтДНК) в ядро клетки, можно устранить дефекты, возникающие из-за мутаций в мтДНК.
Когда это было предложено, эта уникальная и амбициозная стратегия была, возможно, слишком «смелой» для многих лабораторий и финансирующих организаций. Таким образом, MitoSENS был «внутренним» проектом SENS, который был бы невозможен без поддержки сообщества. Пока что этот подход, финансируемый сообществом, имеет отличную историю, ведущую к революционным открытиям.
В 2013 году SENS организовал свою первую краудфандинговую кампанию специально для MitoSENS в партнёрстве с LongeCity. Эта небольшая инициатива вызвала значительный интерес и проложила путь к более крупному сбору средств в 2015 году на сайте Lifespan.io. За этим последовали прорывные открытия, и впервые в человеческих клетках учёные показали принципиальную работу подхода MitoSENS.

Чтобы приблизить его клиническое применение, SRF вскоре создал «максимально изменяемую модель мыши». У этой мыши есть уникальная модификация в их ядерном геноме, которая позволяет целевую вставку новых генов в конкретном месте. Используя эту мышь, мы готовы сделать следующий шаг и продолжить митохондриальную генную терапию на животной модели.
Решение
Мыши C57/BL6MT-FVB линии (назовём их «Больными Мышами» ) имеют генетический дефект (мутация в митохондриальном гене ATP8) и проявляют несколько возрастных симптомов, включая снижение фертильности, артрит, сахарный диабет II типа и неврологические нарушения. Поскольку митохондриальная ДНК наследуется лишь по матери, скрещивание самки Больной Мыши с самцами мышей из иных линий приведёт к этой же дисфункции митохондрий.
Мы будем использовать максимально изменяемую модель мыши для проектирования новой трансгенной мыши («аллотопная АТР8 трансгенная мышь – МитоМышь»). У этой мыши будет ген ATP8, важный для митохондриальной функции, «скрытый» в ядре клетки и, следовательно, способный передаваться потомству независимо от пола.
Наша гипотеза заключается в том, что как самцы, так и самки в потомстве Больной Мыши и МитоМыши покажут восстановленные митохондриальные функции. Это означало бы жизнеспособность стратегии MitoSENS, показав, что функциональные резервные копии генов митохондриальной ДНК в ядре могут заменить их мутировавшие аналоги у живых животных.
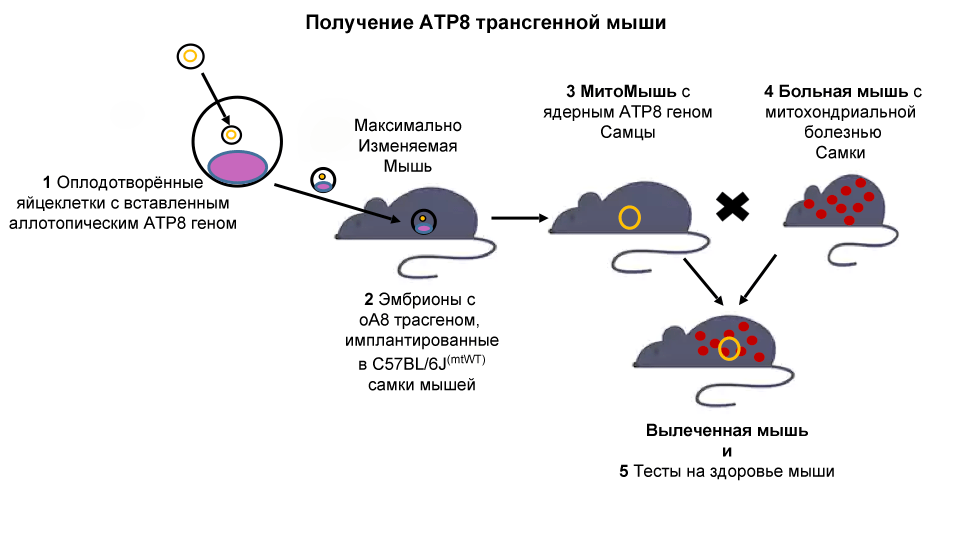
Наконец, мышей оценят на фенотипические улучшения, такие как поведенческие, физиологические и биохимические изменения. Успех проекта заложит основу для успешной генной терапии у людей.

