В основном в гликозилировании участвуют два гликана (углеводной части связки углевод-органическая молекула): N-гликаны (связанные с амидной группой аспарагина) и О-гликаны (связанные с гидроксильной группой серина или треонина). В связи со старением нас больше интересуют N-гликаны. Описано, что при старении меняется спектр сахарных цепочек, которые присоединяются к иммунным белкам при N-гликозилировании. И такое изменение играет одну из ключевых ролей в возрастном повышении общего воспаления в организме. Так, уровень гликозилированных антител IgG может предсказывать биологический возраст человека даже более точно, чем длина теломер [1].
Кроме этого, ещё два гликана, NGA2F и N2AF, показали себя перспективными биомаркерами старения. В рамках программы европейского исследования биомаркеров старения MARK–AGE, завершившейся в 2013 году, был разработан тест GlycoAgeTest, определяющий биологический возраст человека. В его основе – соотношение количества гликанов NGA2F (повышающихся с возрастом) и N2AF (уровень которых с возрастом понижается). Ещё одним потенциальным биомаркером старения и возраст-зависимых заболеваний (сердечно-сосудистых и диабета), описанным в рамках исследования MARK–AGE, стал гликопротеин кластерин, который участвует в стабилизации белковых структур [2].
Перейдём теперь к рассмотрению патологической части этого явления. Кроме регулируемого организмом ферментативного гликозилирования существует неферментативная форма этого процесса, т.н. реакция Майяра, результатом которой становится появление в организме разнообразных продуктов гликирования. Следует отметить, что процесс неферментатиивного гликозилирования практически не регулируется. Хотя есть возможность «сдерживания» гликозилирования через трансгликацию, при которой в «расход» идут глутатион, полиамины, тиолы, свободные аминокислоты, например, таурин, лизин. А также через инактивацию метилглиоксаля глиоксалазной системой: глиоксалаза I превращает метилглиоксаль и восстановленный глутатион в лактоилглутатион, который далее метаболизируется в D-лактат под действием глиоксалазы II.
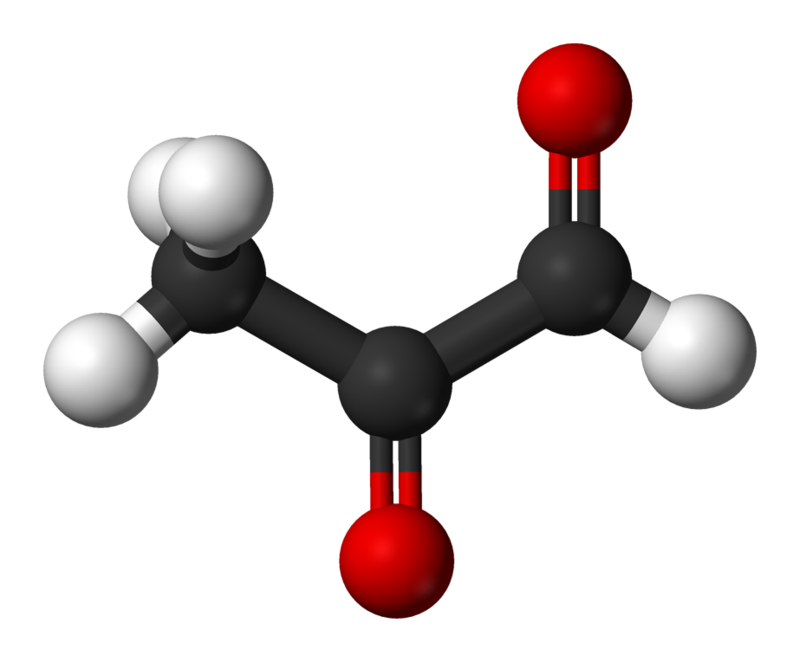
Структура метилглиоксаля
Среди продуктов гликирования выделяют ранние (продукты Амадори) и поздние (или конечные) продукты гликирования. Неферментативное гликозилирование происходит в несколько этапов.Начинается этот процесс с того, что глюкоза и другие простые сахара соединяются с аминогруппой и запускают цепь дальнейших реакций. В начале в ходе реакции между альдегидной группой сахаров и аминогруппой образуется нестабильная альдиминовая группировка (основания Шиффа), которая может превращаться в ряд других, более стабильных соединений, ранних продуктов гликозилирования, т.н. продуктов Амадори. Одним из ранних продуктов присоединения глюкозы к белку является Nе–фруктозил–лизин, который, деградируя, в свою очередь, образует различные конечные продукты гликирования (КПГ). В наибольшем количестве в качестве КПГ образуются гидроимидазолоны, производные остатков аргинина, подвергшихся модификации глиоксалем, метилглиоксалем и 3–дезоксиглюкозоном (3–DG). Ещё одни хорошо изученные КПГ – Nδ–карбоксиметил–лизин (КМЛ) и Nδ–карбоксиэтил–лизин (КЭЛ), а также глюкозепан и пентозидин, характерные для перекрестных сшивок белков [3]. Одним из наиболее легко определяемых видов КПГ является пентозидин, который накапливается, например, в сухожилиях больших мышц (то есть там, где скорость оборота коллагена замедлена) человека начиная с 20 лет и его концентрация линейно увеличивается к старости.
Сшивание молекул коллагена глюкозепаном.
Как сегодня предполагается, неферментативное гликозилирование и КПГ тесно связаны с целым рядом возраст-зависимых заболеваний, таких, как диабет, ревматоидный артрит, атеросклероз, болезнь Паркинсона и Альцгеймера, боково́й амиотрофи́ческий склеро́з, катаракта и онкологические болезни [5]. В организме человека нет ферментов, которые способны гидролизовать КПГ. Белки, подвергшиеся гликированию в реакции Майяра, становятся афизиологично поперечно-сшитыми, теряя при этом свои свойства. Особенно большую проблему это представляет для долгоживущих белков (например, молекулы коллагена кожи, согласно ряду исследований, имеют период полужизни 15 лет, а хрящей — более 100 лет) которые составляют значительную часть всех белков в организме – около одной трети. Образовавшиеся дополнительные сшивки между молекулами нарушают функции этих белков, что приводит к потере эластичности тканей и часто наблюдается при старении и патологиях. Гликирование также становится причиной того, что и так медленно обновляемый белок коллаген становится еще более долгоживущим – после гликирования он приобретает резистентность к физиологическому действию эндогенных коллагеназ, которые обеспечивают обновление тканей.
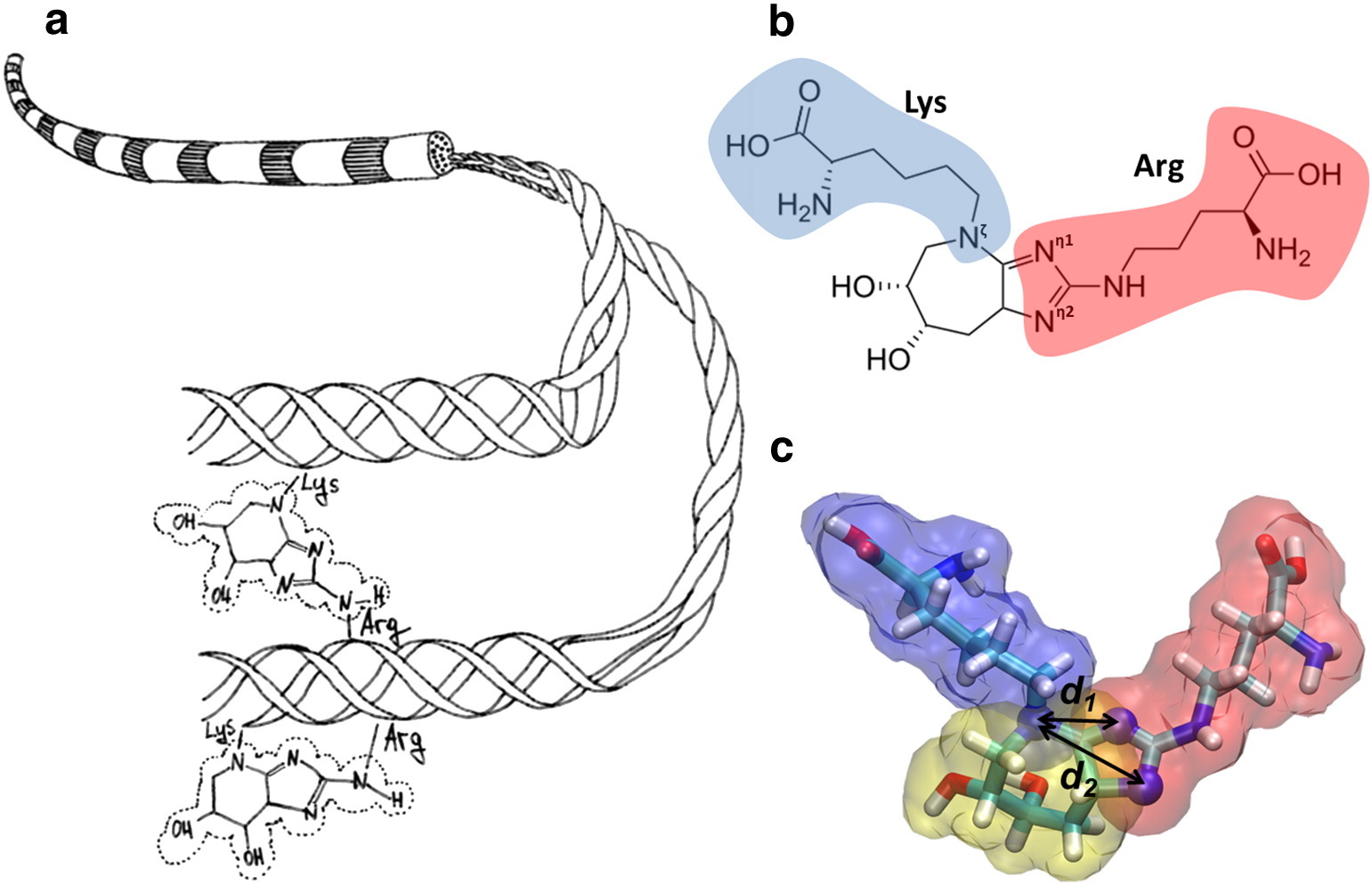
На иллюстрации (а) показана схема коллагеновой фибриллы и образование глюкозепана, который ковалентно связывает боковые цепи лизина и аргинина. (б) Показана химическая структура глюкозопана, которая сшивает лизин (синий) с аргинином (красный). (с) Показана молекулярная модель глюкозопана.
Описано участие гликированного фактора роста фибробластов β-FGF в образовании фиброзов. Гликирование последовательности арг-гли-асп белка фибронектина приводит к нарушению восстановительной способности сосудов и прогрессированию сосудистых патологий. КПГ накапливаются в линзе и сетчатке глаза с возрастом. Кристаллины, основные структурные белки хрусталика глаза, восприимчивы к гликированию и поперечному сшиванию. Гликирование белков хрусталика приводит к возникновению катаракты. Гликированный гемоглобин, который используют для определения среднего уровня гликемии за последние 3 месяца, теряет способность переносить кислород в ткани, что негативно сказывается на многих химических процессах.
Гликирование белков дыхательной цепи митохондрий тоже вносит свой вклад в этот процесс: нарушение в работе дыхательной цепи служит постоянным источником супероксидных радикалов. Кроме этого, формирование в митохондриях и в других структурах под воздействием гликирования неразлагаемых КПГ может быть ответственно за реализацию такого феномена, как «метаболическая память». Когда у больных диабетом 2 типа строгий контроль гликемии уже не предотвращает развитие осложнений, связанных с сердечно-сосудистыми заболеваниями. Предполагается, что неразлагаемые КПГ играют в этом феномене основную роль [6].
Также при гликировании происходит увеличение воспалительных процессов. Так, при гликозилировании коллагена происходит накопление во внесосудистом матриксе конечных продуктов этого процесса, которые организм воспринимает как чужеродные. Из-за этого возникнет иммунный ответ, в ходе которого иммунные клетки – макрофаги – увеличат секрецию провоспалительных цитокинов (TNF-α, интерлейкина-6 и др.), которые известны своей способностью негативно влиять на резистентность к инсулину и атерогенез [7].
Даже незначительные изменения модуля сдвига и вязкоупругости межклеточной среды оказывают сильное влияние на клетки – «старый» внеклеточный матрикс может существенно ограничивать эффективность применения сенолитиков и терапии стволовыми клетками. Так, «молодые» фибробласты стремительно стареют в старом матриксе и наоборот – «старые» клетки утрачивают признаки связанного со старением секреторного фенотипа в «молодом» матриксе.
Какие есть причины возникновения гликированных белков и КПГ? Считается, что главная из них для современного человека сегодня – это нездоровая пища. Поджаренная коричнево-чёрная корочка на продуктах как раз и представляет собрание КПГ, образовавшихся из-за термической обработки продуктов (жарки мяса, картофеля и т.п.) при высоких температурах. Рекордсменом по количеству образованных КПГ считается поджаренный бекон. Кроме этого, потребление содержащих много быстрых углеводов продуктов (кондитерских изделий, сладких газированных напитков и пр.) также может способствовать гликированию белков и образованию КПГ. Известны продукты, которые, напротив, помогают противостоять накоплению КПГ – черная редька, редис, капуста брокколи, благодаря содержащемуся в ней веществу сульфорафану. Как это не удивительно, но вместе с гурманами регулярно снабжают себя повышенными дозами КПГ и курильщики. Табачный дым содержит гликотоксины, которые реагируют с остатками лизина и аргинина, формируя КПГ. Вероятно, поэтому у курильщиков наблюдается хроническое воспаление дыхательных органов [8].
По образному выражению авторов SENS, белковые сшивки действуют как молекулярные «наручники», связывающие молекулы белков, нарушая этим их функцию. Решением этой проблемы авторы SENS видят в разработке лекарств, которые смогут реагировать с поперечными сшивками и разрывать их, не разрушая других структурных особенностей молекул. По их мнению благоприятным обстоятельством в этом процессе является то, что сшивки, которые происходят как химические аварии в структурах наших белковых молекул, имеют очень необычное химическое строение, которое в норме не встречается в веществах, производимых организмом. Что должно облегчить поиск и создание терапевтических средств. Кроме этого, авторы SENS определяют ещё ряд перспективных подходов для решения данной проблемы. Такие, как поиск или разработка ферментов, вместо лекарств, для разрушения сшивок. А также разработка «одноразовых» белков, которые разрушали бы сшивку, и потом сами были бы уничтожены в процессе. Известно, что такие белки существуют для других целей, например, регенерирующий ДНК белок MGMT [9]. В пользу подхода по поиску ферментов, говорит тот факт, что у живых организмов описаны дегликирующие ферменты. Так у грибов и бактерий найдены противостоящие гликированию ферменты амадориаза, фруктозолизин-6-киназа frlD и фруктозолизин-6-фосфат-дегликаза frlB, действующие на низкомолекулярные соединения аминокислот с сахарами [10]. У позвоночных обнаружены ферменты фруктозамин-3-киназа (FN3K) и родственный ей белок FN3K-RP, которые в состоянии расщеплять продукты гликирования внутриклеточно, в АТФ-зависимых процессах [11].
К сожалению, глюкозепан не был выбран целью для ранее разработанных препаратов против поперечных сшивок, таких как Alagebrium/ALT-711 (Wolffenbuttel et al., 1998), C36 (Cheng et al., 2007), vTRC4149 (Pathal et al., 2008), и ему только предстоит доказать свою роль в механизмах старения. Эти вещества были нацелены на нейтрализацию карбоксиметиллизина – самого распространённого позднего продукта реакции Майяра, накапливающемся в организме при диабете.
На данный момент группа Дэвида Шпигель из Йельского университета работает над синтезом антител против содержащих глюкозепан белков. Обри де Грей подтверждает важность исследований по глюкезепану и недавно сообщил о регистрации компании Revel, на базе которой, возможно, будут продолжены начатые в университете исследования.
Однако, есть вероятность, что ни антитела, ни энзимы, по причине своих размеров, не смогут проникнуть между фибриллами коллагена. Более того, разорванные поперечные сшивки коллагена восстанавливаются после окончания приема препарата, что будет требовать повторный курс терапии.
Как было замечено ранее, поскольку конечные продукты гликирования накапливаются во время старения, их количественное определение может быть точным и надежным биомаркером старения. Однако, как детектирование КПГ в организме, так и ранняя диагностика изменений состава и структуры межклеточного матрикса затруднены по причине ограниченного органами и системами характера изменений и необходимостью проведения множественной биопсии. Даже в одном организме результаты сильно отличаются в зависимости от места взятия биопсии и исследуемого вида конечных продуктов гликирования.
Доступные методы определения конечных продуктов гликирования в коже, такой как аутофлуоресценция, то есть без применения специальных красителей (прибор «AGE-READER», изготавливаемый голландской компанией DiagnOptics BV) не дают точных данных и на результаты измерений могут влиять многие факторы, например, изменения водно-солевого баланса организма.
Также для определения уровня КПГ используется иммуноферментный анализ. Но этот метод имеет ряд качественных ограничений (недостаточная специфичность антител, влияние свободных продуктов гликирования и пр.). Поэтому считается, что целесообразно проводить его в сочетании с масс–спектрометрией. КПГ также можно идентифицировать по общей интенсивности их флуоресценции. Что тоже имеет свои ограничения (большинство КПГ количественно не флуоресцируют, поэтому не могут быть определены) и позволяет более точно определять низкомолекулярные пептиды КПГ и свободные продукты гликирования.
Одним из перспективных биомаркеров, показывающих не только накопление КПГ, но и увеличение риска смертности от всех причин, является плазменный карбоксиметил-лизин (КМЛ). КМЛ является одним из доминирующих КПГ в организме, как циркулирующих, так и тканевых. Кроме этого, КМЛ является единственным КПГ, который выступает лигандом для рецепторов КПГ (RAGEs). Связывание RAGE с КМЛ приводит к увеличению генерации свободных радикалов, активации пути ядерного фактора Nf-κB и повышению уровня медиаторов воспаления (таких, как фактор некроза опухоли-альфа, интерлейкин-6 и C-реактивный белок). Известно, что КМЛ накапливается в больших кровеносных сосудах с возрастом. И высокие концентрации этого КПГ в сыворотке связаны с большей артериальной жесткостью, мощным фактором риска развития сердечно-сосудистых патологий и смертности от них, что было показано в ходе Балтиморского продольного исследования старения [12]. Также известно, что пожилых людей с церебрально-сосудистыми заболеваниями повышенный уровень КМЛ обнаруживается в кортикальных нейронах и сосудах головного мозга, что связано с тяжестью когнитивных нарушений. В рамках 6-летнего исследования Invecchiare in Chianti, в котором приняли участие 1.013 человека старше 65 лет, было показано, что средняя концентрация КМЛ в плазме, которую измеряли иммуноферментным анализом, была значительно выше у тех людей, которые умерли от всех причин, чем у выживших [13]. В 2018 году группа датских и шведских учёных описала новое моноклональное антитело, D1-B2, нацеленное на КМЛ, которое имеет хороший потенциал при иммуноферментном анализе для обнаружения данного КПГ. [14]
Авторы обзора: Денис Одиноков, Алексей Ржешевский.
Список литературы:
1. Krištić J, Vučković F, Menni C, Klarić L, Keser T, Beceheli I, Pučić-Baković M. et al. Glycans are a novel biomarker of chronological and biological ages.Gerontol A Biol Sci Med Sci. 2014 Jul;69(7):779-89.
2. Bürkle A, Moreno-Villanueva M, Bernhard J, Blasco M, Zondag G, Hoeijmakers JH6, Toussaint O, Grubeck-Loebenstein B, Mocchegiani E, Collino S, Gonos ES, Sikora E. et al. MARK-AGE biomarkers of ageing. Mech Ageing Dev. 2015 Nov;151:2-12.
3. Ahmed N., Thornalley P.J. Роль конечных продуктов гликирования в патогенезе осложнений сахарного диабета. Российский медицинский журнал. 2009. №9, стр. 642-51.
4. Федорова М. А., Благовещенский И. Ю., Филимонов В. Б., Кулева Н. В. Неэнзиматическая модификация актина in vitro под влиянием факторов окислительного, гликоокислительного и нитрозактивного стрессов. Вестник СПбГУ. 2006, №2, с. 51-59.
5. Ансари Н.А., Рашид З. Неферментативное гликирование белков: от диабета до рака. Биомедицинская химия, 2010, том: 56(2), 168-178.
6. Герасименко О.А. Конечные продукты избыточного гликозилирования как потенциальная мишень «выключения» метаболической памяти. Эффективная фармакотерапия. Эндокринология. 2011. № 4.
7. Bernheim J, Rashid G, Gavrieli R, Korzets Z, Wolach B. In vitro effect of advanced glycation end-products on human polymorphonuclear superoxide production. Eur J Clin Invest. 2001. Dec;31(12):1064-9.
8. Mullick AE, McDonald JM, Melkonian G, Talbot P, Pinkerton KE, Rutledge JC. Reactive carbonyls from tobacco smoke increase arterial endothelial layer injury. Am J Physiol Heart Circ Physiol. 2002 Aug;283(2):H591-7.
9. GlycoSENS: Breaking extracellular crosslinks.
10. Monnier VM, Sell DR. Prevention and repair of protein damage by the Maillard reactionin vivo. Rejuvenation Res. 2006;9(2):264–273.
11. Szwergold BS1, Bunker RD, Loomes KM. The physiological substrates of fructosamine-3-kinase-related-protein (FN3KRP) are intermediates of nonenzymatic reactions between biological amines and ketose sugars (fructation products). Med Hypotheses. 2011 Nov;77(5):739-44.
12. Semba RD, Najjar SS, Sun K, et al. Serum carboxymethyl-lysine, an advanced glycation end product, is associated with increased aortic pulse wave velocity in adults. Am J Hypertens. 2009;22:74–79
13. Semba, R. D., Bandinelli, S., Sun, K., Guralnik, J. M., & Ferrucci, L. (2009). Plasma Carboxymethyl-Lysine, an Advanced Glycation End Product, and All-Cause and Cardiovascular Disease Mortality in Older Community-Dwelling Adults. Journal of the American Geriatrics Society, 57(10), 1874–1880.
14. Wendel U, Persson N, Risinger C, Bengtsson E, Nodin B, Danielsson L, Welinder C, Nordin Fredrikson G, Jansson B, Blixt O. A novel monoclonal antibody targeting carboxymethyllysine, an advanced glycation end product in atherosclerosis and pancreatic cancer. PLoS One. 2018 Feb 8;13(2):e0191872.
15. Biemel KM, Fried DA, Lederer MO. Identification and quantification of major maillard cross-links in human serum albumin and lens protein. Evidence for glucosepane as the dominant compound. J Biol Chem. 2002 Jul 12;277(28):24907-15. Epub 2002 Apr 26.
16. Chellan P, Nagaraj RH. Protein crosslinking by the Maillard reaction: dicarbonyl-derived imidazolium crosslinks in aging and diabetes. Arch Biochem Biophys. 1999 Aug 1;368(1):98-104.
Источник


