Такие белковые структуры имеют диаметр около 5–10 нм и длину до 800 нм, и состоят из двух и более параллельных разнонаправленных филаментов, образующих специфическую структуру – кросс-бета-складчатую конформацию. Именно такая структура определяет специфическое оптическое свойство амилоида – способность к двойному лучепреломлению. И обнаружение этого свойства положено в основу диагностики амилоидоза. При микроскопии окрашенных красителем конго красным препаратов в поляризованном свете амилоид изменяет красный цвет окраски на зеленое свечение [1].
Скопления неправильных белков авторы концепции SENS называют «внеклеточным мусором» (Extracellular junk) и определяют одной из причин старения, что видится вполне справедливым. Амилоидные фибриллы в силу своей структуры не подвержены действию специальных ферментов, расщепляющих белки (протеаз), и потому имеют свойство накапливаться в тканях организма, нарушая их работу. Структурные и химико-физические свойства амилоида зависят от основного белка-предшественника, содержание которого в фибрилле – около 80%, и это определяет специфичный признак для каждого типа амилоидоза. Термином амилоидоз обозначают группу наследственных или приобретенных заболеваний, связанных с внеклеточным отложением фибрилл нерастворимых белков, вызывающих тканевые структурные нарушения и дисфункции органов. В настоящее время известно более 20 амилоидогенных белков-предшественников и столько же клинических вариантов амилоидоза. Кроме широко известного β-амилоида существует АА-амилоид, связанный с ревматоидным артритом, болезнями сердца, почек и воспалением кишечника, AIAPP-амилоид, участвующий в патогенезе сахарного диабета 2 типа, и другие [2].
β-амилоид.
Способом решения проблемы накопления белковых агрегатов авторы SENS видят в использовании специализированных каталитически активных антител, так называемых абзимов (англ. abzyme, antibody enzyme), которые подбираются конкретно под амилоиды и удаляют их из ткани. Недавно в рамках этого подхода был разработан один перспективный способ. Было обнаружено подмножество человеческих антител, которое обладает каталитической активностью против определенного антигена, разбивая его на более мелкие и менее вредные фрагменты, а не захватывает его для удаления или разрушения другими иммунными клетками. Использование этих новых каталитических антител в качестве терапии для нацеливания на амилоиды дает потенциальные преимущества перед секвестрирующими антителами, применяемыми в других вакцинах, нацеленных на амилоиды. Первый заключается в том, что ожидается сокращение дозы, необходимой для эффективного удаления внеклеточных агрегатов из тканей. Это связано с тем, что секвестрирующие антитела могут захватить, а затем транспортировать только одну молекулу амилоида за один раз. Тогда как абзимы связываются с молекулой амилоида, измельчают ее и затем переходят на следующую, одну за другой, позволяя каждой молекуле антитела быстро разрушать несколько амилоидных молекул. Другим является то, что каталитические антитела относятся к классу, который более эффективно переносится через гематоэнцефалический барьер, защищающий наш мозг, тогда как секвестрирующим антителам труднее преодолеть этот барьер [3].
Известно, что нерастворимые бляшки в мозге больных образованы главным образом β-амилоидным пептидом (Aβ), который имеет молекулярную массу 4 кДа и длину около 40 аминокислотных остатков. Aβ представляет собой фрагмент трансмембранного белка предшественника бета-амилоида (amyloid precursor protein, АРР), который обнаруживается во многих тканях организма, в том числе в синапсах нейронов. АРР вовлечен в некоторые физиологические процессы, связанные с нейропластичностью, образованием синапсов и нейропротекцией (выживанием нервных клеток) [4].
В отличие от своего предшественника, Aβ является токсичным для нервных клеток, способствуя их дегенерации и гибели. Он образуется путём отделения внеклеточного N-концевого домена (sAPP) белка-предщественника. Этот процесс может быть осуществлён двумя разными секретазами — α-секретазой и β-секретазой, которые имеют принципиальное различие в своём действии. В первом случае фрагментация происходит между аминокислотными остатками внутри последовательности Аβ, что предотвращает последующее образование амилоидного пептида. Во-втором, патологическом, под воздействием β-секретазы процесс фрагментации в силу своих особенностей заканчивается образованием Аβ. Этот второй путь, связанный с развитием нейропатологий, более редкий, и почему фрагментация белка-предшественника идёт по нему, остаётся не до конца ясным [5].
β-секретаза.
β-амилоид окисляет холестерин и полиненасыщенные жирные кислоты, образуя наиболее токсичные формы активные формы кислорода – гидроксильный радикал и перекись водорода. Рацемизация L-аспарагиновой кислоты в долгоживущих белках способствует формированию β-амилоида и α-синуклеина. Патологические скопления последнего наблюдаются при болезни Паркинсона, болезни Альцгеймера, болезни Леви и других нейродегенеративных заболеваниях.
Ещё одним патоморфологическим признаком нейродегенерации при болезни Альцгеймера выступают агрегаты гиперфосфорилированного тау-белка (τ-белка): парные спиральные филаменты (PHF) и нейрофибриллярные клубки (NFT). Физиологически τ-белок участвует в стабилизации микротрубочек нейронов, которые обеспечивают перенос через цитоплазму нейронов клеточных органелл, гликопротеидов и других веществ. При болезни Альцгеймера τ-белок гиперфосфорилируется, теряет нормальную способность стабилизировать микротрубочки и скапливается в клетке нерастворимыми нейротоксичными структурами. Что во время формирования патологии происходит ранее – формирование агрегатов амилоида или τ-белка – вопрос не до конца ясный. Но, очевидно, что эти два процесса взаимосвязаны и стимулируют друг друга. Так, оба патологичных белка демонстрируют прионные свойства, схожие с прионным белком PrPsc: неправильно свёрнутые формы белков по типу цепной реакции стимулируют превращение нормальных белков в неправильные в окружающих их здоровых нейронах. Между собой Аβ и τ-белок также взаимодействуют по типу прионов: описано, как Аβ активирует протеинкиназу GSK3, фосфорилируя τ-белок и вызывая его неправильный фординг [5].
τ-белок.
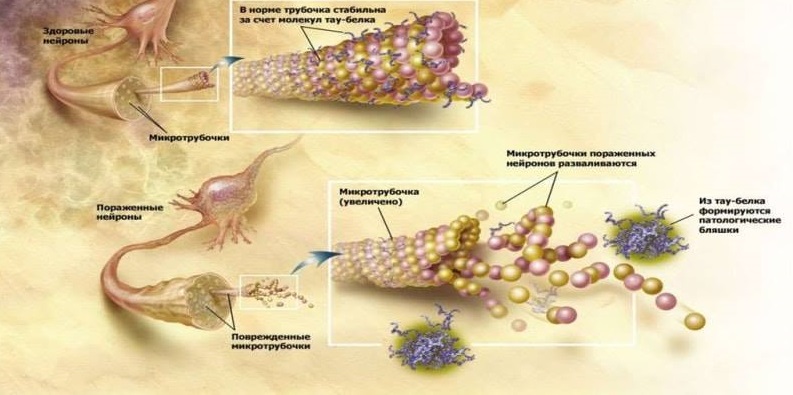
Функции τ-белка в норме и патологии.
Подтверждением инфекционности болезни Альцгеймера может служить ещё одно исследование, в котором лабораторным мышам с повышенным амилоидогенезом и обычным мышам хирургически объединили кровоток. В результате здоровые мыши начали накапливать Аβ в мозге, что вообще не характерно для этих грызунов. Это исследование впервые показало потенциальную возможность проникновения Аβ с кровью в мозг и последующее участие в развитии нейродегенерации [10].
Взаимосвязь накопления в тканях β-амилоида и τ-белка с возрастными нейропатологиями определяет необходимость поиска эффективных методов по выявлению этих белковых агрегатов как биомаркеров будущей нейропатологии и ускоренного старения. Сегодня уже известно несколько таких методов.
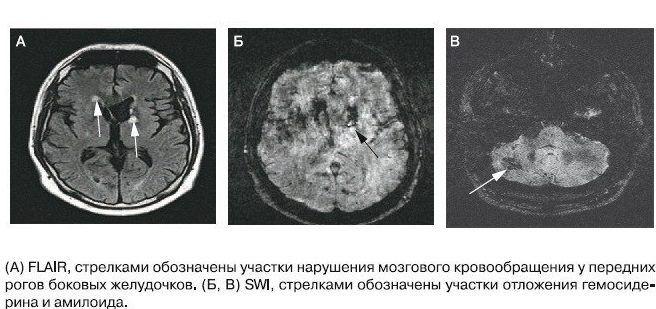
Одними из самых чувствительных биомаркеров в ранней диагностике болезни Альцгеймера и умеренных конгитивных нарушений (УКН) в переходной к патологии фазе сегодня считаются уровни амилоида Аβ-42, общего τ-белка и фосфорилированного τ-белка в спинномозговой жидкости (ликворе). Причём амилоиды при патологии показывают уменьшения уровня, а уровни в ликворе τ-белка, общего и фосфорилированного – увеличиваются. Связано это с тем, что у здоровых людей нет скоплений амилоида в виде бляшек и, потому большое количество свободного амилоида обнаруживается в ликворе. Низкие же значения τ-белка показывают отсутствие разрушения нейронального цитоскелета.
Обнаружена значительная корреляция между возрастом и замедлением выведения β-амилоида из нервной системы, что может быть связано со склерозированием лимфатических сосудов и снижением их дренажных способностей. Восстановление дренажа – один из перспективных методов лечения болезни Альцгеймера, предложен компанией Leucadia, интервью с основателем которой было переведено и опубликовано на habr.com/post/371513
2. Дворецкий Л.И., Карпова О.Ю., Александрова Е.Н., Петрова С.Ю. Амилоидоз сердца у пожилых. Архивъ внутренней медицины. 2015. № 6(26), с. 28-36.
3. AmyloSENS: Removing junk from between cells…
4. Lee, V., Goedert, M., Trojanowski, J. (2001) Neurodegenerative tauopathies, Annu. Rev. Neurosci., 24, 1121–1159.
5. Татарникова О.Г., Орлов М.А., Бабкова Н.В. Бета-амилоид и Тау-белок: структура, взаимодействие и прионоподобные свойства. Успехи биологической химии, т. 55, 2015, с. 351–390.
6. Weller, R., Yow, H., Preston, S., Mazanti, I., Nicoll, J. (2002) Cerebrovascular disease is a major factor in the failure of elimination of amyloid beta from the aging human brain, Ann. NY Acad. Sci., 977, 162–168.
7. Nalivaeva, N., Fisk, L., Belyaev. N., Turner, A. (2008) Amyloid-degrading enzymes as therapeutic targets in Alzheimer’s disease, Curr. Alzheimer Res., 5, 212–224.
8. Fisk, L., Nalivaeva, N., Boyle, J., Peers C., Turner A. (2007) Effects of hypoxia and oxidative stress on expression of neprilysin in human neuroblastoma cells and rat cortical neurons and astrocytes, Neurochem. Res., 32, 1741–1748.
9. Jaunmuktane Z., Mead S., Ellis M., Wadsworth J. D. F., Nicoll A. J., Kenny J., et al.. (2015). Evidence for human transmission of amyloid-β pathology and cerebral amyloid angiopathy. Nature 525, 247–250.
10. X-L Bu, Y Xiang, W-S Jin, J Wang, L-L Shen, Z-L Huang, K Zhang, Y-H Liu, F Zeng, J-H Liu, H-L Sun, Z-Q Zhuang, S-H Chen, X-Q Yao, B Giunta, Y-C Shan, J Tan, X-W Chen, Z-F Dong, H-D Zhou, X-F Zhou, W Song & Y-J Wang. Blood-derived amyloid-β protein induces Alzheimer’s disease pathologies. Molecular Psychiatry. 2017.
11. В.Ю. Лобзин, А.Ю. Емелин, Л.А. Алексеева. Ликворологические биомаркеры нейродегенерациив ранней диагностике когнитивных нарушений. Вестник Российской военно-медицинской академии. 2013, №4, с. 15-20.
12. Blennow, Kaj, and Henrik Zetterberg. «Biomarkers for Alzheimer disease–current status and prospects for the future.» Journal of internal medicine (2018).
13. Nabers, Andreas, et al. «Amyloid blood biomarker detects Alzheimer’s disease.» EMBO molecular medicine (2018).
Источник


