Эта статья является логическим продолжением предыдущего поста, посвящённого устройству мозга, шизофрении и методам борьбы с ней. Перед чтением нижеследующего текста имеет смысл ознакомиться с содержанием предыдущей части, без этого может быть непонятно.
tl;dr: В статье рассказано о депрессии о том, что она представляет собой на уровне психофармакологии, а также о некоторых препаратах, используемых для её лечения.
Disclaimer: как всегда, автор предупреждает читателей о том, что он не психиатр, а псих, и изложенную в статье информацию ни в коем случае нельзя использовать как основу для постановки диагнозов и принятия решений о начале, прекращении или изменения порядка приёма каких-либо препаратов. Медицинские назначения должен делать квалифицированный врач, и по любым вопросам, касающимся лечения, имеет смысл обращаться к нему за консультацией.
Тем не менее, автор статьи перепробовал многие из описанных препаратов на себе, а также наблюдал их действие на собратьях по несчастью, поэтому основные тезисы статьи подтверждены не только источниками, но и [заведомо нерелевантным[4], но зато живым] личным опытом.
Заинтересовавшихся прошу под кат.
Аффективные расстройства
Они же — расстройства настроения. В МКБ идут под номерами F30 — F39[5]. Включают в себя депрессии, мании и их чередования (БАР, циклотимию и прочее). Общего у этих расстройств, несмотря на кажущиеся различия (кто видел депрессивных и маниакальных больных непременно отметить, насколько различно в них всё — облик, мышление, поведение), довольно много: во-первых, они приводят к тому, что настроение больного становится неадекватным, во-вторых, они имеют сходную фармакологическую природу и, соответственно, лечатся зачастую одними и теми же препаратами, в-третьих, могут «перетекать» из одного в другое (например, то, что было неверно диагностировано как депрессивный эпизод — F32, может на самом деле оказаться БАРом — F31).
Поэтому мы будем рассматривать их все в рамках одного раздела, обращая внимание на различия там, где это необходимо. В рамках этого поста мы рассмотрим депрессию, а другие аффективные расстройства оставим в качестве темы будущих статей.
Депрессия

Пожалуй, самое известное из аффективных расстройств. Как и многие другие термины из психиатрии, слово «депрессия» нашло довольно широкое применение в разговорном языке[6], где потеряло свою терминологическую точность: «Ах, у меня депрессия, — томно вздыхают барышни, — вчера он ушёл от меня».
Сюрпризом для многих станет тот факт, что абсолютное большинство случаев употребления этого термина в быту — некорректно. Депрессия — это не плохое настроение, не горе, не подавленность и не усталость. Всё вышеперечисленное может быть симптомами депрессии, но не составляет её сути[7].
Классическое определение депрессии предполагает наличие т.н. «депрессивной триады»[8]. Первым её компонентом является ангедония — снижение способности получать удовольствие: то, что раньше нравилось человеку, перестаёт нравиться и радовать: ни сон, ни еда, ни секс, ни достижения в карьере — ничто не вызывает эмоционального подъёма, ничто не является субъективно значимым и желательным.
Второй компонент — это нарушения мышления. Это не те нарушения мышления, которые бывают при шизофрении, а свои, специфически депрессивные. Во-первых, в случаях тяжелой депрессии обычно наблюдается снижение темпа мышления. Во-вторых, для депрессии характерны определённые паттерны мышления, определяющие пессимистичность суждений, их самообвиняющий характер.
Третий компонент — это двигательная заторможенность: больной тяжело, медленно и неохотно двигается.
Следует отметить, что существуют больные, у которых не все компоненты триады явно выражены, но которые, тем не менее, страдают депрессией в той или иной её форме[9]. Лично мне близка позиция Бека, который основным и определяющим компонентом депрессии считает именно когнитивные искажения[10], а все остальные особенности выводит уже из них.
Чем депрессия отличается от горя и других неприятных, но нормальных состояний? Своей неадекватностью. Дело в том, что, само по себе, горе не обязательно является чем-то патологическим, и может быть вполне адекватным ответом на произошедшие события[6]. Например, если у человека умер любимый хомячок, к которому тот был привязан, наличие признаков депрессивной триады в течение нескольких дней после этого события ещё не повод утверждать о том, что он (человек) страдает депрессией.
Однако если со времени неприятного события прошли годы, человек давно завёл нового хомячка, его дочь счастливо вышла замуж и родила внука, самого человека недавно повысили на любимой работе, и он успешно завершил сложный проект, однако все его мысли всё равно крутятся вокруг умершего питомца, он целыми днями занимается самообвинениями и ничто не доставляет ему удовольствия, а вставать утром с постели стало безумно тяжело, то имеет смысл отправить такого человека к специалисту: вполне возможно, у него развилась депрессия.
Хорошее видео о том, что такое депрессия, есть на TED-ED:
Теперь, когда мы определили, что представляет собой депрессия, можно поговорить о её причинах. В рамках этой статьи мы не станем рассматривать психологические аспекты депрессии (об этом — в следующих статьях), а сосредоточимся на биохимии мозга.
Как это часто бывает в психиатрии, единого мнения о том, что же такое депрессия на нейрохимическом уровне, в литературе до сих пор нет[9]. Есть лишь некоторое количество более или менее распространённых гипотез и доказательств в пользу каждой из них.
Исторически первым было предположение о том, что депрессия напрямую связана с недостатком определённых нейромедиаторов, в частности серотонина и норадреналина[7,9].
Основания для выдвижения этой гипотезы достаточно просты и прозрачны: препараты, которые влияют на обратный захват, релиз или разрушение этих нейромедиаторов, приводят к улучшению состояния, по крайней мере, некоторых депрессивных пациентов.
А препараты, снижающие количество серотонина и норадреналина, наоборот вызывают депрессивные симптомы.
Моноаминовую гипотезу можно наглядно представить в виде следующей картинки, в левой части которой отображается нормальное состояние, а в правой — депрессия (нейромедиатор показан в виде треугольников):
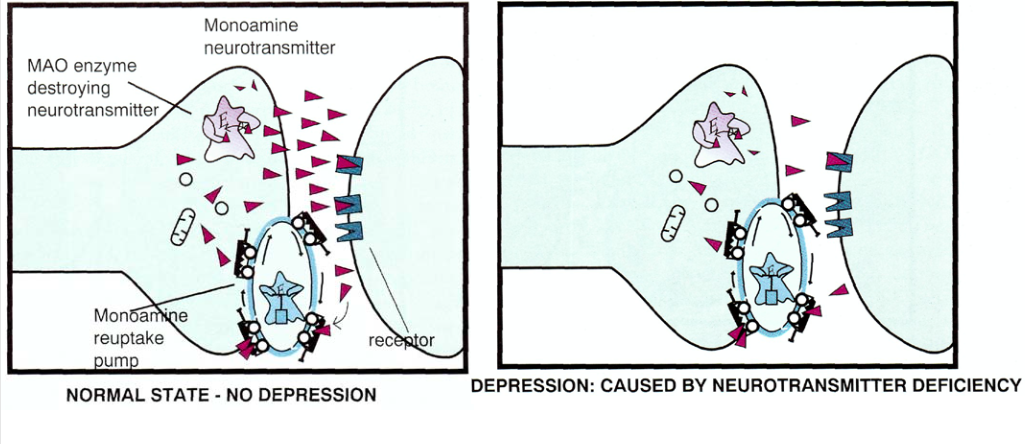
В прошлой статье, когда речь шла о шизофрении, мы говорили, в основном, о дофамине, теперь же речь пойдёт о серотонине и норадреналине.
Начнём с последнего. Итак, у нас в мозге есть норадренергические нейроны, т.е. такие, которые в качестве средства передачи сигнала используют нейромедиатор норадреналин. Основным скоплением таких нейронов в мозге является т.н. голубоватое пятно (locus coeruleus)[11]:

Оно является частью ретикулярной формации и расположено в стволе мозга на уровне моста. Аксоны его нейронов восходят к верхним слоям коры больших полушарий, гиппокампу, миндалине, перегородке, стриатуму, коре мозжечка. Нисходящие проекции идут в спинной мозг к симпатическим и мотонейронам.

Некоторые из этих проекций (отростков нейронов из голубоватого пятна, тянущихся к другим областям мозга) имеют большое значение в формировании (и лечении) депрессивной симптоматики.
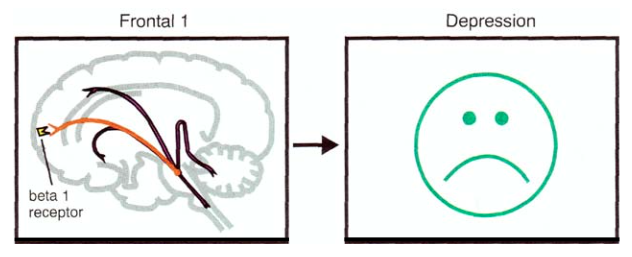
Так, например, одна из проекций в префронтальную кору головного мозга отвечает за регулирование настроения[9]:
Другая — за воздействие норадреналина на внимание:

Проекция в лимбическую систему влияет на эмоции, энергичность, усталость и психомоторную активность:

Проекция в мозжечок может быть ответственна за регуляцию моторной активности и наличие / отсутствие тремора:

Основная функция голубоватого пятна — определять, на что будет обращено внимание: на внешние стимулы или на внутренние ощущения[9]. Кроме того, оно играет важную роль в процессах познания и контроле настроения. А если мы вспомним, что для депрессии характерно снижение когнитивных и мнестических способностей, ухудшение способности к произвольной концентрации внимания, а также, собственно, неадекватное настроение[8], то станет понятно, почему голубоватое пятно имеет значение в этиологии и лечении депрессии.
У каждого норадренергического нейрона есть рецепторы (чем-то же он должен принимать сигналы от своих собратьев и контролировать собственный релиз нейромедиатора). Эти рецепторы можно поделить, во-первых, на пре- и постсинаптические (в зависимости от расположения), а, во-вторых, на альфа- и бета- подтипы, которые потом делятся по опосредуемым эффектам, локализации, а также аффинитету к различным веществам на α1-, α2-, β1-, β2, β3-адренорецепторы[9].
Для нас здесь важным является то, что постсинаптические α1-, α2-, β1-рецепторы являются основными каналами для передачи сигнала, а пресинаптические α2-рецепторы обеспечивают отрицательную обратную связь: когда в синаптической щели норадреналина слишком много, он связывается с этими рецепторами, и нейрон перестаёт релизить этот нейромедиатор[12]. Соответственно (и это важно для лечения), если мы заблокируем этот рецептор антагонистом, то мы таким образом «сломаем тормоз», и количество норадреналина в синаптической щели увеличится. На этом принципе основана работа некоторых антидепрессантов, но об этом — далее.
Разобравшись немного с норадренергической передачей, перейдём к рассмотрению серотонинергической. Как следует из названия, она имеет отношение к нейронам, использующим в качестве мессенджера серотонин. Такие нейроны имеют свои рецепторы, которые тоже можно поделить на пре- и постсинаптические. К первым относятся 5HT1A и 5HT1D. Ко вторым, соответственно, 5HT1A (один и тот же вид рецептора может быть и пре-, и постсинаптическим), 5HT1D, 5HT2A (привет, психонавты!), 5HT2C, 5HT3, и 5HT4[9].
Пресинаптические рецепторы, как и в случае норадренергических нейронов, описанных выше, выполняют функцию обеспечения отрицательной обратной связи: когда серотонина в синаптической щели становится много, его молекула связывается с пресинаптическим рецептором, и нейрон прекращает его выделений и, соответственно, передачу импульса.
Пресинаптические рецепторы 5HT1D и 5HT1A в этом контексте отличаются тем, что первый тормозит релиз серотонина, а второй — прекращает вовсе. Нам это интересно в том контексте, что вещества, являющиеся антагонистами 5HT1D-рецептора, могут способствовать усилению серотонинергической передачи.
Дальше — чудесатее и чудесатее. Серотонинергический нейрон имеет в качестве пресинаптических не только серотонинергические, но и норадринергические рецепторы[9]. Это означает, что концентрация норадреналина влияет на релиз серотонина. Как и в случае норадринергических нейронов, речь идёт о α2-рецепторах. А это значит, что лекарство, которое блокирует эти рецепторы (их антагонист) будет увеличивать не только норадренергическую, но и серотонинергическую передачу. Так работает, например, миртазапин.
Но и это ещё не всё. На поверхности тела серотонинергического нейрона находятся α1-рецепторы (тоже норадренергические), которые работают не как «тормоз», а как «педаль акселератора», обеспечивая положительную обратную свзязь: соединяясь с таким рецептором, молекула норадреналина (или любого другого агониста) усиливает выпуск нейроном серотонина и, соответственно, передачу импульса[12].
Серотонинергические нейроны группируются в стволе мозга: в варолиевом мосту и ядрах шва. Проекции этих нейронов в кору влияют на настроение (т.е. напрямую связаны с рассматриваемыми здесь аффективными расстройствами)[9]:

Проекции в базальные ядра влияют на движения, а также на обсессии и компульсии (именно поэтому антидепрессанты группы СИОЗС применяют для лечения обсессивно-компульсивного расстройства[13]).
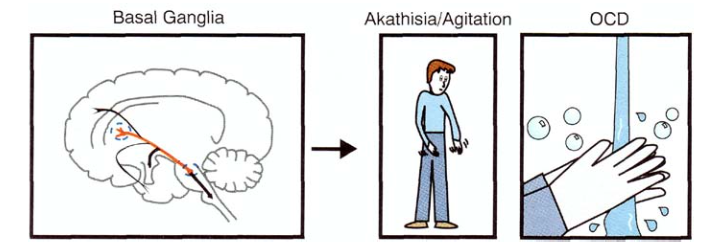
Проекции в лимбическую систему связаны с тревожностью и паникой (особую роль в этом играют рецепторы 5HT2A и 5HT2C),

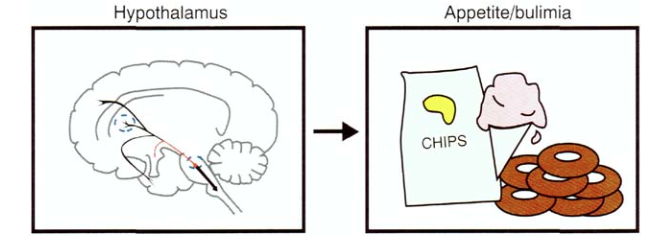
а проекции в гипоталамус — с регуляцией аппетита и пищевого поведения (СИОЗСы используются и для лечения булимии за счет воздействия на рецепторы 5HT3):
Проекции в промежуточный мозг ответственны за бессонницу (которая часто бывает при депрессии), и снова главную роль здесь играют рецепторы 5HT2A:
И, наконец, о грустном: проекции в спинной мозг ответственны за возникновение эректильной дисфункции (частый побочный эффект от приема СИОЗС, наряду со снижением либидо):
Итак, суммируя всё вышесказанное, можно сделать вывод о том, что дефицит серотонина приведёт к депрессии, тревожности, паническим явлениям, может спровоцировать фобии, обсессии, компульсии и даже вызвать обжорство.
И, наконец, дофамин. Подробно роль дофамина и дофаминергические путей разобрана в предыдущей части статьи, здесь мы кратко ограничимся описанием роли этого нейромедиатора и соответствующих нейронов в этиологии и лечении депрессии.
Начнем с того, что на сегодняшний день установлена связь депрессии с наличием дефицита дофаминергической передачи, а также, что агонисты (или частичные агонисты) дофаминовых рецепторов могут быть полезны для лечения депрессивных состояний[1]. Существуют свидетельства того, что при депрессии повышается плотность D2-рецепторов[2], что тоже указывает на то, что их агонисты или ингибиторы обратного захвата дофамина могут быть полезны при депрессии. Кроме того, лекарства, повышающие уровень дофаминергической передачи, помогают при апатии и отсутствии энергии[3], а также при абулии, которая тоже характерна для некоторых депрессивных пациентов.
В целом же разбивку нейромедиаторов по эмоциям можно представить в виде вот такой картинки[3]:

А лекарства, используемые для её лечения, соответственно, в виде вот такой[3]:
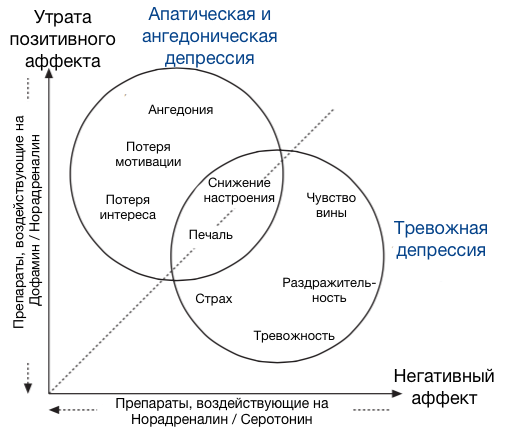
Тут следует отметить, что моноаминовая гипотеза в настоящее время считается несколько «наивной», и на самом деле там все гораздо сложнее — имеют место сложные процессы регуляции плотности рецепторов и механизмов экспрессии генов, но это всё выходит за рамки нашей статьи. Для понимания основ функционирования антидепрессантов на концептуальном уровне моноаминовой гипотезы вполне достаточно.
Лекарства для лечения депрессии
Ингибиторы МАО
Исторически, это первые антидепрессанты[7]. Прежде, чем говорить о них подробно, необходимо рассказать в двух словах о том, что такое это самое МАО.
Итак, в нейроне синтезируются нейромедиаторы, о чем было рассказано в предыдущей части статьи. Однако параллельно с процессом синтеза этих самых катехоламинов происходит и обратный процесс — их разрушение.
В этом процессе ключевую роль играет фермент моноаминоксидаза (она же — МАО), которая, собственно, разрушает серотонин, норадреналин и дофамин (и много чего ещё)[14]. Наглядно это можно представить примерно так:

Так вот, идея заключается в том, чтобы этот процесс разрушения остановить путём ингибирования моноаминоксидазы, тем самым увеличивая количество нейромедиаторов и повышая уровень соответствующей передачи (ингибиторы МАО повышают сразу и серотонинергическую, и дофаминергическую, и норадренергическую передачу, именно поэтому они так эффективны, и именно поэтому у них столько побочек)[9].
Моноаминоксидаза бывает двух типов: МАО-A и MAO-B. Они довольно похожи (аминокислотные последовательности этих белков совпадают на 70%), но отличаются по своим функциям: MAO-A расщепляет адреналин, норадреналин, серотонин, гистамин, дофамин а также многие фенилэтиламиновые и триптаминовые ПАВ, в то время как MAO-B «работает» с фенилэтиламином и дофамином[15].
Соответственно, варьируя тип моноаминоксидазы, который будет ингибироваться, можно влиять на то, количество каких нейромедиаторов будет повышаться.
Как и многие другие изобретения, первый антидепрессант из группы ингибиторов МАО был «открыт» случайно[16]: изначально собирались сделать препарат для лечения туберкулёза (ипрониазид), но вскоре после того, как его начали назначать больным, стало заметно, что их настроение меняется: у некоторых оно просто улучшалось, у других же возникала расторможенность и даже антисоциальное поведение[9].
Такое влияние на настроение быстро привлекало к препарату внимание психиатров, которые решили попробовать дать его депрессивным больным и заметили существенное улучшение их состояния.
В настоящее время ипрониазид не используется из-за высокой токсичности и большого количества побочных эффектов, на его место пришли новые, более современные и совершенные лекарства. По своим фармакологическим свойствам они делятся на обратимые и необратимые, селективные и неселективные.
Обратимые ингибиторы МАО (ИМАО) связываются с МАО и образуют относительно стабильные химические комплексы, которые со временем распадаются, после чего фермент снова обретает способность выполнять свою функцию. Необратимые связываются с ним очень прочно и лишают молекулу МАО способности расщеплять соответствующие вещества навсегда (пока не будут синтезированы новые молекулы, которые не успели связаться с необратимым ИМАО)[9].
Селективные ИМАО связываются с каким-то определенным типом МАО (MAO-A или MAO-B), неселективные, соответственно, связываются со всеми типами.
Соответственно, подбирая нужный тип ИМАО, психиатр может достигать желаемого воздействия на больного.
Однако следует отметить, что сегодня этот класс антидепрессантов используется сравнительно редко из-за высокого риска побочных эффектов, вызванных достаточно широким спектром фармакологических изменений, вызываемых этими лекарствами[7,9].
Поэтому, когда есть возможность, врачи предпочитают использовать более узконаправленные препараты: трициклические антидепрессанты, селективные ингибиторы обратного захвата моноаминов и другие препараты.
К типичным ИМАО, используемым сегодня можно отнести моклобемид, пиразидол, инказан.
Трициклические антидепрессанты

Этот класс препаратов получил своё название не благодаря фармакологическому эффекту, а в следствие химического строения молекул, каждая из которых имеет три кольца (см. картинку выше).
По фармакологическому действию трициклики могут довольно сильно отличаться друг от друга, однако все они ингибируют обратный захват моноаминов: каких в большей, а каких в меньшей степени — зависит от конкретного препарата[9].
Трициклические антидепрессанты впервые были синтезированы примерно в то же время, что и ИМАО и тоже не были разработаны как антидепрессанты изначально: пытались сделать антипсихотик, получили имипрамин (первый трициклический антидепрессант), разочаровались в нем как в нейролептике, а потом обнаружили антидепрессивную активность этого вещества: шизофреники, которым его давали, не демонстрировали уменьшения симптомов самой шизофрении, зато показывали улучшение в отношении симптомов депрессии, которая часто ей коморбидна[9,16].
Как было сказано выше, трициклики блокируют обратный захват нейромедиаторов, чем и обусловлен их терапевтический эффект. Однако это ещё не всё: помимо, собственно, блокировки обратного захвата, все трициклики производят, по крайней мере, одно из следующих воздействий: они блокируют мускариновые холинергические рецепторы, блокируют H1 гистоминовые рецепторы и блокируют α1-адренергические рецепторы. Этот аспект работы трицикликов определяет характерные для них побочные эффекты — гипотензию, тошноту, сухость во рту, ухудшение зрения, трудности при мочеиспускании, головокружение и проблемы с памятью.
Типичные представители: имипрамин, амитриптилин, кломипрамин.
Ингибиторы обратного захвата моноаминов
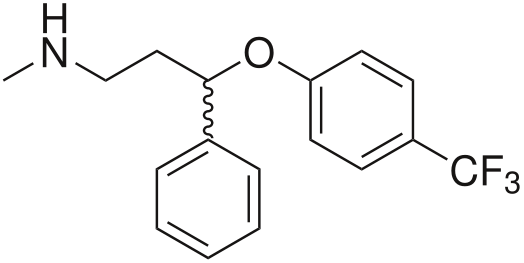
Ещё более современным и «продвинутым» классом препаратов являются селективные ингибиторы обратного захвата моноаминов. Они называются селективными потому, что, в отличие от трицикликов, которые блокируют обратный захват всех основных нейромедиаторов, эти препараты влияют на процесс обратного захвата одного-двух из них.
Самым известным препаратом этой группы является флуоксетин («Прозак»), который относится к подклассу селективных ингибиторов обратного захвата серотонина (СИОЗС).
Одним из наиболее перспективных современных антидепрессантов является венлафаксин, который интересен своим фармакологическим профилем[17]: в зависимости от дозировки он может выступать как селективный ингибитор обратного захвата: 1. серотонина; 2. серотонина и норадреналина; 3. серотонина, норадреналина и дофамина. При этом в последнем случае его действие похоже на работу трицикликов, однако без характерных для последних побочек.
Ещё одним интересным и уникальным по своему фармакологическому воздействию препаратом является бупропион[18]: его фишка в том, что, в отличие от большинства антидепрессантов этой группы, которые влияют на обратный захват серотонина (иногда — серотонина и норадреналина), бупропион воздействует на транспортеры дофамина и норадреналина. Это позволяет использовать его для лечения тяжелых случаев апатических депрессий. Но в то же время делает его почти бесполезным в борьбе с ангедонией.
А ещё он является антагонистом никотиновых рецепторов[19], поэтому его используют как средство для борьбы с табакокурением.
Интересным фактом является и то, что некоторые СИОЗСы применяются не только для лечения депрессии, но и для терапии обсессивно-компульсивного расстройства[13], различных тревожных расстройств и даже булимии[20,21] (см. раздел про серотонин и его воздействия на организм).
Тетрациклические антидепрессанты
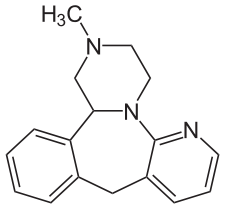
Как и трициклики, эти препараты получили своё название не благодаря фармакологическим свойствам, а в следствие своего строения. Однако на этом сходство между трициклическими и тетрациклическими антидепрессантами заканчивается — механизмы работы у них принципиально различны[9].
Если терапевтический эффект трицикликов основан, в основном, на ингибировании обратного захвата моноаминов, то здесь это лишь второстепенный фактор. Главное — это блокирование «тормозных» пресинаптических α2-адренорецепторов с одновременным блокированием постсинаптических серотониновых 5-HT2 и 5-HT3 рецепторов[7].
Первым действием достигается увеличение серотонина и норадреналина в синапсах (помните, мы говорили про то, что α2-адренорецепторы обеспечивают отрицательную обратную связь и работают как «тормозной механизм»?); вторым — обеспечивается снижение неприятных побочных «серотониновых» эффектов: сексуальных расстройств, бессонницы и тревоги, тошноты и рвоты, понижения аппетита, анорексии.
Типичным представителем этой группы является миртазапин («Ремерон»), структурная формула которого изображена на картинке выше.
Антипсихотики для аугментации

Про антипсихотики мы говорили довольно подробно в предыдущей части, здесь же стоит упомянуть только том, что некоторые атипики[22,23] (например, амисульприд) с успехом используются для лечения депрессии — в монотерапии или в сочетании с антидепрессантами.
Механизм действия здесь простой: антипсихотик блокирует пресинаптические дофаминовые D2 и D3 ауторецепторы (т.е. рецепторы, обеспечивающие отрицательную обратную связь), тем самым потенцируя повышение релиза дофамина в синаптическую щель.
NSI-189

Новейший антидепрессант, ещё не вышедший на рынок. Обладает крайне интересным механизмом действия: не ингибирует обратный захват, не блокирует рецепторы, а запускает механизмы нейрогенерации в гиппокампе[24] — области лимбической системы, которая отвечает в т.ч. за формирование эмоций, консолидацию памяти и генерацию тета-ритмов при удержании внимания:

Конкретный механизм антидепрессивного действия этого препарата пока неизвестен, но он есть.
Личный опыт
Как всегда, закончить пост хочу описанием неверифицируемого и заведомо непоказательного личного опыта приёма антидепрессантов.
Далее было прикольное сочетание флуоксетина и флувоксамина («Феварин») в максимальных дозировках. Сначала просто не хотелось есть и заниматься сексом. Вообще. Я в это время был в психушке, где и еда невкусная и для совокуплений условия, мягко говоря, неподходящие, поэтому эти эффекты показались мне полезными.
Но потом, по мере накопления эффекта от препаратов, я всё больше стал осознавать собственную офигенность, а также потерял потребность во сне. Однажды, после почти суток без сна в дурдоме я вышел в коридор и понял: ночевать я тут не хочу. Движимый мыслью о том, что такой офигенный чувак, как я, непременно сможет убедить психиатра в том, что среди психов ему не место, я пошел к доктору.
Я не знаю, чем она думала, но она выписала мне бумажку, дающую право на то, чтобы покинуть отделение на неделю. Мне. В гипо-, а может, и полноценном маниакальном состоянии.
За эту неделю я успел: наделать долгов, обдоблбаться в присутствии сотрудника наркоконтроля, поспать два раза по полтора часа, затопить соседей, бухнуть с любовником бывшей жены, поругаться с очень хорошей подругой, сходить со своим мед.психологом из той самой психушки «в горы» (в кавычках потому, что гор в Приморье нет, есть сопки), постричься налысо (для меня это вообще что-то за гранью) и совершить кучу других совершенно для меня не характерных, я бы даже сказал — безумных, действий. До сих пор удивляюсь, как меня смогли остановить от забега на 120 км., который я хотел совершить нонстопом.
А ещё — словить серотониновый синдром вдали от цивилизации и любых средств, которыми его можно было бы купировать. В общем, интересное сочетание СИОЗСов даёт интересные эффекты. Не повторяйте, это опасно.
Потом был венлафаксин, о котором могу сказать две вещи: не понимаю, почему врач ограничился средней дозировкой, когда явно была нужна максимальная (чтобы зацепить дофаминку), и что с него было очень трудно слезть. Синдром отмены выражался в тревожности, очень плохом настроении и ощущении, что тебя уронили с высоты метра два, повторяемом с частотой несколько раз в минуту.
Затем был бупропион с милнаципраном (СИОЗСН). Ах, этот прекрасный коктейль, на котором музыка звучит так приятно, так осязаемо, на котором одежда прохожих начинает ярко светиться, а сами они становятся необыкновенно красивыми людьми! А то, что ты при этом делаешь кучу орфографических ошибок в текстах, что забываешь выполнить элементарные гигиенические действия — это ерунда, ведь ты так прекрасен! В общем, снова улет в [гипо]манию. Но при уменьшении дозировки — это же самое сочетание (там ещё был амисульприд, но это нейролептик, а не антидепрессант) просто давало силы жить и действовать, и на сегодня я могу признать его лучшим из того, что мне доводилось пробовать.
Последняя схема из бупропиона и миртазапина мне понравилась снижением тревожности и улучшением качества сна. Но, к сожалению, как и предыдущую схему, эту пришлось забросить по экономическим причинам, которые к теме статьи отношения не имеют.
В целом хочу сказать, что в правильно подобранных антидепрессантах ничего плохого нет, и хороший врач вполне может уменьшить количество нежелательных побочных эффектов практически до нуля, для этого современная психофармакология предлагает ему достаточно много средств.
Литература
1. Paul Willner, Dopamine and depression: A review of recent evidence. I. Empirical studies, Brain Research Reviews, Volume 6, Issue 3, December 1983, Pages 211-224, ISSN 0165-0173, doi.org/10.1016/0165-0173(83)90005-X.
2. Hugo A. D’haenen, Axel Bossuyt, Dopamine D2 receptors in depression measured with single photon emission computed tomography, Biological Psychiatry, Volume 35, Issue 2, 15 January 1994, Pages 128-132, ISSN 0006-3223, doi.org/10.1016/0006-3223(94)91202-5.
3. Nutt DJ. Relationship of neurotransmitters to the symptoms of major depressive disorder. J Clin Psychiatry. 2008;69 Suppl E1 4-7. PMID: 18494537.
4. 4. Основы доказательной медицины. Учебное пособие для системы послевузовского и дополнительного профессионального образования врачей./Под общей редакцией акаде- мика РАМН, профессора Р.Г.Оганова.– М.: Силицея-Полиграф, 2010. – 136 с.
5. МКБ-10. Перевод на русский язык.
base.garant.ru/4100000
6. 6. Н. Мак-Вильямс. Психоаналитическая диагностика: понимание структуры личности в клинич. процессе: [учеб. пособие по специальности «Психотерапия и мед. психология»];
7. Шацберг А.Ф. Руководство по клинической психофармакологии / Алан Ф. Шацберг, Джонатан О. Коул, Чарлз ДеБаттиста; пер. с англ.; под общ. ред. акад. РАМН А.Б.Смулевича, проф. С.В.Иванова. – 2-е изд. – М.: МЕДпресс-информ, 2014. – 608 с.: ил. ISBN 978-5-00030-101-2
8. Бобров А.С. Эндогенная депрессия. — Иркутск: РИО ГИУВа, 2001. — 384 с.
9. Stahl, S. M. Essential psychopharmacology: neuroscientific basis and practical application / Stephen M. Stahl; with illustrations by Nancy Muntner.—2nd ed. p.; cm. ISBN 0-521-64154-3 (hardback)—ISBN 0-521-64615-4 (pbk.)
10. А. Бек, А. Раш, Б. Шо, Г. Эмери. Когнитивная терапия депрессии. Изд-во Питер, 2003. ISBN: 5-318-00689-2, 0-89862-919-5
11. АНАТОМИЯ ГОЛОВНОГО МОЗГА ЛЕКЦИЯ 4. СРЕДНИЙ МОЗГ (mesencephalon ) — Анатомия головного мозга — Медицинская библиотека.
www.nedug.ru/library/анатомия_головного_мозга/АНАТОМИЯ-ГОЛОВНОГО-МОЗГА-ЛЕКЦИЯ-СРЕДНИЙ#.WRQpVVJeOu5
12. Ф. Хухо. Нейрохимия. Основы и принципы. М.: Мир, 1990. ISBN 5-003-001030-0
13. Cochrane evidence. Selective serotonin re-uptake inhibitors (SSRIs) versus placebo for obsessive compulsive disorder (OCD).
www.cochrane.org/CD001765/DEPRESSN_selective-serotonin-re-uptake-inhibitors-ssris-versus-placebo-for-obsessive-compulsive-disorder-ocd
14. Berry M. D., Juorio A. V., Paterson I. A. The functional role of monoamine oxidases A and B in the mammalian central nervous system. (англ.) // Progress in neurobiology. — 1994. — Vol. 42, no. 3… — PMID 8058968
15. Tipton KF, Boyce S, O’Sullivan J, Davey GP, Healy J (August 2004). „Monoamine oxidases: certainties and uncertainties“. Current Medicinal Chemistry.: 1965–82. doi:10.2174/0929867043364810. PMID 15279561
16. Robert A. Maxwell; Shohreh B. Eckhardt (1990). Drug discovery. Humana Press. ISBN 0-89603-180-2. ISBN 9780896031807
17. Redrobe JP, Bourin M, Colombel MC, Baker GB (July 1998). „Dose-dependent noradrenergic and serotonergic properties of venlafaxine in animal models indicative of antidepressant activity“. Psychopharmacology. 138 (1): 1–8. doi:10.1007/s002130050638. PMID 9694520.
18. Stahl SM, Pradko JF, Haight BR, Modell JG, Rockett CB, Learned-Coughlin S. A Review of the Neuropharmacology of Bupropion, a Dual Norepinephrine and Dopamine Reuptake Inhibitor. Primary Care Companion to The Journal of Clinical Psychiatry. 2004;6(4):159-166.
19. Slemmer J E, Martin R M, Damaj M I (2000). «Bupropion is a Nicotinic Antagonist». J Pharmacol Exp Ther 295 (1): 321–327. PMID 10991997
20. Cochrane evidence. Antidepressants compared with placebo for bulimia nervosa.
www.cochrane.org/CD003391/DEPRESSN_antidepressants-compared-with-placebo-for-bulimia-nervosa
21. Long-term fluoxetine treatment of bulimia nervosa. Fluoxetine Bulimia Nervosa Research Group. D J Goldstein, M G Wilson, V L Thompson, J H Potvin, A H Rampey. The British Journal of Psychiatry May 1995, 166 (5) 660-666; DOI: 10.1192/bjp.166.5.660
22. Noble, S; Benfield, P (December 1999). „Amisulpride: A Review of its Clinical Potential in Dysthymia“. CNS Drugs. 12 (6): 471–483. doi:10.2165/00023210-199912060-00005
23. Komossa K, Depping AM, Gaudchau A, Kissling W, Leucht S. Second-generation antipsychotics for major depressive disorder and dysthymia. Cochrane Database of Systematic Reviews 2010, Issue 12. Art. No.: CD008121. DOI: 10.1002/14651858.CD008121.pub2.
24. Roger S. McIntyre, Karl Johe, Carola Rong & Yena Lee. The neurogenic compound, NSI-189 phosphate: a novel multi-domain treatment capable of pro-cognitive and antidepressant effects. Expert Opinion on Investigational Drugs. Published online: 08 May 2017
Источник



