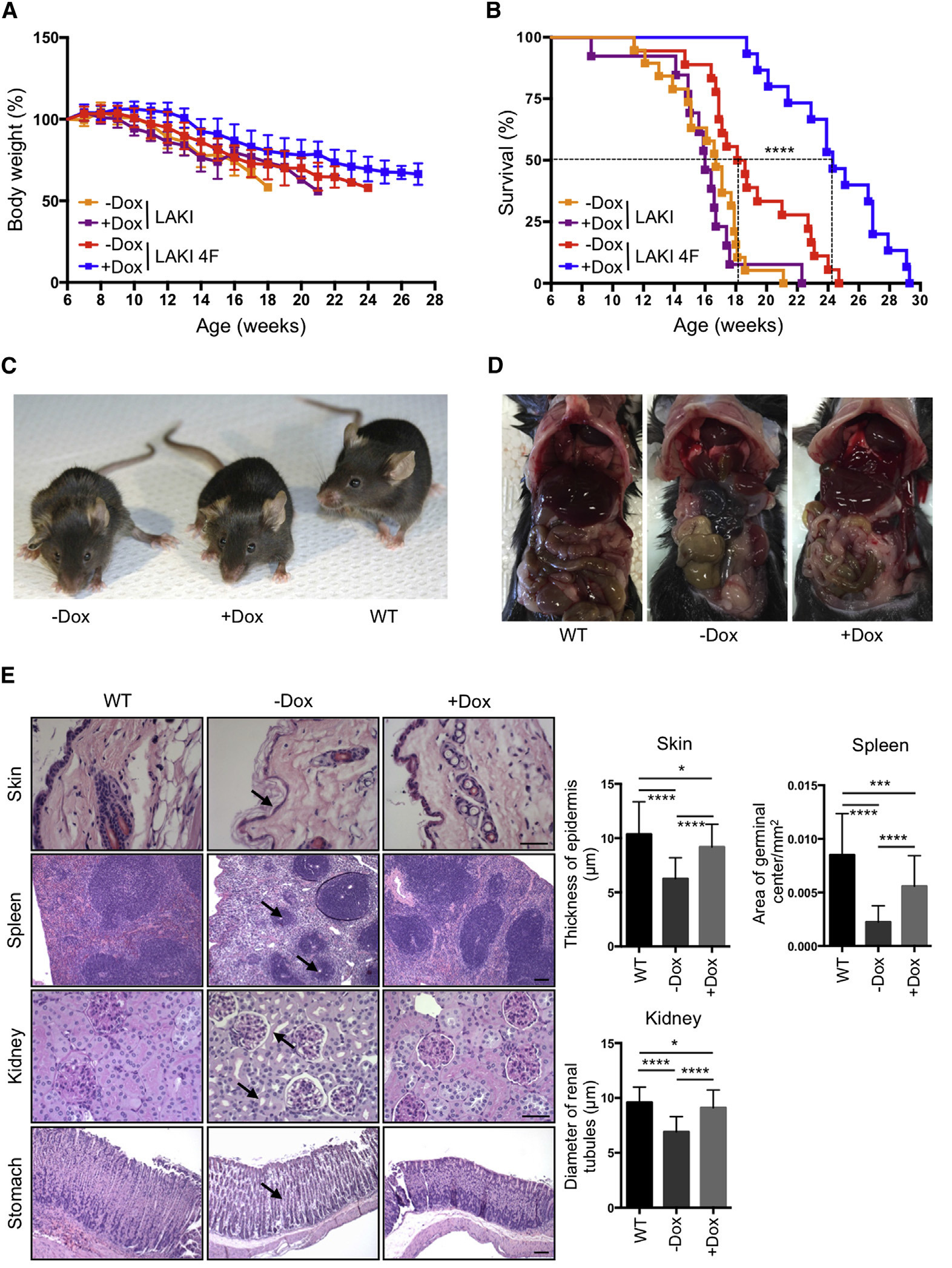
Сравнительное состояние мышей. У генетически изменённой мыши +Dox состояние гораздо лучше, чем у мыши −Dox того же возраста. В эксперименте участвовали мыши с редким генетическим заболеванием — синдромом Хатчинсона-Гилфорда, который вызывает преждевременное старение. Таких мышей взяли для удобства, чтобы быстрее наступило старение и проявились результаты клеточного перепрограммирования
Старение тела увеличивает риск развития многих болезней и смерти. Поэтому учёные давно ищут способы изменить биологически программы организма, чтобы продлить молодость и отсрочить наступление старости. Возможно, в перспективе удастся предотвратить наступление старости вообще, что значительно снизит риски заболеваний и увеличит среднюю продолжительность жизни наиболее достойных людей.
Предыдущие исследования «в пробирке» (in vitro) показали, что возможность омоложения клеток действительно есть. Это показали с помощью клеточного перепрограммирования, то есть с помощью индуцированных стволовых клеток, полученных из плюропотентных клеток путём эпигенетического программирования.
Лабораторные опыты in vitro подтвердили факт омоложения, а сейчас учёные впервые провели опыт на живых существах, то есть внутри живого организма (in vivo). В хорошо изученной области клеточного перепрограммирования ничего фундаментально нового американские учёные не изобрели, но зато теперь своими глазами можно сравнить старую живую мышь с омоложенной живой мышью того же биологического возраста (см. фото C на иллюстрации вверху). Переход от опытов «в пробирке» к экспериментам на живых организмах — гигантский шаг вперёд на пути к реальным генетическим опытам на людях.
Клеточное перепрограммирование
Перепрограммирование генетической системы клеток происходит под воздействием перепрограммирующих факторов. Проще говоря, с помощью препарат-индуцируемых вирусных трансгенов 0ct4, Sox2, Klf4 и с-Мус.
В результате некоторые соматические клетки обходят механизмы клеточного старения и в результате экспрессии 0ct4, Sox2, Klf4 и с-Мус превращаются в индуцированные плюрипотентные стволовые CiPSD клетки. В живом существе это означает омоложение организма со всеми сопутствующими эффектами — улучшением состояния различных систем и увеличением средней продолжительности жизни.
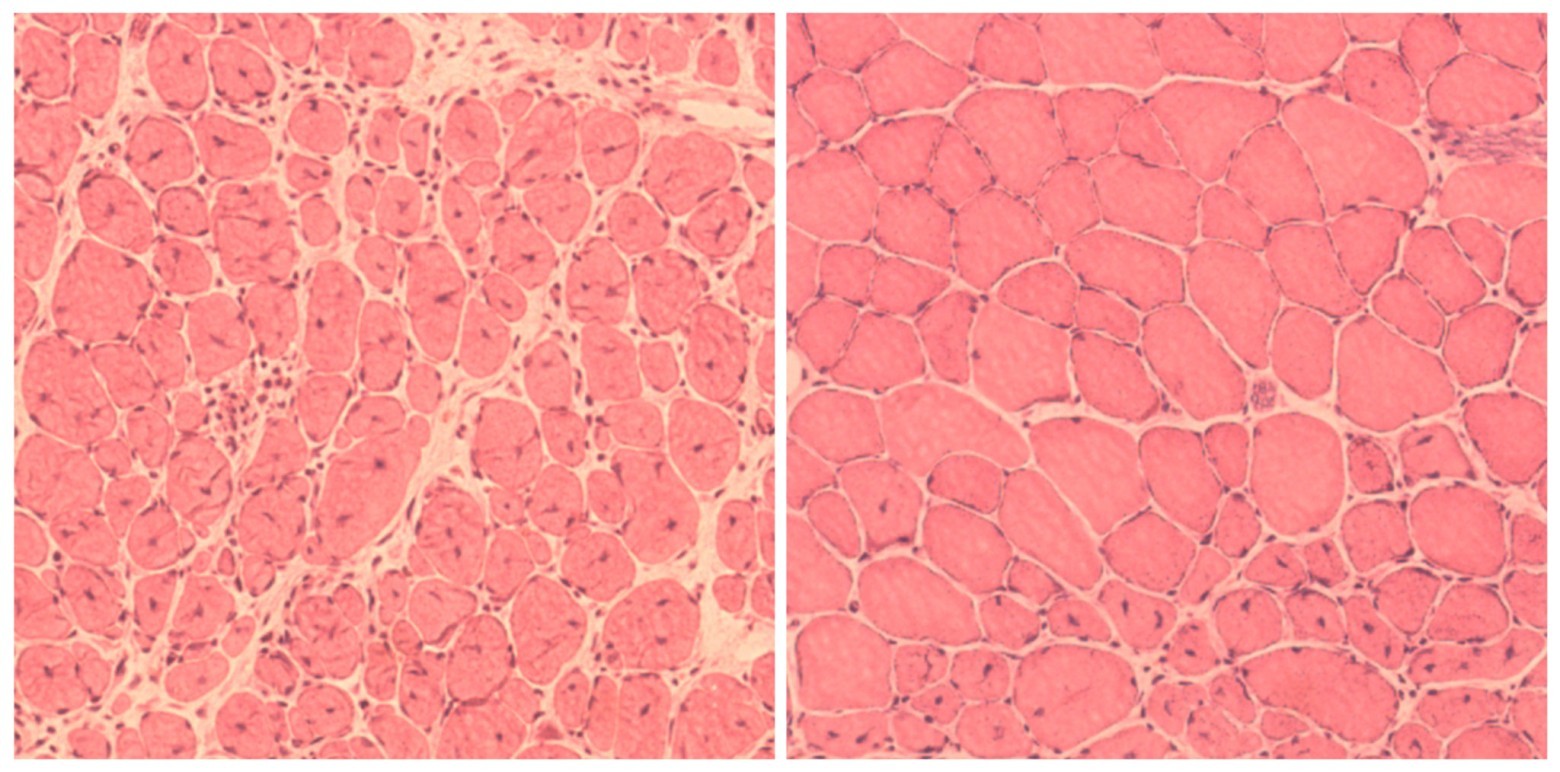
Мышечная ткань мыши до и после перепрограммирования клеток
В отличие от генной инженерии, здесь используются методы эпигенетики, то есть «включение» и «выключение» генов, которые уже есть в организме, без непосредственного изменения ДНК.
В данном случае экспрессия 0ct4, Sox2, Klf4 и с-Мус выполняет управляющую функцию. Эти конкретные гены активны только у эмбрионов, а у взрослого человека они не должны работать. Если же искусственно активировать их у взрослого человека, то обычные взрослые клетки перепрограммируются обратно в стволовые. Происходит регенерация тканей и биологический возраст организма как бы «уменьшается».
Эксперимент с омоложением пожилых клеток был успешно проведён в 2011 году in vitro. Сейчас его повторили in vivo, то есть в живом организме мыши. Учёным удалось найти такой способ циклической генной терапии, который устраняет побочные эффекты — преждевременную смертность и образование тератом — и реально продлевает жизнь мышей.
По мнению учёных, такой метод не будет работать в организме человека. Однако этот процесс позволит лучше понять фундаментальные причины старения и выявить непосредственные биологические факторы, из-за которого организм в определённый момент теряет способность к регенерации и размножению.
Причины старения
Начало деградации организма и старение — одна из самых больших загадок в биологии. Почему некоторые ткани организма регенерируют и никогда не стареют (например, репродуктивные клетки), а другие включают механизм деградации?
В данный момент у учёных нет единого мнения по поводу причин старения. Наиболее авторитетными считаются эволюционно-генетическая и эволюционно-физическая теории. Приверженцы первой теории считают, что старение вызвано накоплением мутаций в организме, в том числе под воздействием специальных плейотропных генов. Приверженцы второй теории считают, что старение возникает вследствие наиболее оптимального распределения ресурсов организма.
В любом случае, методами генной инженерии можно попробовать внести изменения и исправить ошибки во встроенных биологических программах. Если считать старение такой ошибкой, то и её теоретически можно исправить.
Относительно данного метода омоложения остаётся ещё много неисследованных вопросов. Во-первых, следует провести испытания на здоровых животных, а не только на мышах с врождённым пороком преждевременного старения. Во-вторых, следует убедиться, что омоложению подвержены в равной степени все органы. Например, что происходит в центральной системе, где замена клеток ограничена? Согласитесь, ведь никто не хочет остаться в молодом теле со здоровыми органами и сильными мышцами, но со старым мозгом.
Пока что не очень хорошо изучены и социальные последствия увеличения продолжительности жизни у всего населения или его части. Конечно, люди продолжат умирать на войнах, в ДТП, от несчастных случаев и от смертельных болезней. В итоге, никто не будет жить вечно, но предсказать продолжительность конкретного человека в отсутствие гарантированного старения будет очень проблематично. Если предположить, что старение организма отсутствует, то непонятно, на каком уровне устанавливать пенсионный возраст и начинать выплачивать пенсию. Вероятно, это не единственная проблема, с которой столкнётся человечество при увеличении средней продолжительности жизни.
Научная работа опубликована 15 декабря 2016 года в журнале Cell (doi: 10.1016/j.cell.2016.11.052, pdf).
Источник


